HMGB1在重症急性胰腺炎大鼠肺损伤中的表达及乌司他丁的干预效应*
2018-03-06王静黄忠魏尉候聪王霆宇罗红发自贡市第一人民医院消化内科四川自贡643000
王静 黄忠 魏尉 候聪 王霆宇 罗红发(自贡市第一人民医院消化内科,四川 自贡 643000)
重症急性胰腺炎(Severe acute pancreatitis,SAP) 死亡率高, 近年来有研究提示作为始发因子的肿瘤坏死因子(TNF-α)通过级联反应形成瀑布效应导致全身炎症反应综合征(SIRS)和多器官功能障碍综合征(MODS)的发生[1],而高迁移率族蛋白-1(HMGB1 )[2]作为晚期炎性介质,或许通过某些传导通路加重SAP,乌司他丁(ulinastatin)则可减少SIRS及MODS的发生并改善预后。其中急性呼吸窘迫综合征(Acute respiratory distress syndrome,ARDS)/急性肺损伤(Acute Lunginjury,ALI)为其最严重且最常见的并发症之一,能给予早期防治对降低其病死率意义重大。本研究试图通过SAP大鼠模型及采用乌司他丁干预,探讨HMGB1、TNF-α、白介素1β(IL-1β)在SAP大鼠胰腺炎肺损伤中的机理及乌司他丁的治疗作用。
1 材料与方法
1.1 实验动物与主要试剂 健康SD大鼠54只(雄性,清洁级,体质量200~250g);牛磺胆酸钠;乌司他丁;大鼠 HMGB1、TNF-α、IL-1β的ELISA试剂盒;大鼠HMGB1多克隆抗体。
1.2 动物分组及造模 SD大鼠54只,完全随机分为SAP组、治疗组及对照组三组,每组各18只,每组再各分为6、12和24h亚组(n=6)。①对照组:开腹后仅拨动胰腺组织。②SAP组:参照Zhang等[3]方法用制作SAP模型。③治疗组:于SAP大鼠尾静脉注射乌司他丁予以治疗。
1.3 各指标的测定及方法 于6、12和24h分别处死各组大鼠,提取血清及胰腺、肺组织,血清用于ELISA检测;胰腺及肺组织用于病理学检测,其中胰腺组织行免疫组化检测及ELISA检测。
1.4 胰腺及肺病理观察 胰腺按Schimidt法[4]评分 将肺按Frank法[5]评分 ,EPS-G7法检测动脉血气分析;ELISA法检测血清、肺、胰中的HMGB1蛋白浓度;ELISA法检测血清中的TNF-α、IL-1β蛋白浓度;免疫法检测胰腺组织中的HMGB1,免疫组化结果判定[6]:结果判定在放大400倍的条件下。细胞膜或胞浆内棕黄色颗粒为(+),选择10个高倍视野,据HMGB1阳性细胞与总细胞数比值定为0~4分:阳性细胞数<5%记0分,阳性细胞数5%.25%记1分,阳性细胞数26%.50%记2分,阳性细胞数5l%.75%记3分,阳性细胞数>75%记4分。

2 结果
2.1 3组大鼠胰腺组织病理改变 ①胰腺组织:对照组大鼠胰腺镜下无明显变化;镜下可见SAP组胰腺小叶间水肿、破坏、出血、炎性细胞浸润、坏死。SAP组、治疗组评分明显高于对照组且具有统计学意义(P<0.05),见图1。② 肺组织:对照组大鼠胰腺及镜下无明显变化;SAP组大体可见,肺表面呈暗红色,可伴胸腔少量积液;SAP组可见肺间隔增宽,肺组织水肿、出血、肺泡腔融合、大量炎性细胞积聚甚至肺实变,SAP组及治疗组肺病理改变随时间延长而加重,严重程度:24>12>6h,差异有统计学意义(P<0.05),各组大鼠肺病理评分,见表1。③ 胰腺组织HMGB1表达见图2。

图1 3组大鼠胰腺组织病理HE染色(×400)Figure 1 Histopathological changes of pancreas in three groups observed by HE staining (× 400)
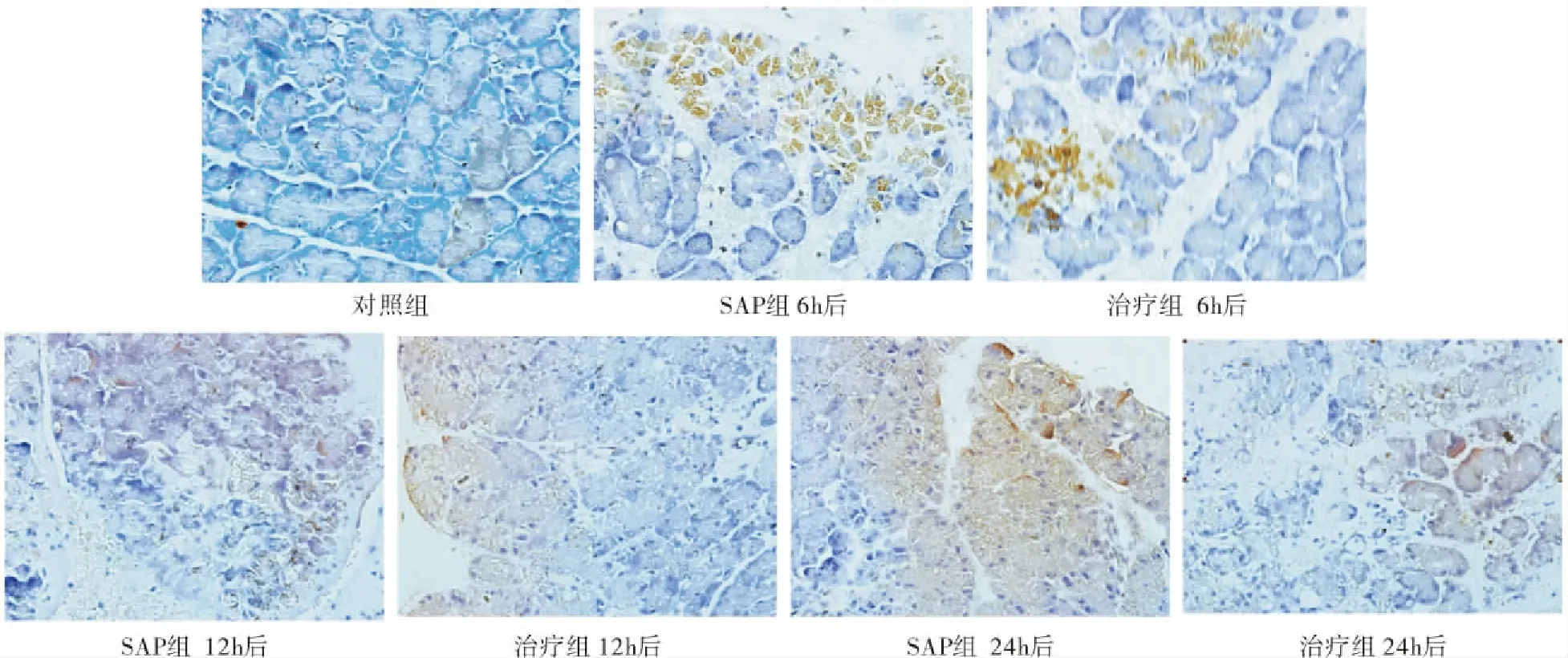
图2 3组大鼠胰腺组织中的HMGB1表达(EnVision两步免疫组织化学法×400)Figure 2 HMGB1 expression in pancreatic tissue of three groups (× 400)
2.2 血氧分压测定 SAP组、治疗组血氧分压数值明显低于对照组且差异有统计学意义(P<0.05);治疗组数值明显高于SAP组且低于对照组,差异有统计学意义(P<0.05),见表1。
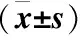
Table1Comparisonofthepathologicalscoresofthepancreasandlungtissueandthechangeofbloodoxygenpartialpressure

组别术后时间(h)胰腺组织肺组织血氧分压(mmHg)对照组61.21±0.222.33±0.1989.33±3.99121.33±0.212.47±0.2288.47±4.29241.39±0.252.66±0.2587.64±4.75SAP组68.11±0.70①3.88±0.30①78.64±7.31①1210.60±0.69①4.82±0.41①72.45±8.67①2412.12±0.73①5.75±0.39①67.34±7.6①治疗组65.37±0.18①②2.91±0.33①②85.71±7.12①②127.77±0.36①②3.46±0.19①②80.42±6.73①②249.88±0.56①②4.65±0.23①②74.92±7.55①②
注:与对照组同期比较,①P<0.05;与SAP组同期比较,②P<0.05
2.3 ELISA法检测血清、胰腺及肺中的HMGB1蛋白浓度 各浓度在6~24h持续上升,与对照组比较升高,差异均有统计学意义(P<0.05),治疗组与 SAP组比较降低,差异有统计学意义(P<0.05),见表2。
2.4 ELISA法检测血清TNF-α、IL-1β蛋白浓度 SAP组、治疗组的血清中的TNF-α、IL-1β蛋白浓度在6h 至2h继续升高,于24h下降,与对照组比较升高,差异均有统计学意义(P<0.05),治疗组与 SAP组比较降低,差异有统计学意义(P<0.05),见表3

Table2HMGB1proteinconcentrationinserum,pancreasandlungtissue

组别术后时间(h)血清中的HMGB1(ng/ml)胰腺中的HMGB1(ng/ml)肺中的HMGB1(ng/ml)对照组698±15.6150±13.7112±14.112103±16.2155±14.9123±17.524110±13.4177±15.5136±20.3SAP组6223±11.5①233±17.1①192±27.7①12287±20.9①337±18.7①273±23.3①24362±19.3①375±22.5①308±24.9①治疗组6223±15.8①②205±20.8①②172±19.5①②12241±17.5①②280±16.3①②221±23.4①②24279±21.6①②304±23.5①②259±18.3①②
注:与对照组同期比较,①P<0.05; 与SAP组同期比较,②P<0.05

表3 各组大鼠血TNF-α、IL-1β水平比较Table 3 The blood TNF-α and IL-1β in each group
注:与对照组同期比较,①P<0.05; 与SAP组同期比较,②P<0.05
2.5 胰腺中HMGB1表达(免疫组化) 在对照组少量腺泡细胞胞浆表达,SAP组胰腺腺泡胸次浆及胞核可见HMGB1强表达:SAP组>治疗组>对照组,从6~24h持续上升,见表4。
Table4ThepancreaticHMGB1positivecellsscorewithimmunocytochemistry
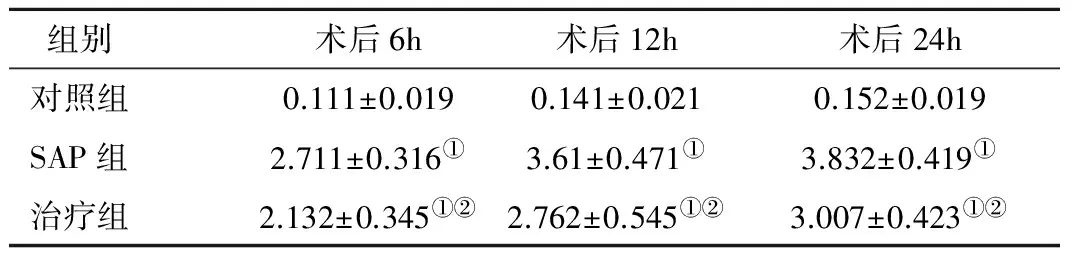
组别术后6h术后12h术后24h对照组0.111±0.0190.141±0.0210.152±0.019SAP组2.711±0.316①3.61±0.471①3.832±0.419①治疗组2.132±0.345①②2.762±0.545①②3.007±0.423①②
注:与对照组同期比较,①P<0.05; 与SAP组同期比较,②P<0.05
3 讨论
HMGB1为非组DNA结合蛋白,可通过多途径促使炎症反应增强,致炎症失控迁延[7]。Mouri[8]等从基因水平揭露HMGB1与其他炎性介质相互加强的分泌效应及其相关的分泌调节网络。细胞受损坏死时, 核内HMGB1释放到细胞外激活免疫及炎性反应,致单核等细胞分泌炎性因子。而炎性因子刺激HMGB1分泌成为正反馈环路, 再加重炎症反应[9]。
SAP病死率高,1周内病死者多为ARDS/ ALI所致。因此,在SAP早期降低肺损伤具有十分重要的意义。TNF-α和 IL-1β为SAP早期促炎因子,在肺损伤中TNF-α和IL-6主要作用是使聚集中性粒细胞并激活释放氧自由基且损伤其内皮细胞[10]。c-Jun氨基端激酶(JNK)为SAP加重的关键介质之一,各类炎症因子可激活JNK信号通路,而该通路激活又可反过来进一步加重炎症反应[11]。研究发现[12]炎症因子如TNF-a、IL-1等引起的JNK信号通路激活可通过上调激活蛋白-1(AP-1)的转录活性,促进肺损伤发生。有研究[13]证实JNK信号通路在SAP相关肺损伤中起关键作用,TNF-a可诱导单核因子如IL-1β、IL-6合成,触发炎症级联反应[14]。
本实验表明SAP胰腺损伤与HMGB的异常表达有关。同时,HMGB1表达上升比TNF-α和 IL-1β晚:胰腺中和血清及胰腺组织中的HMGB1数据显示,从6~24 h持续上升,进一步证明HMGB1为晚期炎性介质。Yuan[15]等研究显示,HMGB1可能以关键性的晚期炎症因子参加了SAP的炎症反应及各器官损害。也有学者证实HMGB1可进一步加重体液外渗,形成胰源性腹水[16],杨智勇等[17]则发现SAP组大鼠血清TNF-α和 IL-1β水平在建模后迅速升高,在6~12 h持续上升,24小时开始下降,本研究也进一步证明TNF-α和 IL-1β为早期炎性介质。
乌司他丁对胰蛋白酶等多种酶有抑制作用,还能抑制溶酶体酶的释放,清除氧自由基,阻断中性细胞聚集,抑制炎症因子及介质的释放[18],减轻SAP中SIRS反应并预防肺损伤的发生。杨野等[19]实验显示作为晚期炎性介质的HMGB-1可能参与了SAP肝损伤的过程;李梁等[20]运用meta分析显示,乌司他丁治疗SAP的疗效胜于常规治疗,其效果主要出现在病程中晚期。本实验进一步证实乌司他丁能有效治疗SAP。
4 结论与启示
SAP大鼠胰腺中的致炎作用可能是由早期炎症因子TNF-α、 IL-1β等激活JNK信号通路,且促炎因子促使HMGB1分泌形成正反馈环路,HMGB1可通过级联反应形成瀑布效应,最终使炎症失控迁延。而乌司他丁可能是通过降低SAP大鼠胰腺组织中的HMGB1、TNF-α、 IL-1β的表达及中断JNK信号通路而发挥保护作用。因此,通过降低HMGB1及TNF-α、 IL-1β的表达及中断JNK信号通路为治疗靶点,可望用于治疗SAP。
[1]吴灏,孙婧,苏红,等.连续性肾脏替代疗法治疗重症急性胰腺炎合并急性肾损伤患者的临床分析[J].内科急危重症杂志,2011,17,(2):84-87.
[2]Wang H, Li W, Goldstein R,etal. HMGB1 as a potential therapeutic target [J]. Novartis Found Symp,2007,280(1):73-85.
[3]Zhang JX,Dang SC,Qu JG,etal.Preventive effect of tetramethylpyrazine on intestinal mucosal injury in rats with acute necrotizing pancreatitis [J].World J Gastroenterol, 2006, 12(39):6386-6390.
[4]Schmidt J,Rattner DW,Lewandrewshi K,etal.A better model of acute pancreatitis for evaluating therapy[J].Ann Surg,1992,215 (1):44-56.
[5]Frank JA,Pittet JF,Wray C,etalProtection from exper-miental ventilator-induced acute lung injury by IL-1 receptor blockade[J].Thorax,2008,63(2):147-153.
[6]史学深,方驰华,朱明德,等.重症急性胰腺炎大鼠DDFA对肺损伤细胞凋亡及Bax,Bcl-2表达的影响[J].第四军医大学学报,2006,27,(2):1093-1096.
[7]Yan Yu, Min Xie, Rui Kang,etal.HMGB1 is a therapeutic target for leukemia[J].Am J Blood Res, 2012, 2(1): 36-43.
[8]Mouri F,Tsukada J,Mizobe T,etal.Intracellular HMGB1 transactivates the human IL1B gene promoter through association with an Ets transcription factor PU.1[J].Eur J Haematol,2008,80:10-19.
[9]刘旺华,李花,肖献忠. 高迁移率族蛋白B-1与炎症关系的研究进展 [J]. 中国病理生理杂志, 2008,24 (8):1656-1660.
[10] 王彬,张晓华.细胞因子在重症急性胰腺炎合并急性肺损伤中的 作用[J].医学研究生学报,2012,25(11):1208-1212.
[11] Minutoli L,Altavilla D,Marini H,etal.Protective effects of SP600125 a new inhibitor of c-jun N.terminal kinase (JNK)and extracellular-regulated kinase(ERKl/2)in an experimental model of cerulein·induced pancreatitis[J]. Life Sci,2004,75(24):2853-2866.
[12] Kanagawa F,Takahashi T,Inoue K,etal.Protective effect of carbon monoxide inhalation on lung injury after hemorrhagic shock/resuscitation in rats[J].J Trauma, 2010,69(1):185-194.
[13] Liu M,Shi L,Chen M,etal.Effects of c-Jun N-terminal kinase signaling pathway on severe acute pancreatitis· associated lung injury[J].Pancreas,2012,41(3):358-366.
[14] 石亮亮,刘明东,朱浩,等.丹参酮ⅡA磺酸钠对急性坏死性胰腺炎大鼠肺损伤的抗炎作用及其机制研究[J].胃肠病学,2014,19,(06):332-335.
[15] Yuan H,Jin X,Sun J,etal. Protective effect of HMGB1 a box no organ injury of acute pancreatitis in mice [J]. Pancreas,2009,38(2):143-148.
[16] Wanten G,Kusters A,van Emst-de Vries SE,etal.Lipid effects on neutrophil calcium signaling induced by opsonized particles:platelet activating factor is only part of the story[J].Clin Nutr,2004,23(4):623-630.
[17] 杨智勇,王春友,熊烱圻. 重症急性胰腺炎大鼠血清高迁移 率族蛋白-1水平的时相变化及意义[J]. 华中科技大学学报:医学版,2004,33(4):466-468.
[18] Park W Y, Goodman R B, Steinberg K P,etal. Cytokine balance in the lungs of patients with acute respiratory distress syndrome[J]. Am J Respiratory Crit Care Med,2001,164(1) : 1896.
[19] 杨野,栾正刚, 郭仁宣. 重症急性胰腺炎大鼠肝组织HMGB1 表达与肝功能损害的关系[J]. 中国医科大学学报, 2008,6(37):343-345.
[20] 李梁, 郑立君. 乌司他丁治疗急性重症胰腺炎的meta分析[J]. 同 济大学 学报 ( 医学 版 ), 2013,2(34):62-68.
