甲基橙氧化褪色光度法测定食盐中碘酸钾的改进
2018-03-06韦后明
韦后明
(广西现代职业技术学院 资源工程系,广西 河池 547000)
碘是人体必需的元素之一,缺碘会引起甲状腺肿(大脖子病)。食盐中加碘酸钾,是缺碘地区人们补碘的主要来源之一,因此准确测定食盐中碘酸钾含量具有实用意义。目前测定食盐中碘酸钾的方法较多,利用碘酸钾具有氧化性氧化染料褪色分光光度法近年来得到了快速的发展,其中甲基橙氧化褪色光度法有不少学者进行了研究,文献[1-4]是硫酸-甲基橙-溴化钾体系,在溴化钾催化作用下,碘酸钾氧化甲基橙溶液褪色;文献[5]是盐酸-甲基橙-溴化钾体系,也是在溴化钾催化作用下,碘酸钾氧化甲基橙溶液褪色;文献[6]是盐酸-甲基橙体系,通过水浴加热使碘酸钾氧化甲基橙溶液来实现褪色反应,反应的水浴温度在文献中没有给出。本文介绍的是在文献[6]的基础上,优化盐酸-甲基橙体系分光光度法测定碘酸钾的条件,并用于测定食盐中微量碘酸钾。方法对仪器要求简单,容易操作,重现性好,准确度高,结果令人满意。
1 实验部分
1.1 主要仪器与试剂
UV-1800PC紫外可见分光光度计 上海美谱达仪器有限公司。
甲基橙标准溶液(100.0 μg/mL):准确称取0.1000 g甲基橙于烧杯中,加适量水,加热溶解完全,冷却后移入1000 mL容量瓶中,用水定容至刻度,摇匀。
碘酸钾标准溶液(1.00 mg/mL):准确称取0.1000 g碘酸钾于烧杯中,加适量水溶解完全后移入100 mL容量瓶中,用水定容至刻度,摇匀。临用前稀释成10.0 μg/mL标准工作液。
盐酸溶液(6 mol/L):浓盐酸与水按1∶1比例配制。
以上所用试剂均为分析纯,配制溶液及以下实验用水均为高纯水。
1.2 实验方法
在2支同一型号的25 mL具塞比色管中,分别加入100.0 μg/mL甲基橙标准溶液1.50 mL,6 mol/L盐酸溶液10 mL,其中1支加入含一定量的碘酸钾溶液,另1支不加碘酸钾做空白试验,加水至刻度,摇匀。同时放入沸水浴中加热5 min,冷却至室温。用1 cm比色皿,以水为参比溶液,在波长507 nm处,测定吸光度,其中空白的为A0,含碘酸钾的为A,计算△A=A0-A的值。
2 结果与讨论
2.1 吸收光谱
按实验方法,在波长400~700 nm范围内扫描不含碘酸钾与含有碘酸钾溶液的吸收光谱,根据扫描结果,以波长λ(取400~650 nm)为横坐标,吸光度A为纵坐标,绘制出吸收光谱曲线,结果见图1。

图1 吸收光谱图Fig.1 Absorption spectrogram
注:1为空白试验吸收光谱; 2为含碘酸钾试验吸收光谱。
由图1可知,曲线1和曲线2最大吸收波峰均在507 nm处,而且曲线2相对于曲线1最大吸收波峰明显降低,另外两条曲线的形状非常相似,显然是单纯的褪色反应。因此,本实验采用波长507 nm作为测定波长。
2.2 甲基橙用量的影响
甲基橙用量的影响主要以得到较大的△A值并且稳定为依据,按实验方法经多次实验表明,甲基橙用量越大,△A值越大,当使用甲基橙标准溶液1.50 mL时△A值较大且稳定,当甲基橙溶液用量太大时,空白吸光度值太大,偏离比尔定律。因此本实验选用100.0 μg/mL甲基橙标准溶液1.50 mL。
2.3 酸度的影响
碘酸钾在强酸性条件下才表现出较强的氧化性,本试验取6 mol/L盐酸溶液在不同用量下进行碘酸钾氧化甲基橙溶液褪色试验,实验结果见图2。

图2 酸度的影响Fig.2 The effect of acidity
由图2可知,当加6 mol/L盐酸溶液的量在0~3 mL时,△A的值变化量很小;当加入量为4~7 mL时,△A的值变化量随着盐酸溶液加入量增多而逐渐变大;当盐酸溶液用量为7~12 mL时,△A值达到恒定。因此,本实验采用加入6 mol/L盐酸溶液为10 mL作为碘酸钾氧化甲基橙溶液时的控制酸度。
2.4 温度的影响
反应速度一般随着反应温度升高而加快,考察温度的变化对实验的影响主要是在一时间内△A值达到最大而且稳定。按实验方法,在不同温度下进行试验反应求出△A,并以温度为横坐标,△A为纵坐标作图,结果见图3。

图3 反应温度的影响Fig.3 The effect of reaction temperature
由图3可知,△A值随温度升高而逐渐增大,当温度超过90 ℃以后其△A值不再变化,达到恒定,为容易控制反应温度一致,故本实验温度选择在沸水浴中进行。
2.5 反应时间的确定
反应时间的确定其实与反应温度有关,当反应温度设定在沸水浴中进行后,按实验方法分别在不同的反应时间段测定其吸光度,并计算△A值,实验结果见图4。
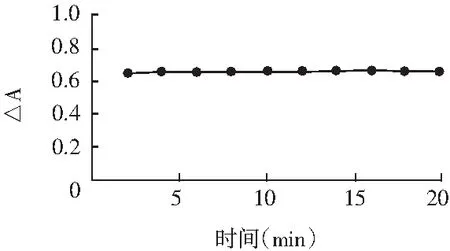
图4 反应时间的确定Fig.4 The effect of reaction time
由图4可知,反应进行得较快,反应2 min即可完成反应,并且实验至20 min后△A值都很稳定,几乎没有变化。为确保反应完全,本实验选用时间为5 min。
2.6 共存离子的干扰
按实验方法,当NH4+,Al3+,Zn2+,Cu2+,Mg2+,Ca2+,SO42-离子浓度为500 μg/mL,Fe3+离子浓度为200 μg/mL,相对误差少于5%时,对实验离子不干扰;而NO3-,BrO3-离子严重干扰,不允许存在。
2.7 工作曲线
按实验方法,在一组比色管中准确加入不同量的碘酸钾标准溶液,测定其吸光度并求出△A,以碘酸钾的浓度为横坐标,△A为纵坐标,绘制工作曲线,见图5。

图5 工作曲线Fig.5 Working curve
由图5可知,溶液中碘酸钾浓度在0~2.0 μg/mL范围内与吸光度呈良好的线性关系。其线性回归方程为:△A=0.403c+0.0059(式中:c为碘酸钾的浓度,μg/mL),相关系数为0.9995。
3 样品测定及回收率试验
本样品从超市随机购买加碘盐,包装袋上注明加入的含碘物为碘酸钾,营养成分表中碘元素含量为2250 μg/100 g。根据食盐中碘酸钾含量称取适量的样品,本实验准确称取样品16.0 g,加水溶解后移入100 mL容量瓶中,用水稀释至刻度,摇匀。按实验方法准确移取试样溶液5.00 mL进行实验,根据测定的吸光度按线性回归方程计算比色管中碘酸钾含量,并换算为样品中碘酸钾含量。
准确移取试样溶液3.00 mL、10.0 μg/mL碘酸钾标准溶液2.00 mL,按实验方法测定其吸光度,计算出比色管中碘酸钾的总浓度,并计算回收率,实验结果见表1。

表1 样品测定结果 (n=10)Table 1 Sample determination results(n=10)
由表1可知,样品中营养成分碘元素含量为2257 μg/100 g,与食盐包装袋标志一致。
4 结论
采用碘酸钾氧化甲基橙溶液褪色分光光度法测定食盐中碘酸钾含量最佳条件为:100.0 μg/mL甲基橙溶液用量1.50 mL,6 mol/L盐酸溶液用量10 mL,在沸水浴中与碘酸钾反应5 min。由于化学试剂溴化钾中常含有微量的溴酸盐,而BrO3-离子严重干扰,不允许存在,所以不采用溴化钾做催化作用。本法是一种比较简单、快速、准确测定食盐中碘酸钾含量的方法。
[1]周坚勇,罗力军,何建丽,等.甲基橙氧化褪色吸光光度法测定碘的研究[J].理化检验(化学分册),1997,33(6):251-252.
[2]陈炳灿,唐洪,蒋炜.甲基橙褪色分光光度法测定酱油中微量碘[J].中国交通医学杂志,2005,19(2):175-176.
[3]余建平,林燕.甲基橙褪色光度法测定加碘盐中微量碘[J].赣南师范学院学报,2005(6):49-50.
[4]刘焕云,马同锁,刘康乐.甲基橙氧化褪色光度法测定微量碘的研究[J].化学世界,2006(4):212-214.
[5]姚武,吴升红.甲基橙氧化褪色光度法测定食盐中的碘[J].黄山学院学报,2007,9(5):30-32.
[6]王振华.甲基橙法测定加碘盐中碘含量[J].辽阳石油化工高等专科学校学报,1997,13(4):27-32.
