豆瓣酱产毒黄曲霉高效拮抗菌筛选鉴定
2018-03-06彭漪杨继鸿梁凤英李同灵王芳张硕刘松青
彭漪,杨继鸿,梁凤英,李同灵,3,王芳,张硕,刘松青*
(1.成都师范学院 化学与生命科学学院,成都 611130;2.四川农业大学 资源学院,成都 611130;3.西华师范大学 生命科学学院,四川 南充 637002)
豆瓣酱作为食品调味产业的传统主导产业,色、香、味俱佳,是川菜必备的调味佳品。它以蚕豆瓣、面粉和本地优质鲜椒为生产原料,采用精细、独特的传统工艺自然发酵,时间长、工序多,不少环节易受黄曲霉
污染致使黄曲霉毒素超标,不但造成豆瓣酱大量感染,产生的黄曲霉毒素B1更具强烈致癌、致畸和致突变的危害,对人及动物肝脏组织会造成破坏,严重的可导致肝癌甚至死亡[1],对人类健康存在较大威胁。抑制黄曲霉的产生,降低或完全去除豆瓣中黄曲霉毒素成为豆瓣酱必须要解决的问题。
大多数豆瓣酱采用米曲霉作为动力微生物,主要是因为米曲霉可以产生丰富的酶系。米曲霉产生的酶系主要包括蛋白酶、脂肪酶、淀粉酶及纤维素酶等[2]。这些酶系使得豆瓣中富含氨基酸、芳香酯和抗氧化物质等多种营养成分及风味物质[3,4]。蛋白酶是米曲霉酶系中最重要的酶之一,直接影响原料的蛋白利用率和最终产品的风味[5]。氨基酸态氮(AN)是蛋白质的分解产物,是评价调味食品的质量及营养价值的一项主要指标,它能使豆瓣酱鲜味柔和,并调和香气,增进色泽,在发酵性食品的分析中有重要的意义[6,7]。同时米曲霉也可能影响黄曲霉的生长、繁殖和产毒,如徐丹等发现米曲霉能够有效抑制黄曲霉合成AFB1[8]。
对于发酵食品中黄曲霉菌株及黄曲霉毒素B1的抑制目前多采用一些物理的或化学的方法,不仅效果欠佳,还会造成二次污染[9-13]。目前,许多国外的研究均致力于利用微生物抑制黄曲霉,但是,国内对黄曲霉及其毒素的研究主要集中在优化黄曲霉毒素的检测方法上,在传统发酵食品中,利用生物防治黄曲霉的报道极少[14]。
本研究拟从制曲的豆瓣中分离筛选黄曲霉拮抗菌并考察其对黄曲霉毒素AFB1合成的抑制作用,达到天然抗菌的目的,以期抑制豆瓣酱中黄曲霉菌生长并降低其产毒量。同时,从制曲的豆瓣中分离筛选对黄曲霉有拮抗作用的米曲霉,研究米曲霉降解AFB1的能力,并初步比较了不同米曲霉发酵豆瓣中氨基酸态氮的含量,从而为提高豆瓣酱营养、风味和安全性研究提供科学依据。
1 材料与方法
1.1 材料
1.1.1 实验样品材料
蒸煮拌面制曲发酵后蚕豆瓣子(简称霉瓣子):由四川某豆瓣厂提供。
1.1.2 主要试剂
黄曲霉毒素B1酶联免疫定量测试盒:无锡百奥深科技有限公司生产; Biomiga gDNA kit:美国Biomiga公司生产;引物合成:27F:5'-AGAGTTTGATCCTGGCTCAG-3';1492R:5'-GGTTACCTTGTTACGACTT-3';mqumITSL,mqumITSR,引物由上海生工生物工程有限公司合成。
1.1.3 主要设备
酶标仪(DNM-9602):北京普朗新技术有限公司。
1.1.4 培养基
分离筛选用培养基见表1。

表1 黄曲霉拮抗菌选择培养基及其配方
1.2 拮抗菌分离及筛选
称取霉瓣子5 g,无菌状态下粉碎,无菌生理盐水梯度稀释,取不同梯度稀释液 0.1 mL于培养皿中,分别浇注牛肉膏蛋白胨培养基、MRS、YPD、PDA、查氏分离培养基, 30 ℃培养 48 h。待菌落长出后挑取单菌落纯化,将纯化好的菌株于 4 ℃保藏备用。
取黄曲霉孢子悬浮液10-1,0.2 mL涂布于蚕豆天然培养基上,将牛津杯垂直置于培养基表面并轻压,加入上述细菌菌株悬浮液10-1,0.2 mL,28 ℃培养3~5天,分别进行3个重复,观察生长状况及抗菌情况。
刮取黄曲霉试管斜面上孢子,制作成50 mL的菌悬液,稀释200 倍,从中取出1 mL均匀涂布在制好的查氏培养基、PDA培养基上。等到菌液完全固定后,用打孔器在米曲霉边缘打成5 mm的菌饼,每个培养基接1 种米曲霉,1个培养基做3个重复。30 ℃培养,观察并记录拮抗情况。
1.3 米曲霉对黄曲霉毒素AFB1的降解能力
将1 mL米曲霉孢子悬浮液与AFB1同时接入50 mL查氏培养基中,于28 ℃,150 r/min,摇床培养5天,检测AFB1的含量;同时以只含AFB1的查氏培养基作为对照。采用固相酶联免疫吸附方法(ELISA)测定黄曲霉毒素含量,450 nm酶标仪读数, 对照标准曲线计算AFB1含量,实验重复3次。
1.4 不同米曲霉发酵豆瓣中氨基酸态氮含量的比较
干豆瓣煮30 min,剖皮后,掰成2瓣。将米曲霉制成孢子悬浮液,分别喷洒于各份豆瓣上,搅拌混匀,28 ℃发酵培养7天后,再用盐水浸泡10天,每种菌株做3个重复。发酵完成后采用甲醛法测定其氨基酸态氮含量。
1.5 菌株的鉴定
1.5.1 形态鉴定
把筛选出的菌株培养于MRS培养基,观察它的菌落特征,结合《伯杰氏细菌鉴定手册(第 8 版)》初步鉴定。
1.5.2 分子鉴定
1.5.2.1 细菌分子鉴定
选用美国Biomiga公司Bacterial gDNA kit按照以下方法提取细菌总DNA。
基尼英语指从英格兰东北部的纽卡斯尔到泰恩河之间的区域,人们所讲的方言。这一地区的人也叫作基尼人。基尼英语也可泛指英格兰东北部的口音和方言。
DNA提取后纯化,进行16S rRNA PCR扩增,引物为27F:5'-AGAGTTTGATCCTGGCTCAG-3';1492R:5'-GGTTACCTTGTTACGACTT-3'。以总DNA为模板,选用27F和1492R两段引物来扩增16S rDNA。
PCR反应体系均为50 μL体积,反应体系组成如下:
2×PCR Mix 25 μL,
27F(10 μmol/L) 1.0 μL,
1492R(10 μmol/L) 1.0 μL,
DNA模板(50 ng/mL) 2.0 μL,
ddH2O 加至50 μL。
按上述组分配制反应液分装于200 mL PCR管中,加入DNA模板混匀后进行PCR反应。
PCR扩增的反应程序为:
1.5.2.2 米曲霉分子鉴定
采用CTAB法提取米曲霉菌总DNA,具体如下:将5种菌株分别接种于查氏培养基,置于30 ℃培养。4天后,用高压灭菌的尖头镊子取一定量菌丝于灭菌EP 管内, 依次用无菌生理盐水、20 mmol/L EDTA及无菌水漂洗, 然后用无菌的吸水纸将菌丝吸干。加20 mmol/L Tris·HCl 和20 mmol/L EDTA 各10 μL,放于-70 ℃,冰冻30 min 后,用灭菌后的研钵研磨5~10 min。重复上述冰冻研磨步骤。研磨后冰浴2~3 min,用重蒸水将研磨液稀释。
加2% CTAB,100 mmol/L Tris·HCl (pH 8.0),20 mmol/L EDTA(pH 8.0),1.4 mol/L NaCl,65 ℃水浴45~60 min。加入等体积的酚∶氯仿∶异戊醇(25∶24∶1),颠倒混匀,12000 r/min 离心25 min。取上层水相再加入0.6倍体积冰冷的异丙醇,颠倒混匀,4 ℃放置20 min,10000 r/min 离心10 min,弃上清液,70%乙醇洗涤沉淀2 次。最后提取的DNA溶于30 μL TE缓冲液中。
DNA提取后纯化,进行PCR 扩增,引物为米曲霉ITS区全长序列mqumITSL和mqumITSR。
PCR反应体系均为50 μL体积,反应体系组成如下:
DNA模板链 2 μL,
2×Taq master mix 25 μL,
hqum-caIS 1 μL,
hqum-caIR 1 μL,
ddH2O 加至50 μL。
按上述组分配制反应液,分装于200 mL PCR管中,加入DNA模板混匀后进行PCR反应。
PCR扩增的反应程序为:

PCR反应产物的检测:扩增产物用含有EB的0.8%琼脂糖凝胶电泳检测。将每个PCR产物3 μL与溴酚蓝1 μL混合点样,100 V电泳30 min。UV下观察,检测扩增片段的长度和浓度。扩增片段长度为1.5 kb左右。将扩增产物保存于-20 ℃备用。
PCR 产物采用1%琼脂糖凝胶电泳检测后,将PCR产物送擎科生物有限公司测序,测序结果采用BLAST在Gen Bank进行比对,查找同源性高的相关基因序列,最后通过MEGA 5.05软件构建系统发育树。
2 结果与分析
2.1 黄曲霉拮抗菌株的筛选
2.1.1 黄曲霉拮抗菌株的筛选——细菌
从霉豆瓣中分离得到75株菌株,利用牛津杯实验筛选得到40株对产毒黄曲霉有抑制作用的菌株,其中10株抑制效果明显,见表2。
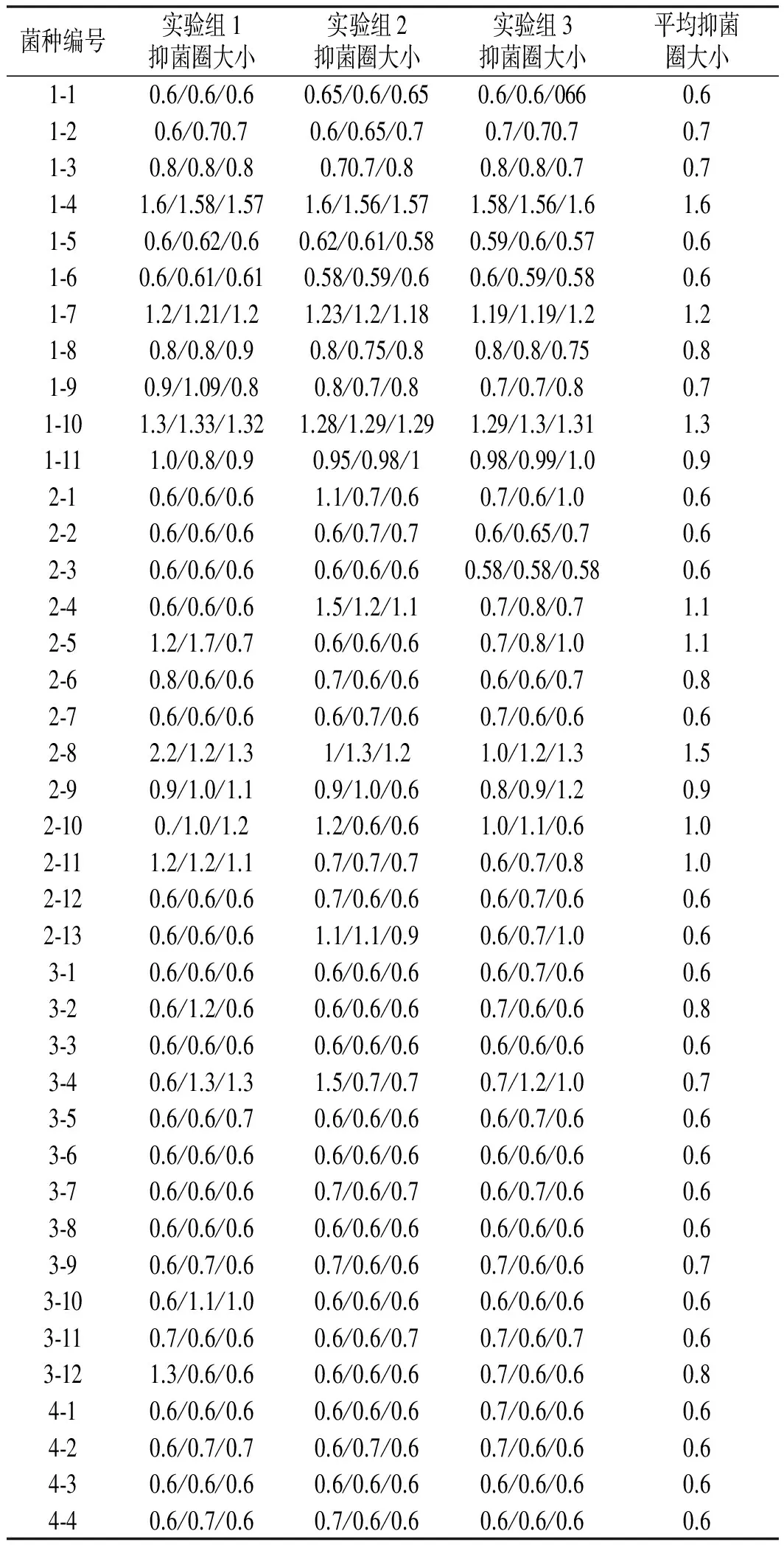
表2 黄曲霉拮抗菌抑菌效果 cm
在牛津杯筛选实验中,一方面黄曲霉菌开始生长,另一方面待测菌呈球面扩散,离杯越近,待测菌浓度越大,离杯越远,待测菌浓度越小。随着待测菌浓度减小,有一条最低抑菌浓度带,在带范围内,黄曲霉菌不能生长,而呈透明的圆圈,形成“抑菌圈”,见图1。

图1 6株高效拮抗菌对产毒黄曲霉的抑制作用
注:a为7号菌,b为3号菌,c为8号菌,d为9号菌,e为1号菌,f为2号菌;黄色箭头所指为黄曲霉,红色箭头所指为牛津杯,黑色箭头所指形成的抑菌圈,影印效果无法呈现,详情询本社编辑部。
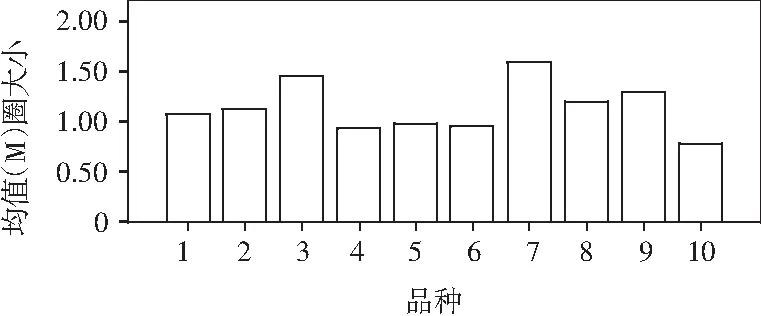
图2 1~10号菌抑菌圈大小
抑菌圈越大,抑菌效果越好,表明此待测菌为黄曲霉有效拮抗菌。由表2可知,2-4,2-5,2-8,2-9,2-10,2-11,1-4,1-7,1-10,3-2抑菌圈较大,最大值达1.6 cm,抑菌效果明显,是黄曲霉的高效拮抗菌,对其依次进行重新编号:1~10号。
对1~10号菌抑菌圈大小进行显著性差异分析,由表3可知,显著性差异范围为0.79 f~1.60 a;其中7号与3号,3号与9号,9号与8,2号,8号与2,1号,2号与1,5,6,4号,1号与5,6,4,10号无显著性差异;而7号与10号显著性差异最大,7号为1.60 a,10号为0.79 f,相差0.81。由图2可知,7号抑菌圈最大,3号次之,10号最小,平均抑菌圈大小在1.00 cm左右。

表3 1~10号菌抑菌圈大小显著性差异分析(α=0.05)
2.1.2 黄曲霉拮抗菌株的筛选——米曲霉
通过培养皿内对峙试验,从19株米曲霉中筛选到对黄曲霉有拮抗作用的菌株5 株,占到菌株总数的26%。培养7天后,测定各菌株的抑菌圈直径,结果显示抑菌圈直径都达到10 mm以上。其中菌株1P-1,2C-3抑菌圈直径较大,分别达到了18,16 mm,见表4和图3。

表4 米曲霉对黄曲霉的抑制效果 mm
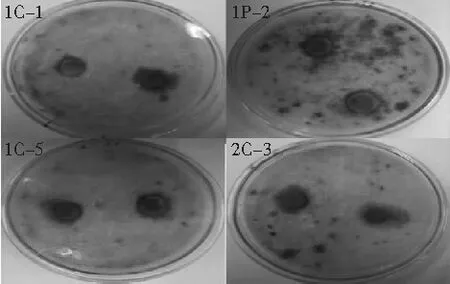
图3 米曲霉对黄曲霉的抑制效果
2.2 米曲霉对黄曲霉毒素AFB1的降解能力
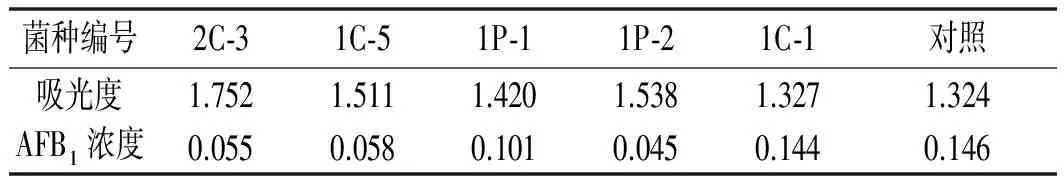
表5 米曲霉对黄曲霉毒素AFB1的降解能力测定

图4 米曲霉对黄曲霉毒素AFB1的降解率测定
由表5可知,实验组AFB1浓度均低于对照组,说明本实验筛选的5株米曲霉均能降解AFB1。且由图4可知菌株1P-2降解能力最强,其降解率高达69.18%,2C-3和1C-5其次,基本在60%左右。
2.3 不同米曲霉发酵豆瓣中氨基酸态氮含量的比较
将筛选得到的米曲霉及标准米曲霉(沪酿3.042米曲霉)分别发酵后,测定发酵液的氨基酸态氮含量,结果见图5。

图5 不同米曲霉发酵豆瓣中氨基酸态氮含量的比较
注:CK-为阴性对照,即未接种米曲霉;CK+为阳性对照,即接种标准米曲霉(沪酿3.042米曲霉)。
由图5可知,本实验筛选得到的5株米曲霉中,仅菌株1C-5发酵豆瓣中氨基酸态氮含量略低于标准米曲霉(沪酿3.042米曲霉),其余4株即菌株1P-2,2C-3,1C-1和1P-1发酵豆瓣中氨基酸态氮含量均高于标准米曲霉(沪酿3.042米曲霉),分别高出8.919%,12.98%,4.537%,22.69%。
2.4 菌株鉴定
2.4.1 形态特征
筛选菌株培养于MRS培养基,培养2天后形态特征见表6和图6。

表6 15株拮抗菌在MRS培养基平板上的培养形态
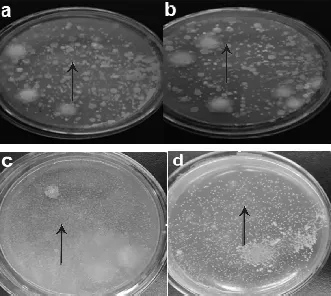
图6 1,2,4,5号菌在MRS培养基平板上的培养形态
注:a为1号菌,b为2号菌,c为4号菌,d为5号菌;均为箭头所指。
2.4.2 分子鉴定
2.4.2.1 细菌分子鉴定
最终选取的10株菌测序后通过比对发现,其中4株菌株(编号分别为1,3,5,6)与葡萄球菌属菌株的16S rRNA的相似性达 100%;3株菌株(编号分别为2,7,8,9)与库特氏菌属菌株的16S rRNA的相似性达 100%;4,10号与克雷伯菌的16S rRNA的相似性达 100%,见表7。

表7 10株菌与参比菌株的相似性
基于16S rRNA基因序列构建了上述10株菌株及其参比菌种的系统发育树见图7。该系统发育树表明,菌株8,9与Kurthiasp.B4的遗传距离最近;菌株2与Kurthiagibsoniistrain VIT-AKS的遗传距离最近;菌株4,10与Klebsiellapneumoniaestrain C-X5C的进化距离最近;菌株3与Staphylococcussaprophyticusstrain PJS/1遗传距离最近;菌株5,6与Staphylococcusgallinarumstrain 2141的进化距离最近;即它们的亲缘关系最高。

图7 基于16S rRNA基因序列10株高效拮抗菌系统发育树图
2.4.2.2 米曲霉分子鉴定
5株对产毒黄曲霉活性有较高抑制效果的米曲霉菌株测序后通过比对发现,与米曲霉菌F6的18S rRNA的相似性达 99%。
基于18S r RNA 基因序列构建了上述5株菌株及其参比菌种的系统发育树,见图8。

图8 基于18S rRNA基因序列5株高效拮抗菌系统发育树图
该系统发育树表明5株菌株与米曲霉菌株F6的遗传距离最近,即它们的亲缘关系最高。
3 讨论
当前在细菌对黄曲霉的拮抗作用的研发中发现的拮抗菌主要包括乳酸菌属、短小芽孢杆菌、枯草芽孢杆菌、链霉菌等[15-21],而本文通过微生物间拮抗作用,首次发现葡萄球菌属、库特氏菌属、克雷伯菌也能抑制黄曲霉且抑制效果显著。它们是黄曲霉的高效拮抗菌,在粮食生产和储藏中具有很好的应用潜力。在牛津杯实验中,10株菌株在平板上形成透明圈,可能原因是这些拮抗菌产生了某些代谢产物抑制黄曲霉菌生长,具体抑制机理下一步将做探究。
本研究筛选的葡萄球菌属、库特氏菌属、克雷伯菌能高效抑制产毒黄曲霉的生长,且这3类菌未曾被发现作为黄曲霉拮抗菌,为以后进一步探究这些拮抗菌抑制产毒黄曲霉生长的机制和食品工业的安全生产提供一定的依据。
氨基酸态氮(AN)能使豆瓣酱鲜味柔和,并调和香气,增进色泽,氨基酸态氮从而成为评价豆瓣酱质量的重要指标之一,氨基酸态氮含量越高,豆瓣品质越好。本实验筛选得到的5株米曲霉中,4株米曲霉发酵豆瓣中氨基酸态氮含量均高于标准米曲霉(沪酿3.042米曲霉),其中菌株1P-1和1C-1的发酵效果较优秀,分别高出22.69%和12.98%,因此将菌株1P-1 和1C-1用于工业生产可大大提高豆瓣酱的氨基酸态氮含量,从而增进豆瓣酱的风味和品质。
[1]宓晓黎,程恒嵩.黄曲霉毒素分析方法研究进展[J].粮食与饲料工业,1994(10):41-43.
[2]刘金霞.酱油酿造过程中米曲霉酶系的影响因素[J].江苏调味副食品,2002,73:10-11.
[3]冯德一.发酵调味品工艺学[M].北京:中国商业出版社,1993.
[4]郭继平,马莺.紫外诱变选育米曲霉高产蛋白酶菌株[J].微生物学通报,2007,34(2):246-250.
[5]党敏娜,傅亮,欧仕益.盐浓度对不同米曲霉所产中性蛋白酶活力的影响[J].中国调味品,2005(7):18-19.
[6]杜善良,张文德.一种快速测定调味品中氨基酸态氮的新方法[J].中国调味品,1998(1):30-31.
[7]李由.提高郫县豆瓣氨基酸态氮含量关键技术的研究[D].成都:西华大学,2010.
[8]徐丹,王洪新,张银志,等.共培养体系下米曲霉与产毒黄曲霉的相互影响[J].食品与生物技术学报,2012,31(6):587-591.
[9]关舒,胡新旭,马秋刚,等.黄曲霉毒素的传统去毒方法和生物降解研究进展[J].饲料工业,2008,29(24):21-24.
[10]汪小舟,祝阳.黄曲霉素的毒害及防除[J].现代食品科技,2005,21(2):223-224.
[11]刘付香,李玲,梁炫强.生物防治黄曲霉毒素污染研究进展[J].中国生物防治,2010,26(1):96-101.
[12]马志科,昝林森.黄曲霉毒素危害、检测方法及生物降解研究进展[J].动物医学进展,2009,30(9):94-99.
[13]宫春波,姜连芳,张永翠.黄曲霉毒素在食品中的危害及去除方法[J].食品研究与开发,2004,25(1):120-123.
[14]高雅,丁文,张琦,等.传统发酵豆瓣中产毒黄曲霉高效拮抗菌的筛选[J].微生物学通报,2010,37(3):369-374.
[15]刘超兰,黄著,彭熙敏,等.乳酸菌和酵母共培养技术缩短郫县豆瓣酱陈酿期的应用研究[J].中国酿造,2009(3):105-108.
[16]李志刚,杨宝兰,姚景会.乳酸菌对黄曲霉毒素吸附作用的研究[J].中国食品卫生杂志,2003,15(3):212-215.
[17]张琦,汪先丁,杨虎,等.郫县豆瓣自然发酵过程中细菌群落结构的变化[J].食品与发酵科技,2010,46(6):16-18.
[18]程世杰,刘长海,陈穗,等.广式高盐稀态酱油优良米曲霉菌株诱变选育[J].中国调味品,2014,39(10):56-62.
[19]李俊霞,梁志宏,关舒,等.黄曲霉毒素B1降解菌株的筛选及鉴定[J].中国农业科学,2008,41(5):1459-1463.
[20]Cotty P J,Bhatnagar D.Variability among atoxigenicAspergillusflausstrains in ability to prevent aflatoxin contamination and production of aflatoxin biosynthetic pathway enzymes[J].Applied and Environmental Microbiology,1994,60:2248-2251.
[21]Janes D,Kantar D,Kreet S,et al.Identification of buckwheat(FagopyrumesculentumMoench)aroma compouds with GC-MS[J].Food Chem.,2009,11(2):120-124.
