油茶产黄酮内生真菌的诱变育种
2018-03-05左雪枝
张 婷,左雪枝
(荆楚理工学院生物工程学院,湖北荆门 448000)
植物内生真菌存在较为广泛,无论是陆地植物还是水生植物,在它们体内都发现了内生真菌。植物体内的内生真菌种类也是不唯一的,有些植物中内生真菌多达几百种,据统计平均每种寄主有4~5种寄生菌[1-2]。内生真菌不仅分布广、种类多,而且具有特殊的代谢产物,很多代谢产物具有促进植物生长、杀虫、抗菌、抗氧化等作用[3]。
油茶(Camelliaoleifera)在我国南方具有悠久的栽培和利用历史,油茶属于山茶科山茶属中一类含有较高油脂的油料物种[4]。油茶蒲的提取物含有丰富的生物活性物质,具有抗癌、减肥降脂、降血糖、改善良性前列腺增生等生物活性[5]。试验前期已从油茶中分离出多种内生真菌,并对内生真菌的代谢产物进行初步研究发现,一些可以产黄酮的内生真菌中,JS-Ye6菌株产黄酮能力最强,但其产黄酮的能力仍远远达不到工业化生产的要求,因此希望通过对JS-Ye6菌株进行诱变处理使其产生基因突变,获得产黄酮能力较高的正突变菌株。
1 材料与方法
1.1 材料与试剂
JS-Ye6菌株(实验室保存);芸香苷标准品和其他分析纯化学试剂[乙醇、亚硝酸钠、硝酸铝、氢氧化钠、乙二胺四乙酸(简称EDTA)、琼脂粉、冰乙酸、无水乙酸钠、乙酸乙酯]均购自湖北省荆州市昌华科教仪器有限公司。
1.2 试验方法
1.2.1 菌丝悬液的制备 将保存的菌株接种于PDA平板培养3~4 d,选取PDA培养基上生长较旺盛的菌落,用接种环将菌丝体挑下,接入装有少量已灭菌玻璃珠的PDA液体培养基(50 mL/150 mL)中,28 ℃ 150 r/min摇床培养48 h,吸取液体培养基稀释至10-4,得到菌丝悬液。
1.2.2 菌株的诱变 参照崔迎的诱变方法[6]进行菌株诱变。先进行单因素诱变[紫外线(UV)诱变和亚硝酸(HNO2)诱变],确定单因素诱变中的最佳正突变菌株,再进行复合诱变。
1.2.3 菌株的初筛 诱变处理的菌液在培养时,每天都要观察其生长状态。当有较多菌落长出时,分别记录诱变组菌落的数量和对照组菌落的数量,通过致死率确定较优剂量范围[致死率=(1-诱变后活菌菌落数/对照组菌落数)×100%]。待较优剂量范围内的菌落完全长出后,取等量菌块,转接于新PDA平板的中心位置,以菌落生长速度和大小为指标,以未处理的菌株为对照,挑选正突变菌株。
1.2.4 菌株的复筛 菌株复筛的主要指标是黄酮产量[7],从正突变菌株中确定单因素诱变和复合诱变中的最佳突变菌株。
1.2.5 最优菌株的遗传稳定性检测 对复合诱变中的最佳正突变菌株进行连续10次传代培养,按照复筛方法检测其菌丝干质量和产黄酮能力。
2 结果与分析
2.1 UV诱变
按照筛选正突变菌株常采用致死率为70%左右的诱变剂量这一规律,从表1可以看出,当照射时间为75、90 s时,致死率分别为66%、71%,符合筛选条件。随后对这个范围内的所有突变菌株进行初筛,统计正突变率,确定UV诱变的最佳诱变时间。

表1 UV诱变不同照射时间的菌落数和致死率
由表2可以看出,诱变时间为90 s时,正突变率为28%,相对较高,所以选择90 s为UV诱变的最佳照射时间。
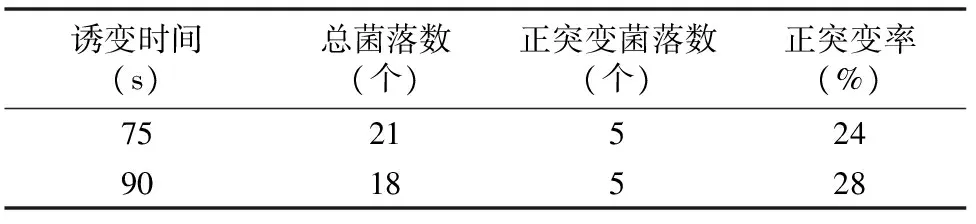
表2 UV诱变较优剂量范围内的正突变率
对较优剂量范围内初筛获得的10株正突变菌株进行编号,再分别进行复筛,测其黄酮产量,筛选UV诱变的最佳正突变菌株。
由表3可以看出,菌丝体生长最佳的为YZ-4,其菌丝体质量为0.855 mg/mL,比对照菌株提高28.38%,其黄酮产量也提高12.59%,YZ-8菌丝体质量为0.763 mg/mL,低于 YZ-4,但其黄酮产量提高37.04%,要明显高于YZ-4的黄酮增长量,因此确定YZ-8为UV诱变的最佳正突变菌株,将菌株YZ-8保藏备用。
2.2 HNO2诱变
HNO2诱变不同处理时间的结果如表4所示。诱变时间为 20 min 时,致死率为62%;诱变时间为25 min时,致死率为78%,因此选择这2个时间为较优剂量,并进一步确定最佳诱变时间。
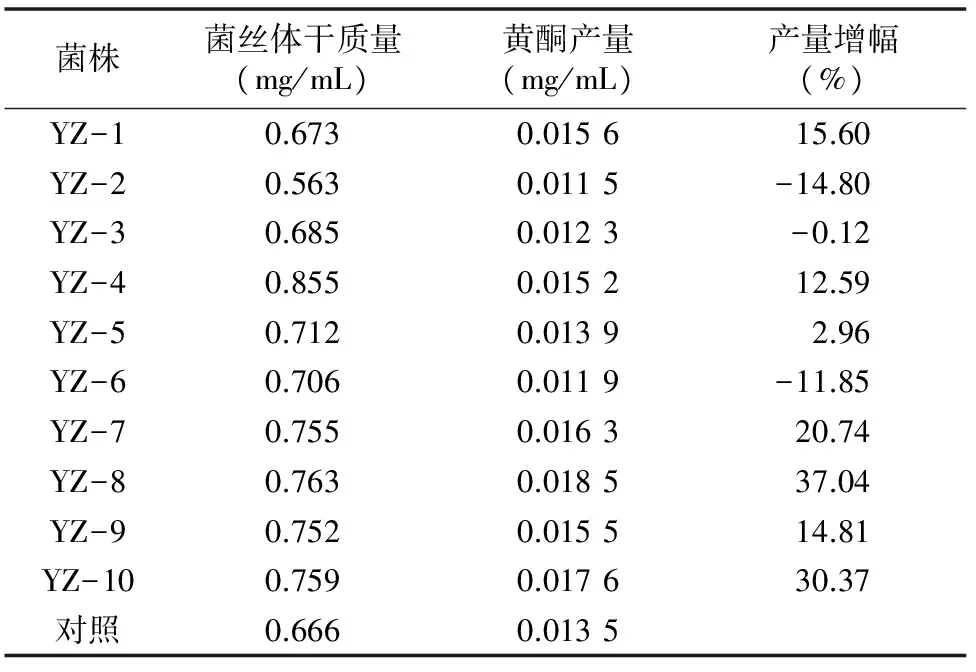
表3 UV诱变产生的正突变菌株的黄酮产量
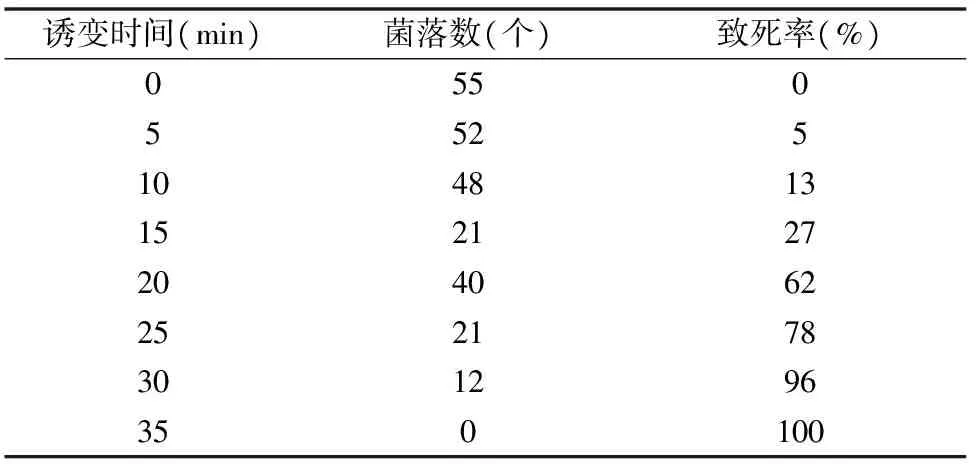
表4 HNO2诱变不同时间的菌落数和致死率
表5结果显示,诱变时间为25 min时正突变率相对较高,为33%,因此选择25 min为HNO2诱变的最佳反应时间。
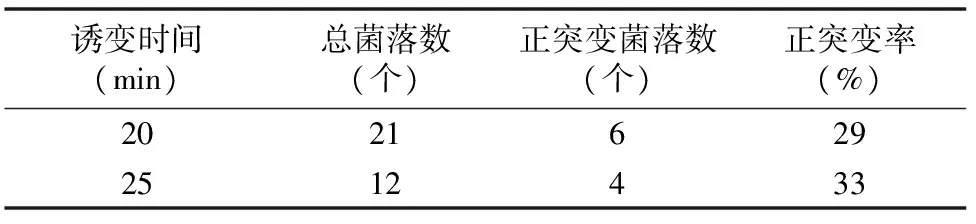
表5 HNO2诱变较优剂量范围内的正突变率
复筛结果如表6所示,YY-4菌株黄酮产量最高,为 0.014 3 mg/mL,比对照菌株产量提高16.26%,菌丝体干质量提高19.65%,确定YY-4菌株为HNO2诱变的最佳正突变株,保藏备用。
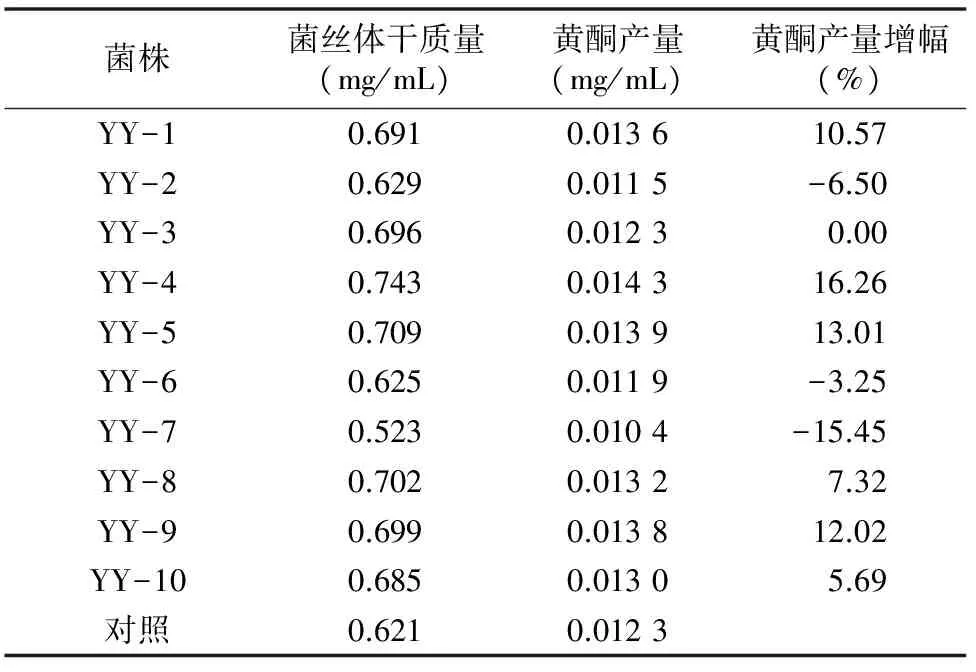
表6 HNO2诱变产生的正突变菌株的黄酮产量测定
2.3 复合诱变
2.3.1 UV-HNO2复合诱变 以UV诱变中的最佳突变菌株YZ-8为出发菌株,进行HNO2诱变处理,对照组为UV诱变优势菌株YZ-8。由表7数据可知,随着时间的延长,致死率逐渐增加,当HNO2诱变时间为5 min时,开始出现菌株死亡;当诱变时间达到25 min时,致死率达到100%。在这些处理时间中,诱变率有较大的变动幅度,当诱变时间为15 min时,致死率为65%,当诱变时间为20 min时,致死率为92%,而筛选时致死率最好在70~80%范围内,因此将15 min后的诱变时间间隔短一些,再进行诱变处理,其结果如表8所示。

表7 UV-HNO2复合诱变的菌落数和致死率-1
由表8可知,当诱变时间为17 min时,致死率为71%;19 min 时,致死率为83%,因此选择这2个时间为较优诱变时间,并进一步确定最佳诱变时间。

表8 UV-HNO2复合诱变的菌落数和致死率-2
由表9可见,诱变时间为17 min时,正突变率相对较高,为27%,所以选择17 min作为复合诱变中HNO2诱变的最佳反应时间。随后,对这6株正突变菌株编号,进行复筛,测其黄酮产量,筛选HNO2诱变的最佳正突变油茶产黄酮内生真菌菌株,结果如表10所示。Y-UH-2的黄酮产量最高,达到0.022 3 mg/mL,增幅均明显高于其他菌株,是 UV-HNO2复合诱变的最佳正突变油茶产黄酮内生真菌菌株。

表9 UV-HNO2复合诱变较优剂量范围内的正突变率
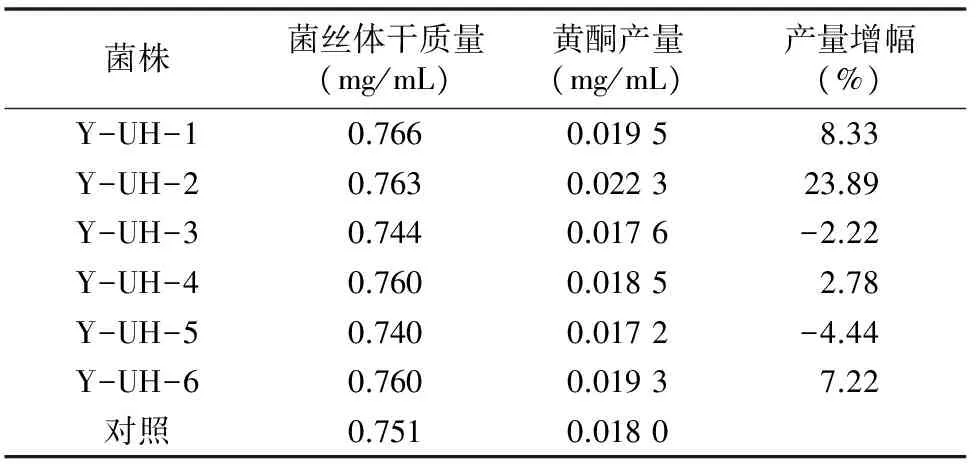
表10 UV-HNO2诱变产生的正突变菌株的黄酮产量
2.3.2 HNO2-UV复合诱变 以HNO2诱变中的最佳突变菌株YY-4为出发菌株,对其进行UV诱变处理,对照组为HNO2诱变优势菌株YY-4。
表11数据显示,随着时间的延长,致死率逐渐增加,当UV诱变时间为15 s时,出现菌株死亡,当诱变时间达到90 s时,致死率达到100%。在致死率数据中,当致死率为77%时,诱变时间为45 s,当致死率为87%时,诱变时间为 60 s。因此选择45、60 s 2个时间作为较优诱变时间,并进一步确定最佳诱变时间。
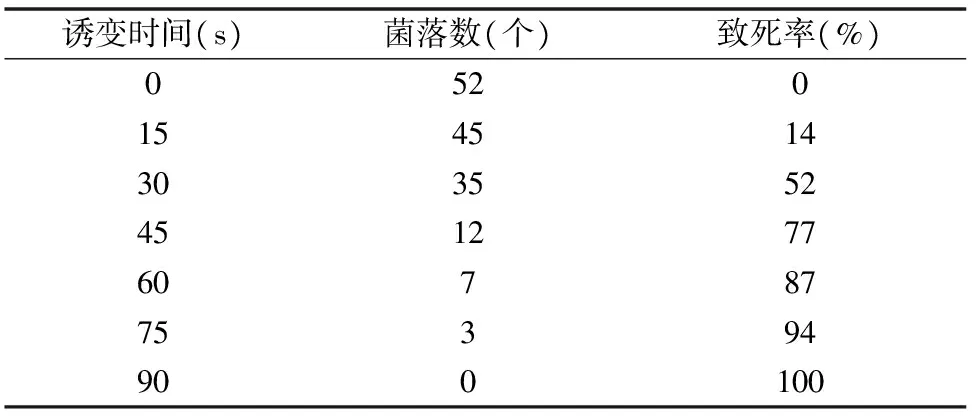
表11 HNO2-UV复合诱变的菌落数和致死率
从表12可看出,诱变时间为45 s时,正突变率相对较高,为33%,所以选择45 s为复合诱变中UV诱变的最佳反应时间。

表12 HNO2-UV复合诱变较优剂量范围内的正突变率
将较优剂量范围内初筛获得的5株正突变菌株进行编号,再分别进行复筛,测它们的黄酮产量,筛选HNO2诱变的最佳正突变菌株。
由表13可看出,Y-HU-3的黄酮产量最高,为 0.016 8 mg/mL,是HNO2-UV复合诱变的最佳正突变株。
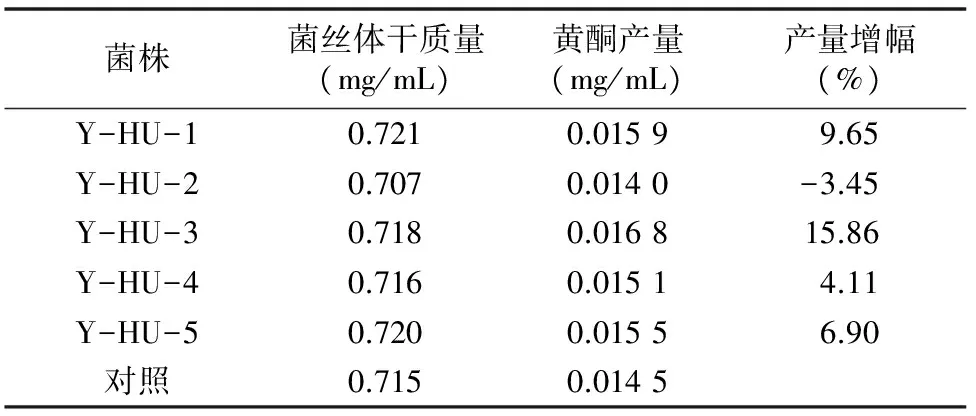
表13 HNO2-UV诱变所产生的正突变菌株的黄酮产量测定
2.3.3 复合诱变高产菌株的比较 因为复合诱变的出发菌株不同,其最佳正突变菌株的参比不同,因此须要选用同一对照,对2种复合诱变方法中的最佳正突变菌株的产黄酮能力进行比较,以确定本研究中的最佳正突变菌株。此方法中选择的参照为原始出发菌株JS-Ye6。
由表14可看出,Y-UH-2黄酮产率最高,产量为 0.022 4 mg/mL,比对照菌株产量提高53.4%,确定其为复合诱变的最佳正突变株。
2.3.4 最优菌株的遗传稳定性 对Y-UH-2进行10次连续传代,虽然在连续传代过程中,黄酮产量有所降低,但降低不太明显,较为稳定(表15)。
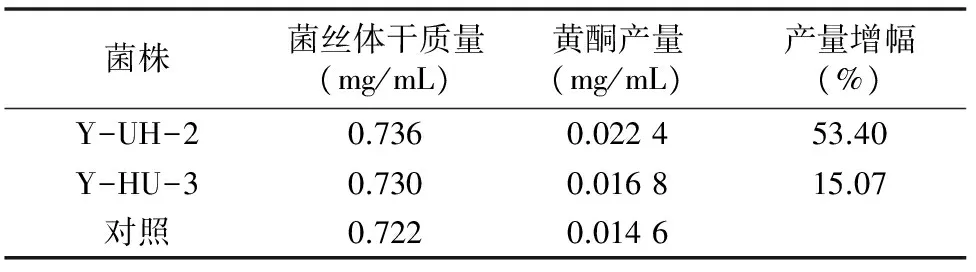
表14 不同复合诱变处理得到的最优菌株的比较
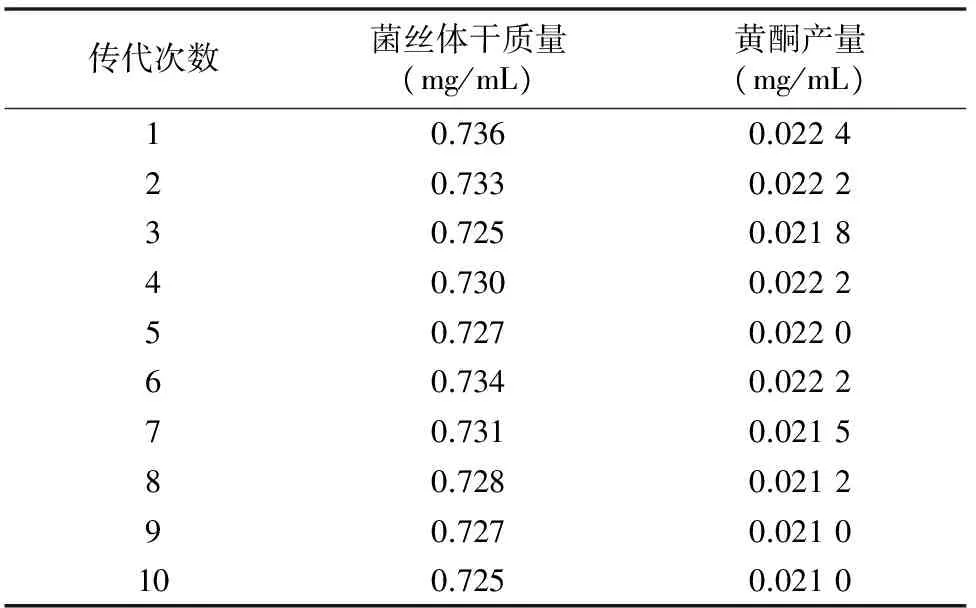
表15 Y-UH-2连续传代10次结果比较
3 结论与讨论
利用微生物发酵法获取目的产物是一种非常有前景的生产技术,微生物具有种群丰富、生长快、易培养、易控制、代谢产物丰富等特点,因此此法与单纯的分离提取技术相比具有显而易见的优势。但在微生物发酵法中使用的微生物通常并不是野生型菌株,野生型菌株并不能满足工业生产的要求,而生产菌株通常都是在野生型菌株的基础上经过一定的改造获得的[8-9]。改造的方法很多,如点突变、构建基因工程菌、诱变育种等,其中诱变育种是较为经济、使用率较高的一种方法[10]。诱变育种可分为单因素诱变法和复合诱变法。单因素诱变法就是整个诱变过程中只选用1种诱变剂去处理对象,而复合诱变是使用2种或2种以上诱变剂共同诱发同一对象的突变方式。
研究表明,复合诱变是寻找高活力突变菌株的较好方法,诱变效果通常比单因素诱变的效果好,王艳君等以产壳聚糖酶菌株为出发菌株进行UV、亚硝酸钠的单因素诱变及两者的复合诱变[11]。结果发现,复合诱变的效果要比单独进行UV诱变或亚硝酸钠诱变的效果好,UV诱变得到的最佳优势菌株的活力为6.500 U/mL,亚硝酸钠诱变得到的最佳优势菌株的活力为6.125 U/mL,复合诱变最佳优势菌株的活力为8.135 U/mL,相比之下复合诱变比UV诱变后的产壳聚糖酶菌株酶活力提高25.15%,比亚硝酸钠诱变后的菌株酶活力提高32.82%[11]。杨春宇对丁醇耐受性菌株进行研究,试验中原始菌株在3%浓度丁醇中的相对生长率为11.82%,分别采用微波、氯化锂、微波-氯化锂复合诱变的方法处理,在单因素诱变中,微波辐照和氯化锂诱变效果较好,突变菌株的相对生长率分别提高至15.68%、15.35%,而复合诱变效果更佳,其中最佳优势菌株的生长率则提高至19.23%,近一步证明了复合诱变的效果优于单因素诱变的效果[12]。高阳在产小檗碱内生真菌的诱变育种试验中,以初始菌株S6为出发菌株;先进行单因素诱变如UV诱变、激光诱变和亚硝酸钠诱变,再进行多种方式的复合诱变,主要是3种单因素诱变的组合,经过诱变得到的最佳优势菌株产量分别为0.724、0.967、0.826、1.229、0.953、1.260 mg/L,相对于初始菌株产量(0.439 mg/L)增幅基本都超过50%,甚至有些超过100%,最终表明复合诱变的结果要优于单因素诱变的效果[13]。
本试验结果也证明了复合诱变的效果一般要优于单因素诱变的效果。在单因素诱变试验中,获得的UV诱变的最佳突变菌株发酵液可产黄酮0.018 5 mg/mL,产量增幅为37.04%;获得的HNO2诱变的最佳突变菌株发酵液可产黄酮 0.014 3 mg/mL,产量增幅为16.26%;复合诱变获得的最佳突变菌株发酵液可产黄酮0.022 4 mg/mL,产量增幅为 53.4%,其产量均要高于UV单一诱变和HNO2单一诱变的结果。
复合诱变的效果优于单因素诱变的效果,其原因可能是多种因子复合使用可以更为广泛地作用于DNA,取长补短,造成DNA分子上多个基因位点的稳定性发生改变,得到更多的突变类型,而单因素诱变作用范围较窄,仅作用于DNA上的某一个区域,作用位点具有专一性,所以作用效果较差。但在具体试验中由于笔者对大多数微生物的遗传背景并不清楚,选取的试验方法带有一定的盲目性,所以复合诱变效果的好坏在一定程度上也取决于笔者所选择的诱变剂种类。虽然在本研究中复合诱变的效果要好于单因素诱变,但也有可能运用其他诱变剂的组合要优于笔者所选用的UV-HNO2诱变法,因此在今后的研究中,笔者所在课题组须要尝试更多的复合诱变方法,以期提高目的菌株的产量。
[1]姜道宏.植物内生真菌及其展望[J].中国生物防治学报,2015,31(5):742-749.
[2]陈丽媛,孙翠焕.药用植物内生真菌研究进展[J].微生物学杂志,2015,35(5):98-101.
[3]丁常宏,都晓伟,徐 莹.药用植物内生真菌的功能研究进展[J].中医药学报,2013,41(3):168-171.
[4]周 薇,吴雪辉.油茶综合利用开发前景[J].中国农村科技,2006(10):21-23.
[5]黄陈陈,丁之恩,杨 松,等.油茶叶黄酮类化合物清除自由基及抑菌作用研究[J].粮食与油脂,2011(12):12-15.
[6]崔 迎.产西贝碱内生真菌的诱变育种及发酵条件优化[D].西安:西北大学,2006.
[7]沈建福,姜天甲,王徐卿.油茶壳中总黄酮的最佳提取工艺研究[J].中国粮油学报,2008,23(3):104-105.
[8]郭宏文,王 艳,江成英,等.酸性α-淀粉酶菌种的诱变选育[J].江苏农业科学,2016,44(3):356-357.
[9]马玮超,杜茂林,谷亚楠,等.高通量法选育果胶酶高产菌株[J].江苏农业科学,2016,44(7):513-516.
[10]高宏正,李国强,邓素贞,等.微生物诱变育种概况及激光在微生物诱变中的应用[J].黑龙江畜牧兽医,2015(9):53-56.
[11]王艳君,廖春林.产壳聚糖酶菌株的单因素及复合条件诱变育种[J].河南城建学院学报,2012,21(4):25-27.
[12]杨春宇.丁醇耐受菌株复合诱变的研究[D].哈尔滨:黑龙江八一农垦大学,2013.
[13]高 阳.产小檗碱内生真菌的诱变及发酵条件的优化[D].西安:西北大学,2009.
