不同播种密度对荞麦植株叶片衰老及产量的影响
2018-03-05母养秀张久盘穆兰海杜燕萍常克勤
母养秀,张久盘,穆兰海,杜燕萍,常克勤
(宁夏农林科学院固原分院,宁夏固原 756000)
荞麦(FagopyrumesculentumMoench.)是廖科(Polygonaceae)荞麦属(FagopyrumMill.)一年生双子叶禾谷类作物[1-2],营养丰富,且具有多种生物学功能[3-6]。在宁夏南部山区的粮食生产中发挥着重要作用。植物叶片的衰老与植物体内的活性酶含量有关[7-9],活性酶含量的高低表示植物体本身清除有害物质的能力强弱。众多研究表明,由于叶片早衰在农业生产中造成作物减产[10-11],荞麦叶片早衰的快慢和功能期的长短,对荞麦产量形成有重要作用[12]。
关于播种密度对植株衰老的影响在玉米[13-14]、小麦[15-16]、水稻[17]等作物上均有相关研究,但关于播种密度对荞麦植株衰老的影响研究还未见报道。本试验重点研究不同播种密度对荞麦植株叶片衰老生理及产量的影响,探索荞麦植株叶片的衰老规律,播种密度与荞麦叶片衰老之间的关系,以期为荞麦高产高效栽培技术的制订提供理论依据。
1 材料与方法
1.1 材料
试验于2016年6—9月在宁夏固原市原州区彭堡镇彭堡村燕麦荞麦试验基地进行,位于106°9′E,36°5′N,海拔 1 660 m,供试品种为宁荞1号。
1.2 试验设计
试验设3个密度梯度,分别为T1:60万株/hm2(每行40株,株距5 cm);T2:90万株/hm2(每行60株,株距 3.33 cm);T3:120万株/hm2(每行80株,株距2.5 cm)。试验采用随机区组设计,每处理3次重复,播种方式为开沟条播,人工间定苗。小区面积10 m2,每个小区9短行,行距为 33 cm,肥、水、病虫草害的管理按国家荞麦区域试验要求进行。
待植株生长至始花期后,每隔7 d采样1次。始花后1、8、15、22 d对荞麦植株叶片的叶绿素含量、可溶性蛋白质含量、丙二醛(MDA)含量、超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)活性进行测定,每项测定3次重复,取其平均值。
1.3 测定项目与方法
叶绿素含量按照80%的丙酮浸提法测定[18];可溶性蛋白质含量测采用考马斯亮兰G-250法测定[19];SOD活性、POD活性、CAT活性采用高俊凤主编的《植物生理学实验指导》方法测定[20];丙二醛含量采用硫代巴比妥酸(TBA)显色法测定[21]。
1.4 数据处理
试验数据采用Excel 2007进行初步处理,用SPSS 16.0软件对不同处理进行LSD多重比较。
2 结果与分析
2.1 不同播种密度对荞麦植株叶片生理特性的影响
2.1.1 不同播种密度对荞麦叶绿素含量的影响 叶绿素存在于叶绿体中,叶绿素含量的高低影响对光能的吸收和转换。从图1可以看出,不同密度处理下,叶绿素含量随生育期的推进均呈先上升后下降的趋势。叶绿素含量在开花后 1 d 随密度的增加而升高,开花后22 d随密度的增加而降低,表明低密度处理叶绿素降解较缓,高密度处理叶绿素降解较快。
2.1.2 不同播种密度对荞麦可溶性蛋白质含量的影响 可溶性蛋白质含量的变化是反映叶片功能及衰老的指标之一。从图2可以看出,在不同密度处理条件下,可溶性蛋白质的含量随生育期的推进均呈下降趋势。可溶性蛋白质含量在开花后1 d随密度的增加而降低,T1处理比T2、T3处理分别高出18.4%、21.6%。在开花后22 d,T1处理可溶性蛋白质含量为 0.21 mg/g,比T2、T3处理分别高5.0%、16.7%,但差异不明显。表明低密度处理植株叶片的可溶性蛋白质含量高,能有效延缓叶片衰老。
2.1.3 不同播种密度对荞麦超氧化物歧化酶活性的影响 超氧化物歧化酶(SOD)是细胞内防御系统的关键酶,SOD活性的高低标志着植物细胞自身抗衰老能力的强弱。从图3可以看出,在不同播种密度条件下,SOD活性呈先上升后下降的趋势。但在高密度T3处理下,SOD活性在开花后 8 d 达到最高,开花后22 d SOD活性最低,且在开花8 d开始下降,而低密度T1、T2处理在开花后15 d后才开始下降,表明高密度处理SOD活性降低速度较快,且加速植株衰老进程。



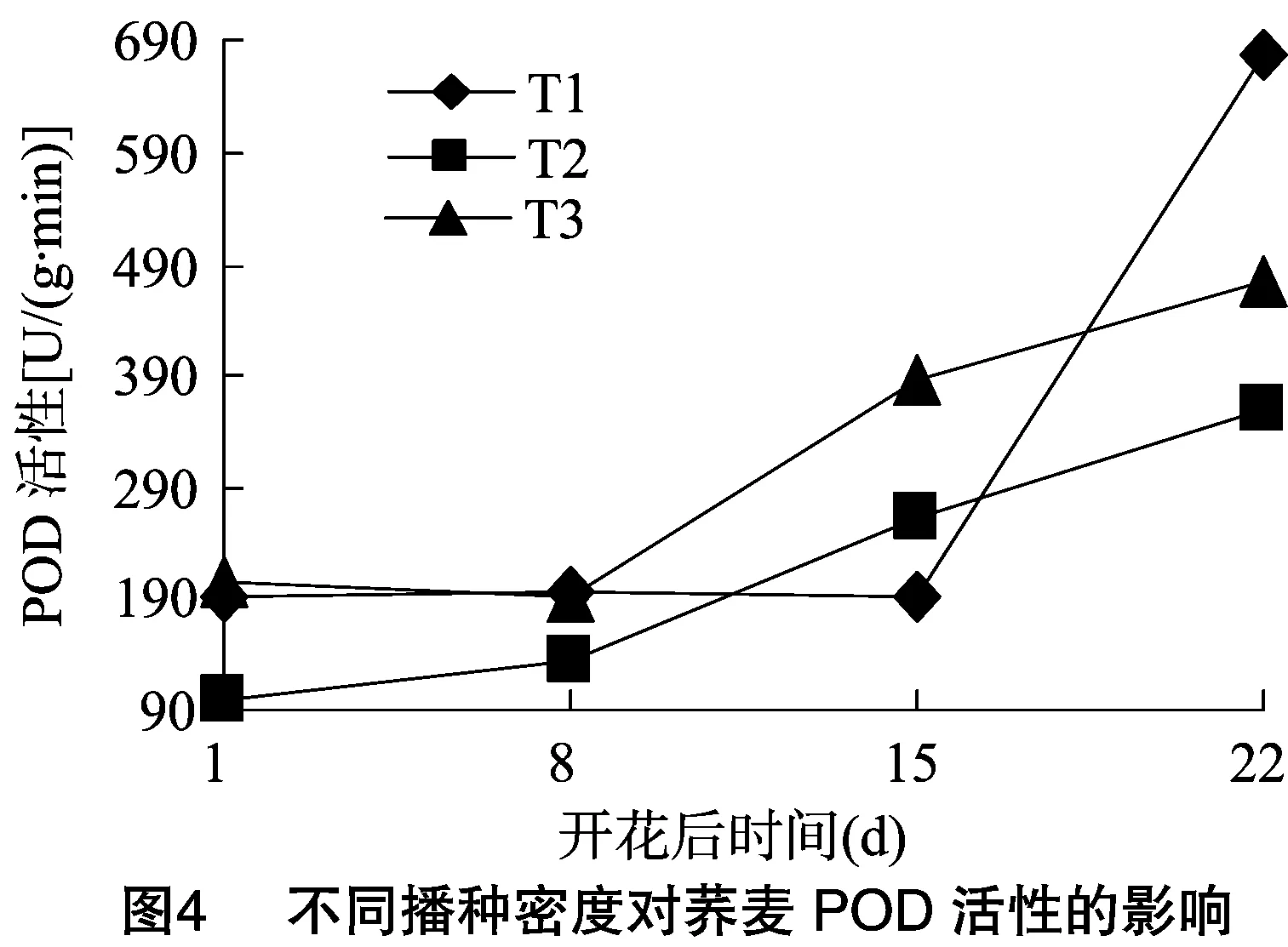
2.1.4 不同播种密度对荞麦过氧化物酶活性的影响 过氧化物酶(POD)是植物保护酶系统另一种重要的酶,可分解细胞内的膜脂过氧化物,减少其积累,对于维持叶片的正常生理功能具有重要作用。从图4可以看出,不同播种密度条件下,POD活性呈上升趋势。在开花后22 d,T1处理POD活性最高,为679.7 U/(g·min),比T2、T3处理分别高89.2%、42.7%,表明低密度处理能有效提高POD活性,延缓荞麦叶片衰老。
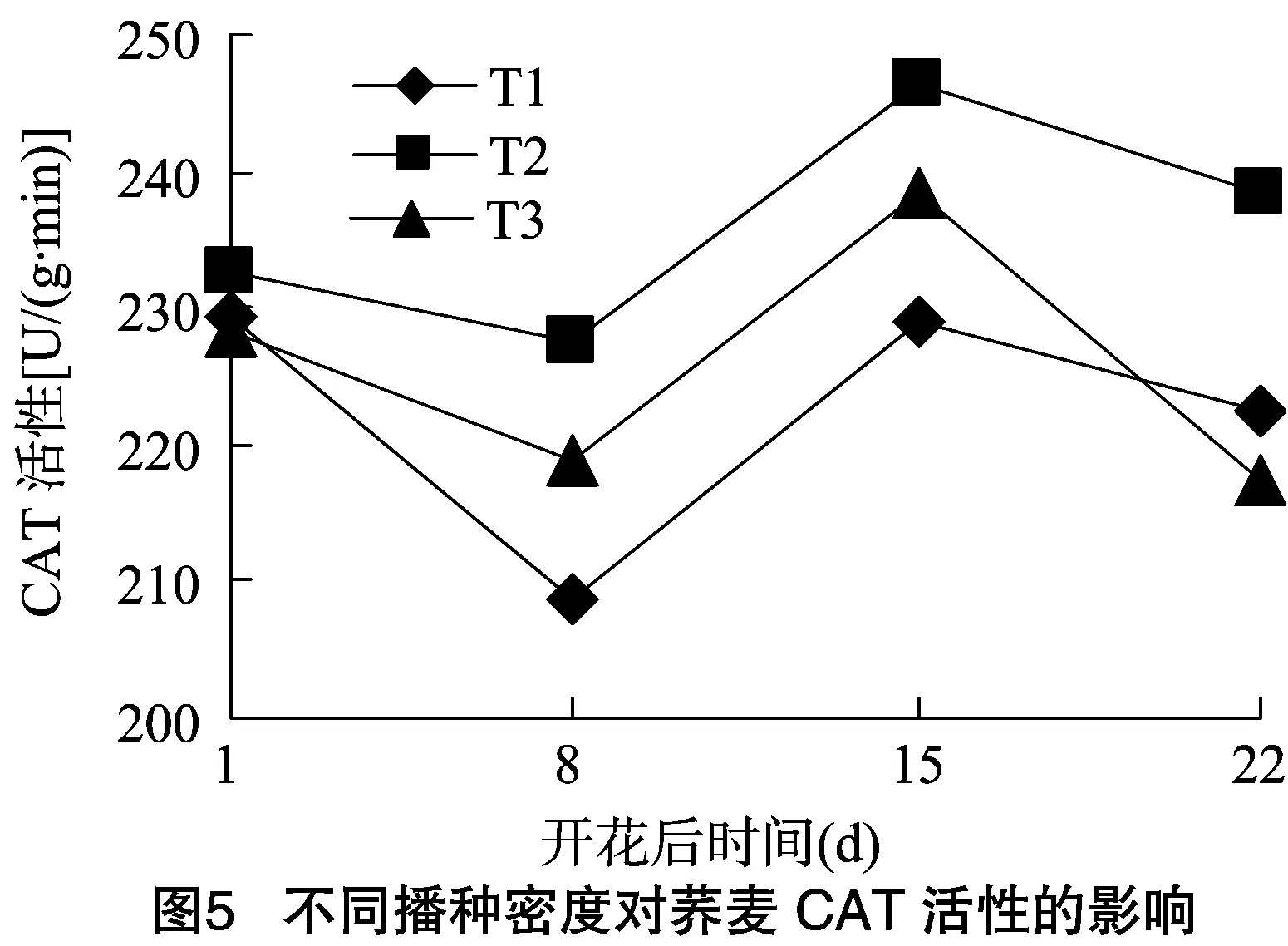
2.1.5 不同播种密度对荞麦过氧化氢酶活性的影响 过氧化氢酶(CAT)能清除植物体内的过氧化氢,是植物酶保护系统重要的酶。从图5可以看出,在不同密度条件下,随着生育期的推进CAT活性呈先下降再上升再下降的趋势。在开花后22 d,高密度T3处理CAT活性最低,为 217.3 U/(g·min),比T1、T2处理分别低2.3%、8.9%,表明高密度处理CAT活性下降速度比低密度快,高密度处理能加速植株叶片的衰老进程。
2.1.6 不同播种密度对荞麦丙二醛含量的影响 丙二醛(MDA)含量的高低能表明叶片细胞膜脂的过氧化程度,其含量越低,说明植株的抗逆性越强。从图6可以看出,3个密度条件下,丙二醛的含量随生育进程的推进均呈先下降后上升的趋势。在开花后1 d,随密度的增加,MDA含量降低;在开花后22 d,随密度的增加,MDA含量增高,但相互之间差异不明显,表明在高密度处理条件下,MDA的积累速度较快,能加速植株的衰老进程。

2.2 不同播种密度对荞麦产量及其构成因素的影响
从表1可以看出,高密度T3处理单株粒数、单株粒质量、千粒质量及产量降低。单株粒数较T1、T2处理分别降低了 34.9%、38.8%,与T1、T2处理差异极显著。T3处理千粒质量较T1、T2处理分别降低了6.1%、11.1%,与T2处理差异极显著。T3处理的单株粒质量和小区产量均低于T1、T2处理,但3个处理间差异不显著。说明在干旱条件下,低密度处理有助于提高荞麦产量。
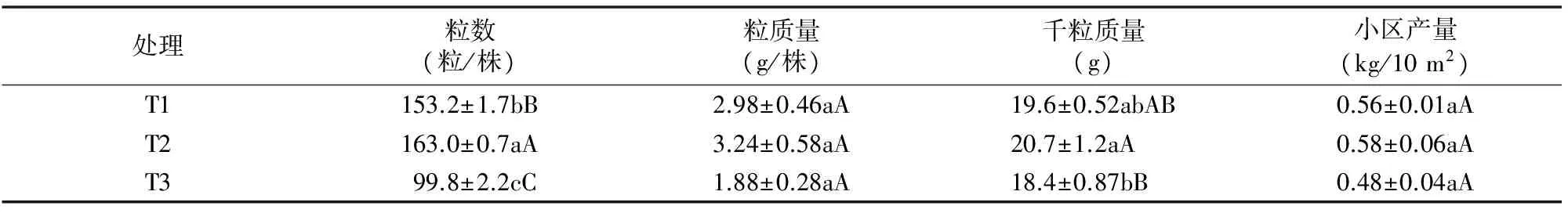
表1 不同播种密度对荞麦产量及其构成因素的影响
注:同列数据后不同小写、大写字母分别表示差异显著(P<0.05)、极显著(P<0.01)。
3 讨论与结论
叶片衰老常见指标是叶绿素和蛋白质含量下降[12],能延缓叶绿素含量和蛋白质含量下降的因素,也即延缓了荞麦植株叶片的衰老。本研究结果表明,高密度处理有效加快叶绿素分解和蛋白质含量的下降,本结论与前人研究的密度对叶片叶绿素含量和可溶性蛋白质含量的影响具有负效应的结论[14,22-23]一致。在低密度T1、T2处理条件下,叶片衰老的速度缓慢。
叶片衰老与活性氧代谢呈正相关[24],SOD活性、POD活性、CAT活性、丙二醛含量均是衡量叶片衰老的重要指标[22,25]。植物叶片衰老伴随着酶活性的降低和膜脂过氧化物MDA含量的增高。本研究中高密度处理会降低SOD、POD、CAT的活性,不能有效清除细胞内自由基,且降低细胞膜的抗氧化能力,加速叶片衰老,同时加快MDA含量的积累,本结论与张荣萍等的研究结果[17]一致。
荞麦产量往往受气候条件影响[2],2016年6—10月,在荞麦生育期内无降雨,一直处于干旱状态。本研究结果表明,低密度处理有效地提高了单株粒数、单株粒质量和千粒质量,本结论与王志和等的研究结果[16]一致。但密度要结合产量进行适宜组合,本研究结果表明,在干旱条件下,T2处理荞麦单株粒数、单株粒质量、千粒质量及产量最高。
荞麦是我国重要的小宗粮豆作物和传统的出口商品,但长期以来,由于从事荞麦研究的科研人员较少,重视程度不够,因此,在荞麦栽培生理研究方面较落后[26]。生产实践中,有效控制或延缓荞麦叶片的衰老进程,延长叶片功能期,对提高荞麦产量有重要作用。
[1]张美莉,胡小松.荞麦生物活性物质及其功能研究进展[J].杂粮作物,2004,24(1):26-29.
[2]母养秀,陈彩锦,杜燕萍,等.宁南山区不同甜荞麦品种产量和品质的比较研究[J].湖北农业科学,2015(16):3860-3863.
[3]赵明和,何玲玲,李慧娟.鞑靼荞食用药用的研究[J].粮食与油脂,1995(4):4-7.
[4]Deschner E E,Ruperto J,Wong G,et al.Quercetin and rutin as inhibitors of azoxymethanol-induced colonic neoplasia[J].Carcinogenesis,1991,12(7):1193-1196.
[5]Husain S R,Cillard J,Cillard P.Hydroxyl radical-scavenging activity of flavonoids[J].Phytochemistry,1987,26(9):2489-2491.
[6]卢丞文.荞麦中D-手性肌醇分离提取与纯化研究[D].长春:吉林农业大学,2007.
[7]赵丽英,邓西平,山 仑.活性氧清除系统对干旱胁迫的响应机制[J].西北植物学报,2005,25(2):413-418.
[8]许长成,邹 琦.大豆叶片旱促衰老及其与膜脂过氧化的关系[J].作物学报,1993,19(4):359-364.
[9]Zhang J X,Kirkham M B.Drought-stress-induced changes in activities of superoxide dismutase,catalase,and peroxidase in wheat species[J].Plant & Cell Physiology,1994,35(5):785-791.
[10]李少昆,陈天茹,肖 璐,等.不同时期干旱胁迫对棉花生长和产量的影响 Ⅰ.棉花受旱减产原因分析[J].石河子大学学报(自然科学版),1999,3(3):178-182.
[11]高小丽,高金锋,冯佰利,等.不同绿豆品种生育后期叶片衰老的研究[J].西北植物学报,2007,27(5):947-953.
[12]巩巧玲,冯佰利,高金锋,等.不同基因型荞麦生育后期叶片衰老特性研究[J].干旱地区农业研究,2008,26(5):27-31,35.
[13]胡 萌.密度对春玉米光合与衰老生理及产量的影响[D].哈尔滨:东北农业大学,2009.
[14]罗瑶年,张建华.种植密度对玉米叶片衰老的影响[J].玉米科学,1994,2(4):23-25.
[15]于振文,岳寿松,沈成国,等.不同密度对冬小麦开花后叶片衰老和粒重的影响[J].作物学报,1995,21(4):412-418.
[16]王志和,姜丽娜,李春喜,等.种植密度和植物生长调节剂对小麦衰老及产量构成的影响[J].作物杂志,2003(2):15-17.
[17]张荣萍,戴红燕,马 均,等.栽培密度对有色稻抽穗后剑叶一些衰老生理特性的影响[J].西昌学院学报(自然科学版),2009,23(3):13-16.
[18]陈毓荃.生物化学实验方法和技术[M].北京:科学出版社,2002:197-199.
[19]李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.
[20]高俊凤.植物生理学实验指导[M].北京:高等教育出版社,2006.
[21]Heath R L,Packer L.Photoperoxidation in isolated chloroplasts.I.Kinetics and stoichiometry of fatty acid peroxidation[J].Archives of Biochemistry and Biophysics,1968,125(1):189-198.
[22]丁四兵,朱碧岩,吴冬云,等.温光对水稻抽穗后剑叶衰老和籽粒灌浆的影响[J].华南师范大学学报(自然科学版),2004(1):117-121,128.
[23]胡文河,王兴录,刘振库.不同密度水稻抽穗后生理特性的研究[J].吉林农业大学学报,2006,28(6):594-596,605.
[24]宋松泉,傅家瑞.杂交水稻叶片衰老与膜脂过氧化作用的关系[J].中山大学学报论丛,1995(1):15-19.
[25]李奕松,黄丕生,黄仲青,等.两系籼型杂交水稻齐穗后光合作用和衰老特性的研究[J].中国水稻科学,2002,16(2):141-145.
[26]冯佰利,柴 岩,高金锋.中国荞麦栽培研究进展与展望[J].荞麦动态,2001(1):8-10.
