Streptomyces pristinaespiralis LS15产普那霉素的发酵培养基优化
2018-03-02李靖靖李红梅
李靖靖,李红梅
(邹平县综合检验检测中心,山东邹平 256200)
随着临床上抗生素的普遍应用,很多感染性病菌的耐药性也逐渐增强,致使抗生素的剂量不断加大,如耐青霉素的肺炎球菌、耐万古霉素的肠球菌、耐甲氧西林的金黄色葡萄球菌等[1-2]。因此迫切需要新型抗生素来抵抗这些耐药菌株的感染,而普那霉素则成了新型抗生素的首选。普那霉素属于链阳性菌素类抗生素,由始旋链霉菌发酵产生,可以通过与核糖体结合从而抑制蛋白的合成,对大多数革兰氏阳性菌和部分革兰氏阴性菌有强烈的抑制作用,是万古霉素的替代药物[3]。更重要的是,对普那霉素制剂的临床应用证明,只有极少数的细菌会对其产生微弱的耐药性,因此普那霉素在抵抗多重耐药菌方面起到了重要作用,具有广阔市场前景[4]。
目前,国内对普那霉素的研究较少,菌株发酵产量尚处于较低的水平,一般效价不超过2 000 μ/mL,发酵单位不超过1 500 mg/L[3-4]。为了进一步提升普那霉素的发酵水平、降低生产成本,试验对一株普那霉素产生菌Streptomyces pristinaespiralis LS15进行了摇瓶发酵培养基的优化,并且取得了较好的效果。
1 材料与方法
1.1 试验材料
放线菌S.pristinaespiralis LS15,土壤中筛选并由实验室保藏。
琼脂培养基:淀粉15 g/L,黄豆粕3 g/L,可溶性酵母粉1 g/L,琼脂18 g/L,初始pH值7.0。于121℃条件下灭菌20 min。
种子培养基:可溶性酵母粉6 g/L,葡萄糖30 g/L,KH2PO4·2H2O 1.2 g/L,(NH4)2SO45 g/L,K2HPO4·2H2O 1.0 g/L,MgSO4·7H2O 0.6 g/L,FeSO4·7H2O 0.03 g/L,ZnSO4·7H2O 0.03 g/L,pH 值 7.0。于115℃条件下灭菌20 min。
发酵培养基:同种子培养基。
1.2 培养方法
种子液培养:从琼脂培养基上刮取孢子两环,在无菌条件下接入50 mL/250 mL的种子培养基中,于30℃,200 r/min条件下摇床培养30 h。
发酵培养:吸取种子液4 mL,无菌条件下接入50 mL/250 mL的发酵培养基中,于30℃,200 r/min条件下摇床培养72 h。
1.3 PB-CCD优化培养基
发酵培养基中有8种成分,其中FeSO4·7H2O和ZnSO4·7H2O这2种成分属于微量元素,添加量较小,因而暂时不作为优化的对象,其余6种培养基组分的添加量较大,在此作为重点优化对象。PB-CCD的设计及结果分析采用软件Design-Expert 8.0。
1.4 发酵液中普那霉素含量测定
高效液相色谱法测定发酵液中普那霉素含量[3]。
1.5 酶活测定
己糖激酶(Hexokinase,HK)、丙酮酸激酶(Pyruvate kinase,PK)、天冬氨酸激酶 (Aspartokinase,AK)、柠檬酸合成酶(Citrate synthase,CS) 的酶活测定参照相关文献[5-8]。
2 结果与分析
S.pristinaespiralis LS15目前发酵培养基的组成有8种物质,如前所述,锌和铁2种金属离子对于微生物的生理代谢及酶的催化具有重要作用,严格来讲不属于营养成分,而且其浓度在一定范围内对普那霉素的产量影响不大,所以暂时没有对其进行优化。试验采用PB-CCD的响应面方法对菌株S.pristinaespiralis LS15发酵培养基的6种主要营养成分进行了优化研究,并取得了较好的效果。
2.1 PB试验筛选主要因素
Plackett-Burman(PB) 试验是一种近饱和二水平试验设计方法,能够在众多因素中快速地评选出哪些因素对于目标具有显著的影响[9-10]。采用Design-Expert 7.0软件,分别对培养基中的优化成分选择了较高水平(以+1表示) 和较低水平(以-1表示)。
PB试验的分组设计见表1。

表1 PB试验的分组设计
PB试验根据所设计的高低水平可以自动生成一组试验方案,共12组。按照该方案配制发酵培养基对S.pristinaespiralis LS15进行不同组别的发酵试验,每组3个平行,发酵结束后测定普那霉素产量并利用Design-Expert 7.0软件进行数据分析。如表2所示,p值是表征模型及因素显著与否的重要参数,如果p<0.05,那就表明该因素具有显著影响。从表3中看出,首先该模型的p=0.018 4,说明该PB试验的设计是合理的,效果非常显著。p<0.05的因素有3个,分别是K2HPO4、酵母抽提物和MgSO4,说明这3种成分影响普那霉素摇瓶产量程度较大,而葡萄糖、硫酸铵和磷酸二氢钾这3种成分影响较小。表2中的系数代表了该因素的增量与普那霉素产量的关系,例如,酵母抽提物、K2HPO4和MgSO4这3个因素的系数为正值,表示增加三者的浓度可以进一步提高普那霉素的产量,而增加其他3个因素的浓度会降低普那霉素的合成。但是,由于葡萄糖等3种成分的p>0.05,影响不显著,所以在后续的试验设计中,只考虑酵母抽提物、K2HPO4和MgSO4三者即可。
PB模型的显著性分析见表2。

表2 PB模型的显著性分析
2.2 梯度爬坡试验
根据表2中的系数和p值分析,对于普那霉素产量影响较小的3个因素不再做进一步优化,其浓度仍然为葡萄糖 50 g/L,KH2PO41 g/L,(NH4)2SO45 g/L,而对影响显著的酵母抽提物、K2HPO4和MgSO4这3种营养物质做后续的爬坡试验,以合适的步长最快地逼近最高适响应区域。从表4显示的结果可以看出,随着正系数影响因素质量浓度的增加,普那霉素的产量也随之增加,与PB试验模型的预测相吻合,在第4组试验中达到最高值为1.92 g/L。该组别的营养成分质量浓度不一定就是最优值,但可以肯定普那霉素的产量最高点就在组别4附近,因为各种营养成分间还存在着交互作用,因此将第4组中的可溶性酵母粉、磷酸氢二钾和硫酸镁作为后续试验的中心点。
梯度爬坡试验见表3。
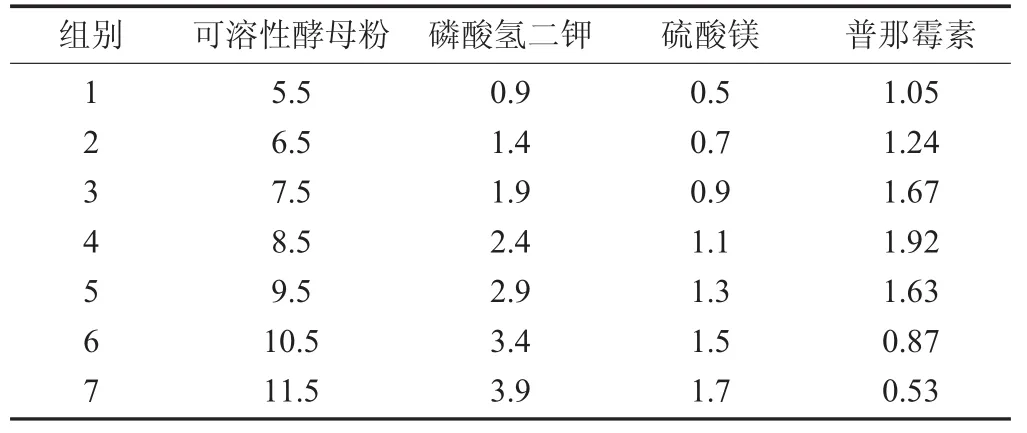
表3 梯度爬坡试验/g·L-1
2.3 中心组合试验
在中心组合试验中,将酵母抽提物质量浓度设定为7~9 g/L,K2HPO4质量浓度设定2~3 g/L,MgSO4质量浓度设定1~2 g/L,Design-Expert 7.0软件会自动生成 5 个水平 (-1.682,-1.000,0,1.000,1.682)的试验考查。
中心组合试验设计及结果见表4。

表4 中心组合试验设计及结果
从表4可以看出,该模型的p<0.000 1,失拟合度不显著,表明模型可信度较高。而且,根据普那霉素的实际摇瓶产量与模型预测值相比较,两者数据差别不大,说明该模型的准确度较高。
Design-Expert软件同时可以生成3种因素的响应面图及其等高线图,该图能够反映出各种组分的相互影响[11-12]。
酵母抽提物和磷酸氢二钾对普那霉素摇瓶产量的影响见图1,酵母抽提物和硫酸镁对普那霉素摇瓶产量的影响见图2,磷酸氢二钾和硫酸镁对普那霉素摇瓶产量的影响见图3。
从图1、图2、图3可以看出,营养成分间存在两两的交互作用,任何一种成分的过高或者过低都会使普那霉素的产量下降。

图1 酵母抽提物和磷酸氢二钾对普那霉素摇瓶产量的影响

图2 酵母抽提物和硫酸镁对普那霉素摇瓶产量的影响
Design-Expert 8.0软件拟合得到了普那霉素摇瓶产量的二次多项式方程为:

其中b,e,f分别为酵母抽提物、磷酸氢二钾和硫酸镁的质量浓度。对该回归方程的3个自变量求导即可得到模型的极值点,软件的数据分析显示,当酵母抽提物质量浓度7.52 g/L,磷酸氢二钾质量浓度2.26 g/L,硫酸镁质量浓度1.81 g/L时,普那霉素产量最高为2.25 g/L。

图3 磷酸氢二钾和硫酸镁对普那霉素摇瓶产量的影响
根据PB-CCD的培养基优化试验,得到的优化培养基为:酵母抽提物7.5 g/L,葡萄糖50 g/L,KH2PO·42H2O 1.2 g/L,(NH)42SO48 g/L,K2HPO·42H2O 2.5 g/L,MgSO4·7H2O 2.0 g/L,FeSO4·7H2O 0.05 g/L,ZnSO·47H2O 0.05 g/L。以上述配比进行普那霉素的摇瓶发酵,实际质量浓度分别为2.33,2.25,2.28 g/L,基本符合模型的预测值,比起初始培养基的1.18 g/L提高了86.4%,证明了PB-CCD培养基优化方法的有效性。
2.4 不同培养基中的胞内酶活测定
为了初步说明S.pristinaespiralis LS15在优化培养基中能够高产普那霉素,试验选取了菌株代谢途径中的一些关键酶进行了酶活测定,这些酶包括糖酵解途径(EMP途径) 中的己糖激酶(hexokinase,HK) 和丙酮酸激酶(pyruvate kinase,PK),二氨基庚二酸途径(DAP途径) 中的天冬氨酸激酶(aspartokinase,AK)和三羧酸循环过程中(TCA) 的柠檬酸合成酶(citrate synthase,CS)。S.pristinaespiralis LS15 分别在初始培养基和优化培养基中发酵,相同时间相同处理方式下测定4种酶的活力。
菌株S.pristinaespiralis LS15在2种培养基中的酶活比较见表5。
普那霉素的分子骨架由很多氨基酸残基聚合而成[2],因此菌体细胞中氨基酸的合成对于普那霉素的产量有重要的影响,而氨基酸的合成主要来自TCA循环。从表5的酶活比较中可以看出,CS作为TCA循环中的第1个关键酶,其酶活在优化培养基中提高了68.7%,说明TCA循环在优化培养基中得到了强化。赖氨酸主要由DAP途径合成,而DAP途径中的关键酶AK在优化培养基中的活性提高了近1倍。TCA循环的增强势必需要上游EMP途径的增强,通过酶活比较可知,EMP途径中的HK与PK也确实有不同程度的酶活提升。

表5 菌株S.pristinaespiralis LS15在2种培养基中的酶活比较
3 结论
发酵是一个非常复杂的生化反应过程,影响其好坏有诸多因素,其中营养成分是一个非常重要的因素,是进行发酵调控及过程优化的基础,并且需要针对不同的普那霉素生产菌或者突变株开发出适合其生长及合成产物的培养基。国内学者对普那霉素的研究较少,何云飞等人[13]对一株普那霉素产生菌S.pristinaespiralis 9-10的培养基优化发现,适合其发酵的碳源为葡萄糖或淀粉,有机氮源为鱼粉,且二者浓度对普那霉素产量均有较大影响;对S.pristinaespiralis ZP-7[14]的研究发现,培养基中添加1.5 g/L的正丙醇有利于提升普那霉素的发酵产量;钱思宇等人[15]以S.pristinaespiralis RP59500为研究对象,发现最适碳源和氮源分别为蔗糖、酵母粉,且补加氨基酸可以有效提升普那霉素的发酵产量。试验确定对S.pristinaespiralis LS15发酵具有显著影响作用的因素为酵母抽提物、K2HPO4和MgSO4,最终摇瓶产量为2.23 g/L,该发酵水平仍然不能满足工业化生产需求,后续研究工作需要聚焦于发酵工艺方面进行优化及调控,进一步提升普那霉素的发酵水平。
[1] Barrett J F,Kuanbert D H.Is the new streptogramin derivative the answer to MRSA[J].Curr.Invest.Drugs,1993,2(3):245-253.
[2] VazquezD.The Streptogramin family of antibioties,In:Coreora JN,Hahn FE,eds[J].Antibioties,1975,4(12):521-529.
[3] Bergeron M, Moniay G.The pharmacokineties of quinupristin/dalfopristinin laboratory animal sand in humans[J].Antimicrob.Chemother,1997,39 (23):129-135.
[4] Griswold M W,Lomaestro B M,Brioeland L L.Quinupristin/daffopristin (RP59500) injectable Streptogramin combination[J].Am.Healt.Syst.Pharm,1996,53(21):41-53.
[5] Teichgraber P,Biesold A,Pigereva D.Subcellular localization of Hexokinase in the rat cortex[J].Biokhimiya,1972,37 (4):748-756.
[6] Hamano Y,Nicchu I.ε-Poly-L-lysine producer,Streptomyces albulus,has feedback inhibition resistant aspartokinase[J].Appl.Microbiol.Biotechnol,2007 (5):873-882.
[7] Jhadeswar M,William C,Plaxton D.Phosphoenolpyruvate carboxylase protein kinase from developing castor oil seeds:partial purification,characterization,and reversible control by photosynthate supply[J].Planta,2007 (2):1 299-1 310.
[8] James C K,Liang B B.Brain mitochondrial citrate synthase and glutamate dehydrogenase:differential inhibition by fatty acyl coenzyme A derivatives[J].Metabolic.Brain.Disease,1994 (9):143-152.
[9] 姜珊,刘梅,王宝杰,等.大肠杆菌表达抗脂多糖因子的发酵条件优化 [J].中国农业科技导报,2011,13(4):128-134.
[10] 庞倩婵,纪凯华,王燕森,等.响应面法优化Paenibacillussp.JX426产黄原胶降解酶发酵培养基 [J].中国酿造,2011(2):33-37.
[11] 杨玉红,刘芳,康宗利,等.响应面法分析优化Streptomyces albus B-215发酵产聚赖氨酸培养基 [J].中国酿造,2011,11(4):138-142.
[12] Bankar S B,Singhal R S.Optimization of poly-lysine production by Streptomyces noursei NRRL 5126[J].Bioresour Technol,2010 (10):8 370-8 375.
[13] 何云飞.普那霉素发酵工艺研究 [D].杭州:浙江大学,2007.
[14] 朱林东.普那霉素产生菌基因组重排育种 [D].杭州:浙江大学,2006.
[15] 钱思宇,刘颖利,王昂,等.普那霉素发酵工艺研究[J].河北化工,2012,35(4):9-14.◇
