可乐碳量子点的提取及其抑菌性研究
2018-03-01陈巧玲陈碧桑李飞明游雨婷吴秀婷
陈巧玲,陈碧桑,李飞明,游雨婷,吴秀婷
(1.闽南师范大学生物科学与技术学院,福建漳州 363000)(2.闽南师范大学化学与环境学院,福建漳州 363000)(3.厦门大学化学与化工学院,福建厦门 361005)
碳量子点由碳元素构成,而碳元素是生命体最重要的组成元素之一,生命体基本结构物质的主要骨架如氨基酸和核苷酸等都是由碳元素组成的。因此,由碳元素构成的量子点是一类生物毒性低的半导体纳米颗粒。近年来,因碳量子点(CDs)具有良好的生物相容性,稳定的荧光特性,抗光漂白以及激发荧光发射等特性,大大的吸引了研究学者的兴趣[1,2]。此外,因CDs表面富含多种官能团如:羧基、羟基和羰基等,这些基团不仅可以作为CDs参与化学反应的位点,而且也通过这些位点对CDs进行修饰,从而使它具有一定的化学特性[3,4]。基于这些特性,CDs可用于传感器[5,6]、光催化[7]、敏化剂[8]、生物成像[9~11]、白光发光二极管[3,12]、药物或者基因载体[13]等领域。因此,如何通过简单、绿色、高效的方法制备无毒、粒径、形貌均一的高质量的CDs,并研究它的性质依然是个重要的课题。
迄今为止,CDs合成主要有两种方法:自上而下以及自下而上。典型的自上而下方法有电弧放电法[14]、激光剥蚀法[15]、电化学法[7]和水热处理法[16]等合成方法。自下而上的方法主要将小分子碳通过化学手段合成碳量子点。主要有化学氧化法[17]、高温热解法[18]和微波法[19]等。碳量子点迄今为止多为合成,且每种方法均各有优缺点,不经化学反应直接获取碳量子点的方法鲜见报道。本文开创了一种以可乐为原材料通过透析直接获得碳量子点的方法,与传统合成方法相比,所得的碳量子点表面富含羟基、羧基等官能团,具有良好的单分散性、溶解度高、容易进行后续改性和应用。本文还重点探索了CDs材料对多种菌的抑制作用,以期更直观的观察其细胞毒性。从可乐中提取CDs步骤简单,无毒,原料易得无需复杂的仪器设备及实验技巧,可以随时随地制备碳量子点。
1 材料与方法
1.1 材料
1.1.1 仪器
紫外分光光度计(岛津UV-2550);荧光分光光度计(Varian Cary Eclipse,Ex slit 5 nm,Em slit 5 nm);红外光谱仪(Thermo Fisher 6700);透射电镜(FEI Tecnai-G2-F30 Transmission);HH-6恒温水浴锅(金坛市鸿科仪器厂);E240型电子分析天平(梅特勒-托利多仪器有限公司);pHS-3B酸度计(梅特勒-托利多仪器有限公司);RE-52AA旋转蒸发仪(上海亚荣);YXQ-LS-75G灭菌锅(上海博讯);SW-CJ-1FD超净工作台(苏净安泰);ZWY-240旋转摇床(上海智城);ALPHA1-2 LD-PLUS冻干机(德国CHRIST)。
1.1.2 培养基与供试菌种
(1)实验用水为超纯水18.2 MΩ(MILLIPORE),去离子水(MILLIPORE),可口可乐(购买于漳州市新华都超市),1 ku透析膜(美国进口,联合碳化),75%酒精(西陇化工)。
(2)培养基(厂家均为北京路桥):营养琼脂(蛋白胨10 g、牛肉膏3 g、氯化钠5 g、琼脂15~20 g、蒸馏水1000 mL、pH 7.2~7.4,121 ℃灭菌15 min)、LB培养基(胰蛋白胨10 g/L、酵母提取物5 g/L、氯化钠10 g/L、pH 7.0,121 ℃灭菌15 min)、普通肉汤(蛋白胨20 g、牛肉粉5 g、氯化钠5 g、pH 7.5±0.1,121 ℃灭菌15 min)、10%氯化钠胰酪胨大豆肉汤(胰蛋白胨17 g、大豆蛋白胨3 g、氯化钠100 g、磷酸氢二钾2.5 g、葡萄糖2.5 g、丙酮酸钠10 g、pH 7.3±0.2,121 ℃灭菌15 min)、察氏液体培养基(硝酸钠3 g、磷酸氢二钾1 g、硫酸镁0.5 g、氯化钾0.5 g、硫酸亚铁0.01 g、蔗糖30 g、蒸馏水1000 mL、pH 6.8±0.2,121 ℃灭菌15 min)、察氏固体培养基(硝酸钠3 g、磷酸氢二钾1 g、硫酸镁0.5 g、氯化钾0.5 g、硫酸亚铁0.01 g、蔗糖30 g、琼脂20 g蒸馏水1000 mL、pH 6.8±0.2,121 ℃灭菌15 min)、马铃薯培养基(马铃薯粉6.0 g、葡萄糖20.0 g、琼脂20.0 g、蒸馏水1000 mL、pH 5.6±0.2,121 ℃灭菌15 min)。
(3)菌种(广东省微生物菌种保藏中心):GIM 1.559大肠杆菌(Escherichia coli)、GIM 1.221金黄色葡萄球菌(Staphylococcus aureus)、GIM 2.194白色念珠菌(Candida albicans)、GIM 1.977枯草芽孢杆菌(Bacillus subtilis)、GIM 1.843铜绿假单胞菌(Pseudomonas aeruginosa)。
1.2 可乐碳量子点的提取
将1.25 L可口可乐通过旋转蒸发仪蒸发浓缩至100 mL左右,采用1 ku透析膜透析24 h,其中每隔约3 h更换一次蒸馏水,直至透析结束,将透析袋内溶液再次浓缩至约50 mL经冻干机冻干为碳量子点。
1.3 结构表征
将提取所得碳量子点采用透射电镜扫描、荧光分光光度计、紫外分光光度计和红外光谱仪进行结构表征。
1.4 抑菌实验
1.4.1 菌种活化及菌液制备
将冷冻保存的菌种与100 mL各菌种所需的液体培养基进行混合,37 ℃、200 r/min摇床培养24 h,血球计数板计数各菌液浓度。
其中,大肠杆菌液体培养基使用普通肉汤培养基,固体培养基使用LB培养基;金黄色葡萄球菌液体培养基使用10%氯化钠胰酪胨大豆肉汤,固体培养基使用营养琼脂;白色念珠菌液体培养基使用改良马丁液体培养基,固体培养基使用改良马丁固体培养基;枯草芽孢杆菌液体培养基使用普通肉汤培养基,固体培养基使用营养琼脂;铜绿假单胞菌液体培养基使用LB培养基,固体培养基使用营养琼脂。
1.4.2 预加菌液法倒平板
分别将1 mL供试指示菌菌液注入已冷却至50 ℃左右的培养基中,混匀,倒约20 mL/平板,水平静置凝固后备用。制得1×106CFU/mL备用。
1.4.3 抑菌材料试验浓度
将碳量子点配制成2 mg/L、5 mg/L、10 mg/L、20 mg/L、40 mg/L、80 mg/L、100 mg/L、500 mg/L和1000 mg/L等浓度进行试验。
1.4.4 打孔法抑菌圈试验
打孔法:用已灭菌的打孔器在试验平板上打孔,小心挑去培养基小块以做成6 mm左右圆孔,往孔中注入80 μL各种浓度的碳量子点溶液,4 ℃预扩散2 h,37 ℃倒置培养24 h,测定抑菌圈大小。
1.4.5 抑菌圈大小测量
用游标卡尺十字交叉法测量抑菌圈直径,以表示抑菌圈的大小。
2 结果与讨论
2.1 电镜扫描、紫外、红外及荧光光谱
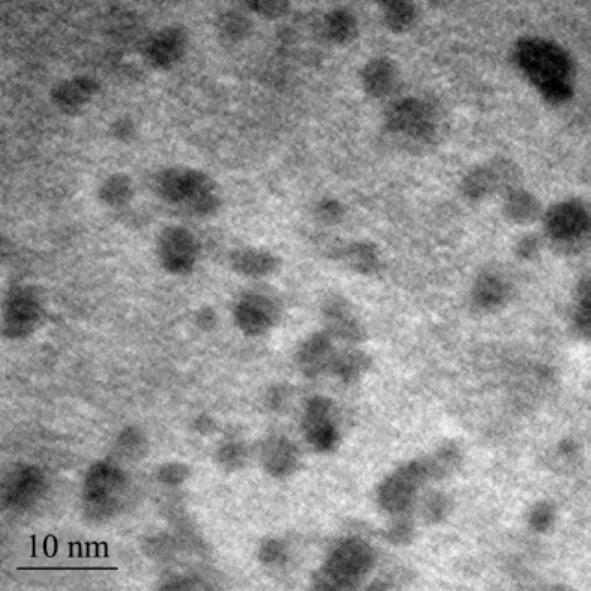
图1 电镜下碳量子点形态Fig.1 TEM image of CDs
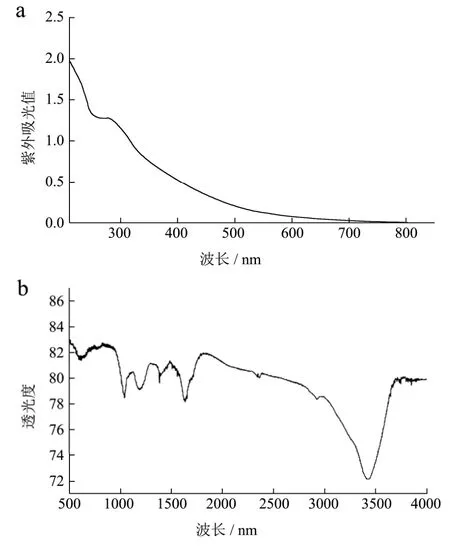
图2 可乐碳量子点的紫外光谱a及红外光谱图bFig.2 UV-Vis (a) and infrared spectrogram (b) of CDs
由图1可知,可乐碳量子点粒度分布窄,单分散性好(平均直径3 nm),为非结晶性物质。从图2a紫外吸收光谱可知,可乐碳量子点的吸收范围较宽,从700 nm开始有吸收,在280 nm处有最大吸收峰。这主要是CDs sp2区域的π-π*跃迁。图2b红外光谱对3428.69 nm、3244.78 nm分别为游离及缔合-NH2的特征吸收峰,2923.91 nm为亚甲基反对称伸缩振动的特征吸收峰;在1382 cm-1、1190 cm-1及1040 cm-1对应的分别为不对称和对称伸缩振动的C-O-C峰,1632.60 cm-1处为伸缩振动。说明表面有大量羟基及羧基的存在。因此,这些基团对可乐碳量子点的改性与应用起到重要的作用。同时,羟基以及羧基的大量存在使得碳量子点具有极强的溶解性,冻干后极易吸潮。
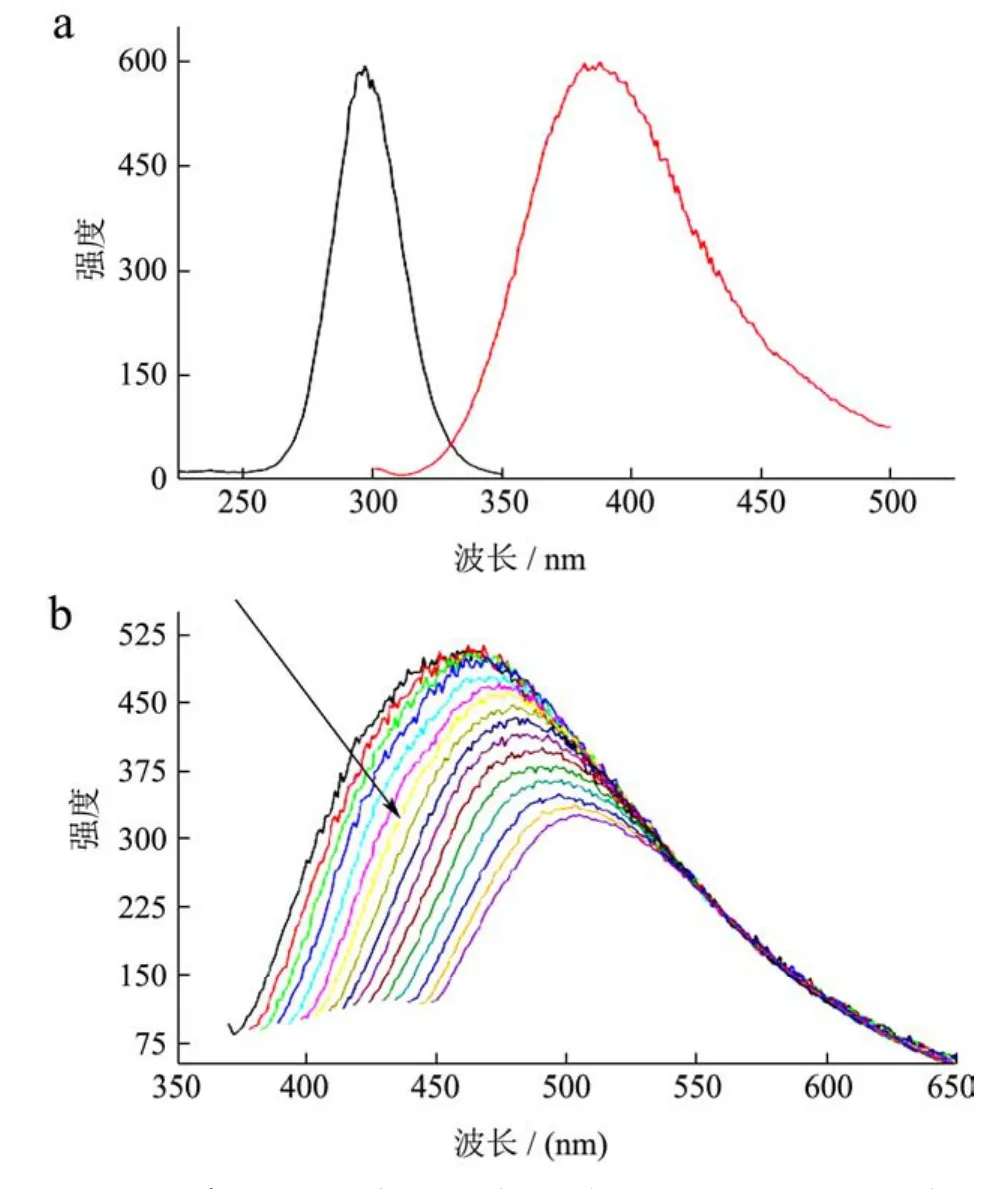
图3 可乐碳量子点的激发/发射光谱a及其波长依赖性发射bFig.3 Excitation/emission spectra of CDs (a),wavelength-dependent emission of CDs (b)
从图3a可知,可乐碳量子点的最大激发/发射波长分别为295 nm/390 nm,在295 nm光激发下可发射出390 nm的荧光。如图3b所示,其发射具有明显的波长依赖性,CDs随着激发波长的增大,其荧光发射峰从450 nm红移至520 nm。与此同时,发射峰强度也逐渐减弱。产生这种现象的原因可能有以下两种:(1)不同尺寸的碳量子点纳米粒子对光的选择性存在差异;(2)由可乐碳量子点表面缺陷引起的,也就是表面的发射空穴不同引起的。利用这些性质可以控制荧光发射。
2.2 不同浓度的碳量子点溶液对于多种常见菌的抑制效果
探讨浓度分别为2.5 mg/L、5 mg/L、10 mg/L、20 mg/L、40 mg/L、80 mg/L、100 mg/L、500 mg/L和1000 mg/L的碳量子点溶液对大肠杆菌、金黄色葡萄球菌、白色念珠菌、枯草芽孢杆菌、铜绿假单胞菌等5种常见菌的抑菌效果,发现碳量子点对这5种菌均无抑制效果,结果见表1。CDs溶液浓度高达1000 mg/L时仍对这五种菌无抑制效果,从侧面说明可乐碳量子点并没有细胞毒性,或者说生物毒性较低。
在细胞水平上,碳量子点的毒性已经得到多方面的研究。Liu等[20]采用甲硝唑为原料制备的碳量子点对牙龈卟啉单胞菌具有抑菌效果,推测所得的碳量子点是否具有抑菌效果仅与合成或者提取CDs的原料有关。另外,通过表面修饰官能化的CDs大部分仍具有较低毒性,如Ray等人发现,HepG2细胞在接触高达100 μg/mL碳量子点后,细胞活力仍保持在80%左右[21]。
如果用于碳量子点表面钝化的基团具有一定的毒性,合成后的碳量子点可能对细胞会带有一定的细胞毒性。如,用PPEI-EI钝化后的碳量子点具有较高的细胞毒性。
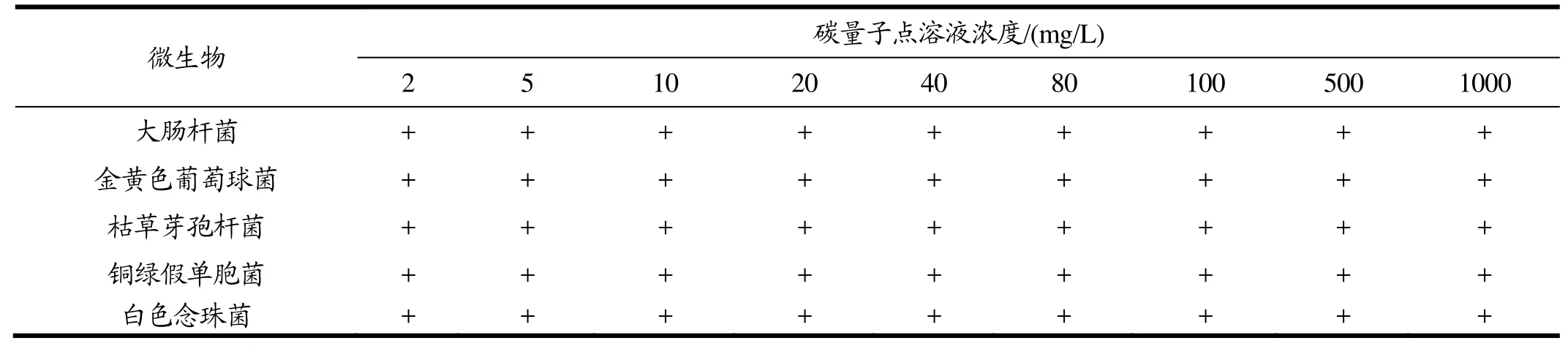
表1 不同浓度碳量子点溶液的抑菌试验结果Table 1 Results of antibacteria test with different concentrations of CDs
2.3 不同浓度碳量子点溶液下供试菌的生长状况
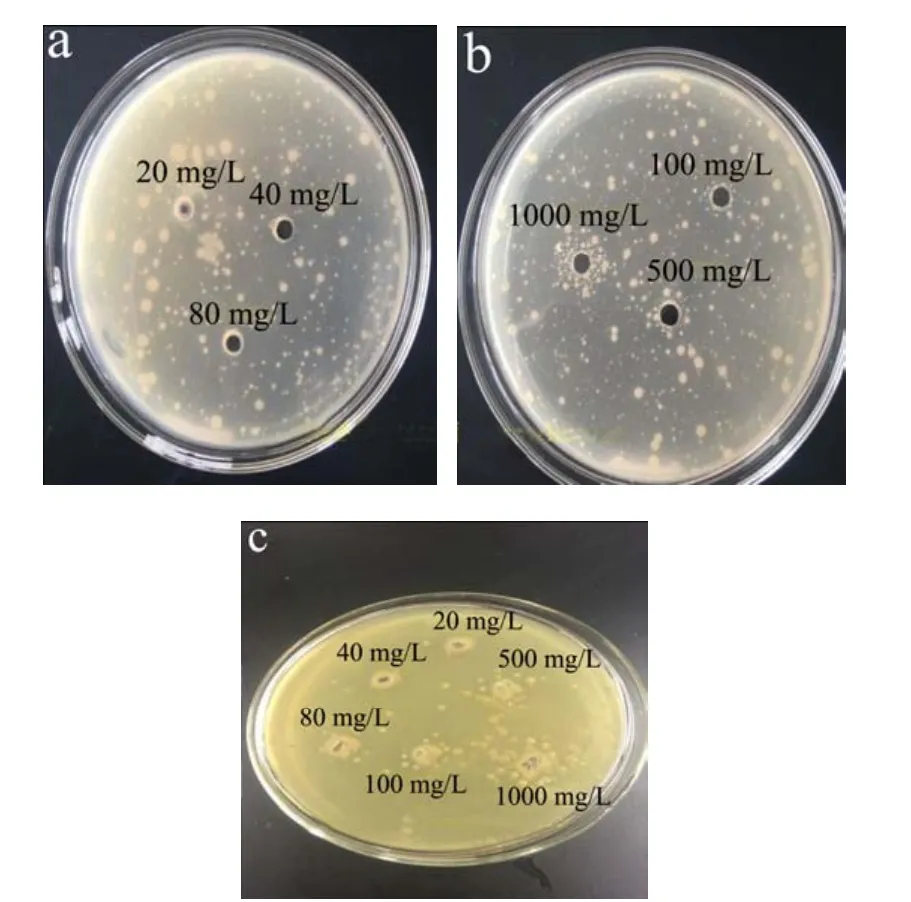
图4 不同浓度碳量子溶液对供试菌生长的影响Fig.4 Effects of different concentrations of CDs on the growth of bacterium
如图4所示,发现五种微生物中的金黄色葡萄球菌、大肠杆菌,在6 mm孔洞附近,随着所加碳量子点溶液浓度达到100 mg/L后,孔周围的菌落明显密集起来。而其余三种菌并未出现相同情况。这是否因为大肠杆菌、金黄色葡萄球菌对于碳源敏感度高,所需的碳源比例较大,有待进一步探索。
3 结论
本文采用随处可见的可口可乐饮料为原料,通过简单的浓缩、透析直接获得可乐碳量子点,经电镜、紫外分光光度计、红外光谱及荧光分光光度计等手段表征了碳量子点的形态结构,通过微生物抑菌实验,探索了该碳量子点材料对常见革兰氏阴性、阳性细菌以及真菌的抑制效果。结果表明,提取的碳量子点并无抑制大肠杆菌、金黄色葡萄球菌、白色念珠菌、枯草芽孢杆菌、铜绿假单胞菌的功效。因此,从侧面说明可乐碳量子点具有较高的生物安全性。通过浓缩和透析方法获得的碳量子点荧光量子产率较低,会影响CDs在生物成像等方面的应用,这是后续研究中急需改善的地方,本研究不仅拓宽了碳量子点的获取手段,而且为可乐碳量子点后续的提取制备以及生物应用奠定了基础。
[1] Miao P, Han K, Tang Y, et al. Recent advances in carbon nanodots: synthesis, properties and biomedical applications[J]. Nanoscale, 2015, 7(5): 1586-95
[2] 李春凤,王成彬,刘星元,等.发光碳量子点的合成与应用研究进展[J].材料导报,2015,29(26):306-310
LI Chun-feng, WANG Cheng-bin, LIU Xing-yuan, et al.Review on the peogress of application and synthesis of carbon quantum dots [J]. Materials Review, 2015, 29(26):306-310
[3] Hu S, Trinchi A, Atkin P, et al. Tunable photoluminescence across the entire visible spectrum from carbon dots excited by white light [J]. Angew. Chem. Int. Ed., 2015, 54(10): 2970-4
[4] Lin L P, Wang X X, Lin S Q, et al. Research on the spectral properties of luminescent carbon dots [J]. Spectrochim Acta A Mol Biomol Spectrosc, 2012, 95(5): 555-61
[5] Liu Y, Zhao Y, Zhang Y. One-step green synthesized fluorescent carbon nanodots from bamboo leaves for copper(II) ion detection [J]. Sensors and Actuators B:Chemical, 2014, 196(2): 647-652
[6] Cayuela A, Carrillo-Carrion C, Soriano M L, et al. One-step synthesis and characterization of N-Doped carbon nanodots for Sensing in organic media [J]. Anal. Chem., 2016, 88(6):3178-85
[7] Li H, He X, Kang Z, et al. Water-soluble fluorescent carbon quantum dots and photocatalyst design [J]. Angew. Chem. Int.Ed., 2010, 49(26): 4430
[8] Margraf J T, Lodermeyer F, Strauss V, et al. Using carbon nanodots as inexpensive and environmentally friendly sensitizers in mesoscopic solar cells [J]. Nanoscale Horiz.,2016, 1(3): 220-226
[9] Shi L, Li Y, Li X, et al. Facile and eco-friendly synthesis of green fluorescent carbon nanodots for applications in bioimaging, patterning and staining [J]. Nanoscale, 2015,7(16): 394-401
[10] Chen B, Li F, Li S, et al. Large scale synthesis of photoluminescent carbon nanodots and their application for bioimaging [J]. Nanoscale, 2013, 5(5): 1967-71
[11] Goh E J, Kim K S, Kim Y R, et al. Bioimaging of hyaluronic acid derivatives using nanosized carbon dots [J].Biomacromolecules, 2012, 13(8): 2554-61
[12] Li X, Liu Y, Song X, et al. Intercrossed carbon nanorings with pure surface states as low-cost and environment-friendly phosphors for white-light-emitting diodes [J]. Angew. Chem.Int. Ed., 2015, 54(6): 1759-64
[13] Zheng M, Liu S, Li J, et al. Integrating oxaliplatin with highly luminescent carbon dots: an unprecedented theranostic agent for personalized medicine [J]. Adv. Mater., 2014, 26(21):3554-60
[14] Xu X, Ray R, Gu Y, et al. Electrophoretic analysis and purification of fluorescent single-walled carbon nanotube fragments [J]. Journal of the American Chemical Society,2004, 126(40): 12736-12737
[15] Hu s, Nik, Sun J, et al. One-step synthesis of fluorescent carbonnanoparticles by laser irradiation [J]. Mater. Chem.,2009, 19(4): 484-488
[16] Peng H, Travassejdic J. Simple aqueous solution route to luminescent carbogenic dots from carbohydrates [J].Chemistry of Materials, 2015, 21(23): 5563-5565
[17] Liu H, Ye T, Mao C. Fluorescent carbon nanoparticles derived from candle soot [J]. Angewandte Chemie, 2007,46(34): 6473-6475
[18] Pan D, Zhang J, Li Z, et al. Observation of pH-, solvent-,spin-, and excitation-dependent blue photoluminescence from carbon nanoparticles [J]. Chemical Communications, 2010,46(21): 3681-3
[19] Zhu H, Yang X. Microwave synthesis of fluorescent carbon nanoparticles with electrochemiluminescence properties[C],2009:5118
[20] Liu J J, Lu S Y, Tang Q L, et al. One step hydrothermal synthesis of photoluminesecent carbon nanodots with selectively antibacterial activity against Porphyromonas gingivalis [J]. Nanoscale, 2017, 9(21): 7135
[21] Ray S C, Saha A, Jana N R, et al. Fluorescent carbon nanoparticles: Synthesis, characterization, and bioimaging application [J]. J Phys. Chem. C, 2009, 113(43):18546-18551.
