EGCG对高脂饮食诱导的肥胖HFA小鼠脂质代谢的影响
2018-03-01胡凌曾本华王洁董飒爽廖振林王丽魏泓方祥
胡凌,曾本华,王洁,董飒爽,廖振林,王丽,魏泓,方祥
(1.华南农业大学食品学院,广东广州 510642)(2.陆军军医大学基础部实验动物学教研室,重庆 400038)
肥胖能引起Ⅱ型糖尿病、非酒精性脂肪肝、癌症等多种疾病的发生[1],并且导致人身体器官组织代谢失调,从而导致脂肪组织脂肪沉积,是公认的影响人类健康的疾病,目前全球已经有超过10亿的人肥胖或超重。随着人们对健康意识的不断提高,饮茶成为了大多数人追求健康的一种时尚。茶多酚是茶叶中最具有生物活性的成分,具有抗氧化[2,3]、抗癌[4]、预防动脉硬化[5],预防老年痴呆和帕金森疾病[6,7]等作用。茶多酚主要成分为儿茶素类化合物,其中EGCG是儿茶素主要成份[8],约占儿茶素总量的50~60%[9],被认为是茶具备各种生理活性的主要功能物质。除抗氧化、抗癌等功能外,近几年越来越多的研究证实EGCG具有减肥降脂功效,Chen YK等[10]研究发现EGCG能预防SPF级C57BL/6J肥胖小鼠体重、血糖增加以及减轻胰岛素抵抗等功效,L Maksoon等[11]证实EGCG不仅能降低SPF级C57BL/6J小鼠脂肪垫重量,还能降低血脂等。
通过肠道定植正常菌群的小鼠和无菌小鼠模型证实在肠道菌群的协助下,肠道中食物的能量利用率大幅提高,这与体质量的增加和肥胖的发生直接相关[12]。且有实验小鼠通过对无菌小鼠肠道菌群研究显示,肠道菌群和肥胖之间有直接关系[13,14]。然而,目前对于EGCG的研究基本采用是SPF小鼠,其不能够达到反映人肠道菌群与肥胖之间的关系,从而不能真实反映人类肥胖产生或治疗的过程或状态。本研究利用无菌动物接种健康成年人粪便悬液构建人源化菌群小鼠模型,一方面可以一定程度上模拟人肠道菌群生态系统[15],同时也避免了直接利用人进行肠道菌群研究存在的伦理学限制等问题[16]。并同时通过高脂饲料诱导肥胖模型研究EGCG的对肥胖的降脂和保护肝脏的作用,为健康饮茶提供科学依据。
1 材料与方法
1.1 动物、材料与饲料
实验动物:50只3~4周龄无菌KM小鼠(全雄),由陆军军医大学基础部实验动物中心教研室提供。EGCG:购于宁波禾普生物科技有限公司,纯度为80%。饲料:普通纯化饲料(D12450J)和高脂纯化饲料(D12492)均购于开源动物饲料(常州)有限公司,其中普通纯化饲料脂肪含量为10%,高脂纯化饲料脂肪含量为60%。
1.2 仪器与设备
CR22GⅡ高速冷冻离心机,日本Hitachi公司;光学显微镜、DFC420显微摄像头,德国Leica公司;RM2015切片机,德国Leica公司;Rios 5反渗透纯水系统,德国Merk-Millipore公司。
1.3 实验方法
1.3.1 HFA小鼠模型的构建
选择一位3个月未服用抗生素健康志愿者,收集其清晨第一次排出的新鲜粪便,并立即在无菌、厌氧条件下称量10 g加入到90 mL 0.1 M PBS(pH 7.2)缓冲液中[15],震荡混匀,制成粪便悬液,分别给50只无菌KM小鼠各灌胃0.3 mL,人肠道菌群在小鼠体内定植4周构建HFA小鼠模型。无菌昆明小鼠在无菌隔离器中饲养,饲养环境为20~23 ℃,湿度为40%~70%,明暗周期各12 h。饲料和垫料菌经过50 kGy60Co-γ射线辐照灭菌,饮水、鼠笼和饮水瓶等经过高压灭菌传入隔离器。
1.3.2 HFA小鼠肥胖模型的构建
将50只HFA小鼠随机分为两组:高脂组40只,普通组10只;高脂组喂食高脂饲料,普通组喂食普通饲料,期间小鼠自由饮食饮水,每周定时称量体重,8周后,将普通组和高脂组各处死10只,判断肥胖模型是否构建成功。
1.3.3 EGCG干预及分组
将高脂饮食组(30只)分为3组:对照组正常饮水,0.2% EGCG干预组(饮用水中加0.2% EGCG)及0.8%EGCG干预组(饮用水中加0.8% EGCG),喂食普通饲料干预8周,实验期间小鼠自由饮食饮水,每周定时称量体重。
1.3.4 样品采集与处理
小鼠分别在肥胖模型构建8周和EGCG干预8周后禁食12 h,眼球取血,放置半小时后3000 r/min离心15 min收集血清,血清生化指标由陆军军医大学西南医院检验科检验。快速解剖出肝脏和附睾脂肪垫,称重并将其于置于4%多聚甲醛中固定24 h,石蜡包埋,切片5 μm,苏木精-伊红(HE)染色,最后中性树胶封片制作肝脏和附睾脂肪垫HE染色切片。并利用Image pro-plus 6.0图像处理软件对脂肪细胞长径、短径及面积进行测量。
1.3.5 统计学方法
实验结果以平均值±标准误表示,利用Graph Pad Prism 6统计软件进行数据统计分析,组间差异比较采用t检验,以p<0.05为有显著差异,p<0.01为极显著差异。
2 结果与讨论
2.1 EGCG对肥胖HFA小鼠体重、肝重及脂肪垫重量变化影响
肥胖常常伴随高血脂等多种代谢性疾病的发生,而肥胖原因多半是由于膳食结构不合理和高糖高脂饮食的摄入导致,现如今随着人们对肥胖越来越关注,构建肥胖模型是研究肥胖相关疾病及减药物肥最有用工具[17],高脂饮食诱导肥胖与人类肥胖最为接近[17]。
表1为高脂饮食干预8周后小鼠体重、肝重和附睾脂肪垫重量变化。试验前各小组体重无显著差异,高脂饮食8周后,高脂组小鼠体重显著增加(p<0.05),平均体重较普通组增加了24%。根据人类肥胖和超重标准,肥胖度大于20%视为肥胖模型构建成功[18],说明本实验HFA小鼠肥胖模型构建成功。同时由表1可知普通组肝重和附睾脂肪垫重量分别为1.69±0.15,0.58±0.06,高脂组肝重和附睾脂肪垫的重量分别为2.26±0.12,2.67±0.18,高脂组肝重和附睾脂肪垫重量较普通组显著升高(p<0.05,p<0.01),说明高脂饮食能显著增加HFA小鼠肝重和脂肪沉积。
表2为EGCG干预8周后小鼠体重、肝重及附睾脂肪垫重量变化。由表2可知低剂量组和高剂量组HFA小鼠体重和肝重较对照组都有降低,但差异无统计学意义;同时对照组、低剂量组以及高剂量组附睾脂肪垫重量分别为1.08±0.17、0.97±0.19和0.56±0.13,低剂量EGCG组和高剂量EGCG组附睾脂肪垫重量较对照组分别降低了10.19%、48.15%,高剂量组显著低于对照组(p<0.05),这与附有EGCG的高脂饲料喂养小鼠较只有高脂饲料喂养的SD大鼠的脂肪垫重量明显降低[19,20]的结论一致,说明EGCG能减轻HFA肥胖小鼠体内脂肪沉积,且呈剂量效应关系。
2.2 EGCG对肥胖HFA小鼠血清中血糖血脂的影响
表3为高脂饮食干预8周后血糖血脂变化。高脂组小鼠空腹血糖(GLU)、总胆固醇(Tch)含量较普通组分别升高了55.48%、24.48%,高脂组GLU和Tch含量均显著高于普通组(p<0.05),甘油三酯(TG)和低密度脂蛋白胆固醇(LDL-C)含量较普通组有一定升高,高密度脂蛋白胆固醇(HDL-C)较普通组降低。
总胆固醇含量升高是导致动脉粥样硬化重要原因之一[21],低密度脂蛋白是将胆固醇运载到组织和细胞中,在转运过程中可能会有胆固醇沉积在血管壁上,因此LDL-C含量升高可能会导致冠心病发生[22]。本研究利用EGCG干预8周后结果显示(表4),高剂量EGCG干预组总胆固醇(Tch)和低密度脂蛋白胆固醇(LDL-C)含量较对照组分别降低了28.64%和43.16%(p<0.05,p<0.05),另外,干预组空腹血糖(GLU)和甘油三酯(TG)含量较对照组有一定降低,高密度脂蛋白胆固醇(HDL-C)较对照组有一定升高,但差异不显著。

表1 高脂饮食对小鼠体重、肝重及脂肪垫重量的影响Table 1 Effects of high-fat diet on the bodyweight, liver weight and fat pad weight of mice
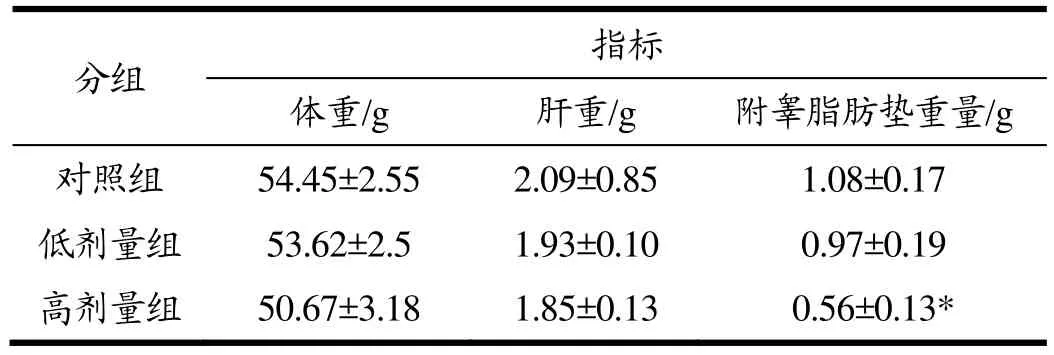
表2 EGCG干预对小鼠体重、肝重及脂肪垫重量的影响Table 2 Effects of EGCG on the bodyweight, liver weight and fat pad weight of mice
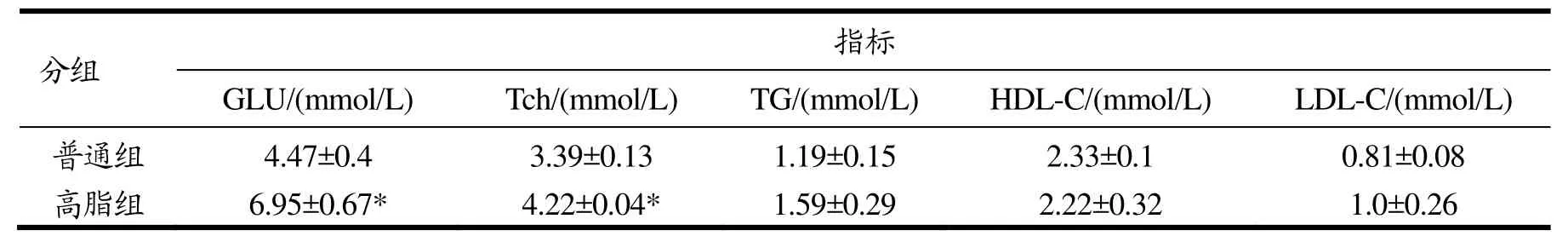
表3 高脂饮食对小鼠血糖血脂含量的影响Table 3 Effect of high fat diet on blood glucose and blood lipid levels of mice
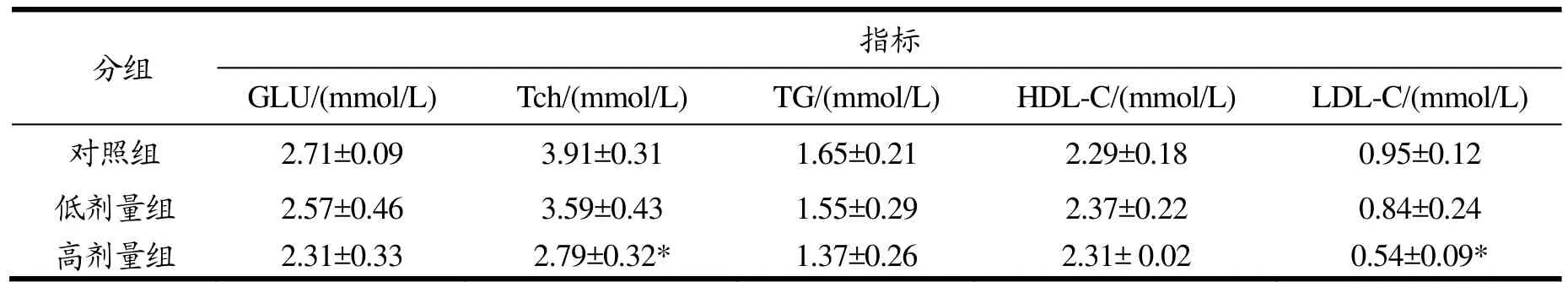
表4 EGCG干预对小鼠血清中血糖血脂含量的影响Table 4 Effect of EGCG on serum glucose and blood lipid levels of mice
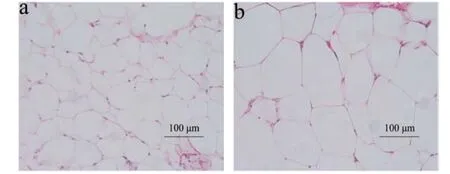
图1 小鼠脂肪细胞HE染色Fig.1 HE staining of adipocytes in mice

图2 小鼠脂肪细胞HE染色Fig.2 HE staining for adipocytes of mouse
2.3 EGCG对肥胖HFA小鼠脂肪细胞形态及大小的影响
脂肪细胞在HE染色下,细胞内的脂肪被溶解而成空泡状。由图1可看出高脂饮食8周后,同一视野下高脂组脂肪细胞数明显少于普通组,且脂肪细胞明显膨大,而普通组细胞形态大小较小且均一。通过Image pro-plus 6.0图像处理软件测量结果显示,普通组脂肪细胞短径、长径、面积分别为54.22±3.3、71.93±3.51和3404±318,高脂组脂肪细胞短径、长径、面积分别为100±4.2、136±9.36和8956±1290,普通组脂肪细胞短径、长径、面积均极显著小于高脂组(表5,p<0.001),由此说明长期高脂饮食在增加机体内脂肪沉积同时也会增大脂肪细胞,而白色脂肪增加和脂肪细胞肥大是肥胖的典型特征[23]。
EGCG干预8周后脂肪细胞切片如图2所示,同一视野下对照组脂肪细胞数量明显多于EGCG干预组细胞数量,对照组细胞大且形态不均一,EGCG干预组细胞形态均一,且细胞短径、长径及面积均极显著小于对照组细胞(表6,p<0.001),低剂量组脂肪细胞短径、长径及面积大小较对照组减少27.38%、42.17%和53.93%,高剂量组脂肪细胞短径、长径及面积大小较对照组分别减少了35%、41.25%和60.54%,说明EGCG干预对于HFA肥胖小鼠脂肪细胞大小有一定的抑制作用。
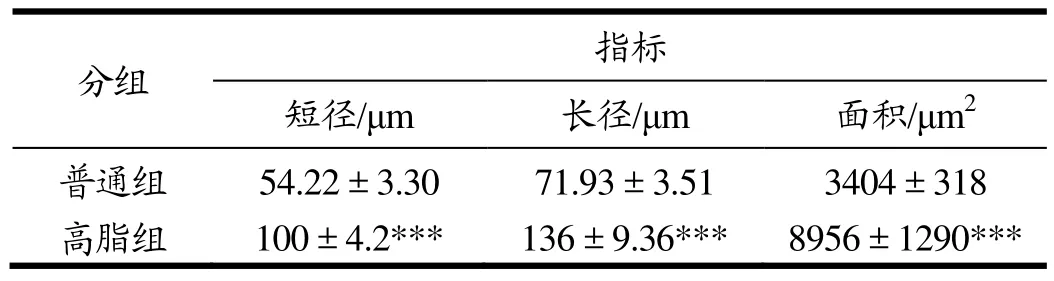
表5 高脂饮食对小鼠脂肪细胞大小的影响Table 5 Effects of high-fat diet on the adipocyte size of mice

表6 EGCG干预对小鼠脂肪细胞大小的影响Table 6 Effects of EGCG on the adipocyte size of mice
2.4 肝脏HE染色
长期高脂饮食会加重脂质在肝脏的沉积和脂肪变性,容易引起或加重肝损伤。通过研究EGCG对由高脂饮食诱导的肥胖小鼠肝损伤修复作用,为健康饮茶提供科学依据。
图3为高脂饮食8周后小鼠肝脏HE染色切片。普通组肝细胞排列整齐,细胞结构清晰,细胞核位于细胞中央,无脂肪变性,高脂组脂肪变性严重,脂肪空泡较多,视野中分布较集中,中央静脉周围脂肪变性更为明显。
图4为EGCG干预8周后小鼠肝脏HE染色切片。由图可看出,对照组肝脏仍有较多脂肪空泡,脂肪变性仍较为严重,低剂量EGCG组和高剂量EGCG组脂肪变性程度都有所减轻,其中高剂量作用效果更为明显,这可能是因为EGCG通过调节机体内脂质代谢,从而改善了肝脏脂肪变性程度。

图3 小鼠肝脏HE染色Fig.3 HE staining for liver of mouse
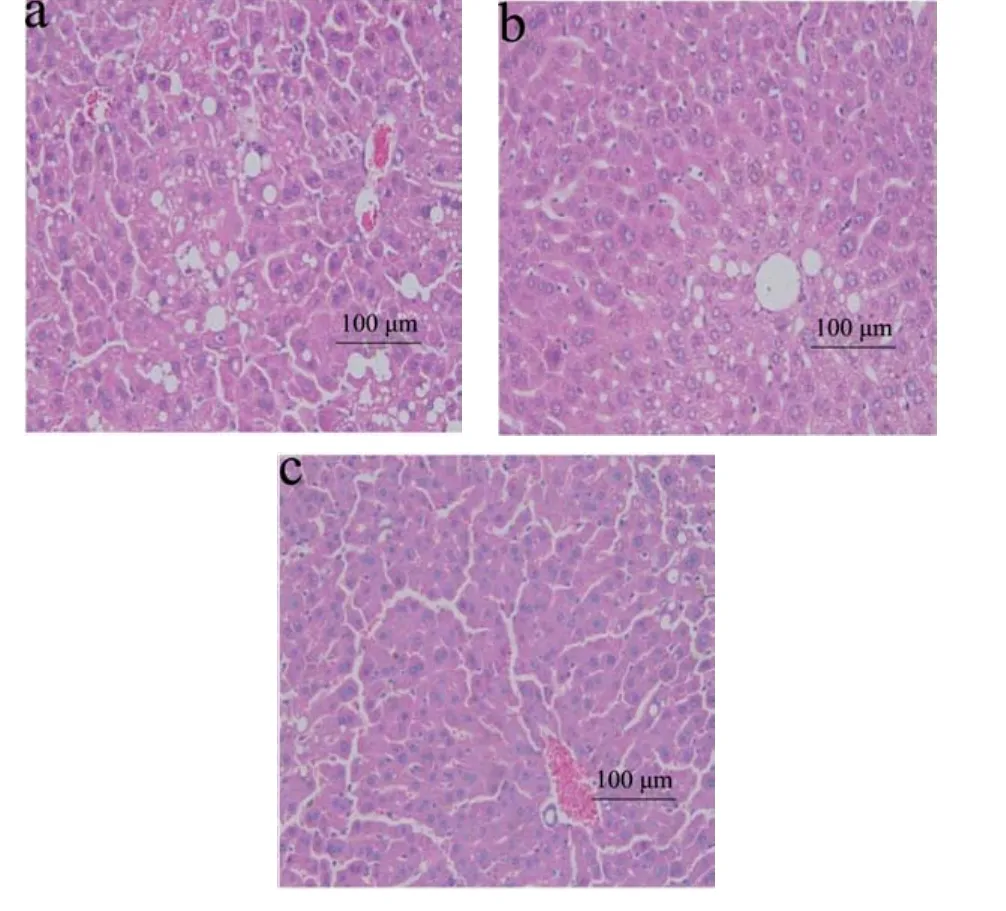
图4 小鼠肝脏细胞HE染色Fig.4 HE staining for liver of mouse
3 结论
本研究首先通过构建人源菌群小鼠模型,达到更好的模拟人肠道菌群环境,再利用高脂饮食诱导小鼠肥胖,使小鼠体重、肝重、附睾脂肪垫重量以及空腹血糖(GLU)和总胆固醇(Tch)含量都发生了显著性增加,高脂组小鼠脂肪细胞大小明显增大并且肝脏HE染色脂肪变性严重。进而,再利用构建的HFA肥胖小鼠模型证实EGCG是否具有治疗肥胖的功效。EGCG干预8周后结果显示,EGCG干预组小鼠的附睾脂肪垫重量、总胆固醇(Tch)和低密度脂蛋白胆固醇(LDL-C)含量较对照组都有显著降低。同时EGCG能使人源性肥胖小鼠的脂肪细胞恢复成接近正常小鼠脂肪细胞,且使肝脏细胞脂滴明显变少、减轻肝脏脂肪变性症状。这些数据表明高脂饮食可以诱导肥胖产生,且除已报道的EGCG能抑制高脂饮食诱导肥胖产生外[24],EGCG对高脂饮食诱导的小鼠肥胖具有一定的治疗效果。
综上所述,EGCG可以通过降低血糖血脂、减轻肝脏损伤及改善脂肪组织形态对高脂饮食诱导人源性肥胖小鼠起到减肥和修复肝脏作用,这对治疗人类肥胖及其产生的代谢综合症有一定的指导作用;但其确切的作用机制有待于进一步研究。
[1] Harley I T W, Giles D A, Pfluger P T, et al. Differential colonization with segmented filamentous bacteria and Lactobacillus murinus do not drive divergent development of diet-induced obesity in C57BL/6 mice [J]. Molecular Metabolism, 2013, 2(3): 171
[2] Yen G C, Chen H Y. Antioxidant activity of various tea extracts in relation to their antimutagenicity [J]. Journal of Agricultural & Food Chemistry, 1995, 43(1): 27-32
[3] Fatima M, Rizvi S I. Anti-oxidative effect of black tea theaflavin on erythrocytes subjected to oxidative stress [J].National Academy Science Letters, 2015, 38(1): 25-28
[4] Zhang G, Wang Y, Zhang Y, et al. Anti-cancer activities of tea epigallocatechin-3-gallate in breast cancer patients under radiotherapy [J]. Current Molecular Medicine, 2012, 12(2):163-176
[5] Lee W, Min W K, Chun S, et al. Long-term effects of green tea ingestion on atherosclerotic biological markers in smokers[J]. Clinical Biochemistry, 2005, 38(1): 84-87
[6] Mandel S A, Amit T, Weinreb O, et al. Simultaneous manipulation of multiple brain targets by green tea catechins:A potential neuroprotective strategy for Alzheimer and Parkinson diseases [J]. CNS Neuroscience &Therapeutics,2008, 14(4): 352-365
[7] Anandhan A, Tamilselvam K, Radhiga T, et al. Theaflavin,a black tea polyphenol, protects nigra dopaminergic neurons against chronic MPTP/probenecid induced Parkinson's disease [J]. Brain Research, 2012, 1433(1433): 104-113
[8] Hamdaoui M H, Snoussi C, Dhaouadi K, et al. Tea decoctions prevent body weight gain in rats fed high-fat diet;black tea being more efficient than green tea [J]. Journal of Nutrition & Intermediary Metabolism, 2016, 6: 33-40
[9] 葛建,林芳,李明揆,等.表没食子儿茶素没食子酸酯(EGCG)生物活性研究进展[J].安徽农业大学学报,2011,38(2):156-163
GE Jian, LIN Fang, LI Ming-Kui, et al. Research progress on the biological activity of (-)-epigallocatechin-3- Gallate [J].Journal of Anhui Agricultural University, 2011, 38(2):156-163
[10] ChenY K, Cheung C, Reuhl K R, et al. Effects of green tea polyphenol (-)-epigallocatechin-3-gallate on newly developed high-fat/Western-style diet-induced obesity and metabolic syndrome in mice [J]. J Agric. Food Chem., 2011, 59(21):11862-11871
[11] Maksoon L, Chongtai K, Yangha K. Green tea(-)-epigallocatechin-3-gallate reduces body weight with regulation of multiple genes expression in adipose tissue of diet-induced obese mice [J]. Annals of Nutrition &Metabolism, 2009, 54(2): 151-157
[12] Bäckhed F, Ding H, Wang T, et al. The gut microbiota as an environmental factor that regulates fat storage. Proc Natl Acad Sci USA 101: 15718-15723 [J]. Proceedings of the National Academy of Sciences, 2004, 101(44): 15718-15723[13] Bäckhed F, Manchester J K, Semenkovich C F, et al.Mechanisms underlying the resistance to diet-induced obesity in germ-free mice [J]. Proceedings of the National Academy of Sciences of the United States of America, 2007, 104(3):979
[14] Rabot S, Membrez M, Bruneau A, et al. Germ-free C57BL/6J mice are resistant to high-fat-diet-induced insulin resistance and have altered cholesterol metabolism [J]. Faseb Journal,2010, 24(12): 4948
[15] 曾本华.建立IHFA小鼠模型研究阿莫西林对婴儿肠道菌群的影响[D].重庆:第三军医大学,2012
ZENG Ben-hua. Establishment of an IHFA mouse model for evalueting the effect of amoxicillin treatment on infant gut microbiota [D]. Chongqing: the Third Military Medical University, 2012
[16] 张晓婧,曾本华,刘智伟,等.两种不同品系小鼠的人源菌群模型的建立与肠道菌群的比较[J].中国微生态学杂志,2013,25(4):376-380
ZHANG Xiao-jing, ZENG Ben-hua, LIU Zhi-wei, et al.Establishment of two strains of HFA mice models and comparison of their intestinal microbiota [J]. Chinese Journal of Microecology, 2013, 25(4): 376-380
[17] 胡晓东,李鸿炎.饮食诱导小鼠肥胖疾病模型的建立[J].南昌大学学报(医学版),2012,52(8):6-9
HU Xiao-dong, LI Hong-yan, Establishment of a mouse model of diet-induced obesity [J]. Journal of Nanchang University(Meidical Science), 2012, 52(8): 6-9
[18] 陈粉粉,郭爱伟,周杰珑,等.ICR小鼠肥胖模型的建立以及肥胖指标和脂肪组织形态学比较[J].安徽农业科学,2012,40(5):2720-2720
CHEN Fen-fen, GUO Ai-wei, ZHOU Jie-long. Establishment of the obesity model of ICR mice and the comparison of the obesity index and morphology of adipose tissue [J]. Journal of Anhui Agricultural Sciences, 2012, 40(5): 2720-2723
[19] 韩超,范小兵,王少康,等.表没食子儿茶素没食子酸酯对肥胖模型大鼠减肥作用的实验研究[J].现代医学,2008,36(3):197-199
HAN Chao, FAN Xiao-bing, WANG Shao-kang, et al. Study on the effect of (-)-Epigallocatechin-3-Gallate on obesity in obese rats [J]. Modern Medical Journal, 2008, 36(3): 197-199[20] Wolfram S, Raederstorff D, Wang Y, et al. TEAVIGOTM(Epigallocatechin Gallate) supplementation prevents obesity in rodents by reducing adipose tissue mass [J]. Annals of Nutrition & Metabolism, 2005, 49(1): 54-63
[21] 蔡景伟,庞美丽,金华.高总胆固醇与颈动脉粥样硬化斑块相关性的临床研究[J].现代医用影像学,2003,12(4):156-158
CAI Jing-wei, PANG Mei-li, JIN Hua. A reltativity clinical study on high plasma total cholesterol and carotid atherosderotic plaque [J]. Modern Medical Imageology, 2003,12(4): 156-158
[22] 赵水平.冠心病防治中降低低密度脂蛋白胆固醇为首要目标[J].临床荟萃,2006,21(20):229-233
ZHAO Shui-ping. The primary objective of the prevention and treatment of coronary heart disease is Lowering low-density lipoprotein cholesterol level [J]. Clinical Focus,2006, 21(20): 229-233
[23] 王玲,曾艺涛,丁晓雯,等.DNJ对正常小鼠脂代谢的影响及作用机理初探讨[J].现代食品科技,2017,33(4):6-12
WANG Ling, ZENG Yi-tao, DING Xiao-wen, et al. Effect of 1-Deoxynojirimycin on lipid metabolism in normal mice and preliminary exploration of the underlying mechanism [J].Modern Food Science and Technology, 2017, 33(4): 6-12
[24] Bose M, Lambert J D, Ju J, et al. The major green tea polyphenol,(-)-Epigallocatechin-3-Gallate,inhibits obesity,metabolic syndrome, and fatty liver disease in High-Fat-Fed mice [J]. Journal of Nutrition, 2008, 138(9): 1677
