复方苍术方调节肠道菌群及肠道保护作用的研究
2018-03-01曾宏亮肖满陈波曾文彬
曾宏亮,肖满,陈波,曾文彬
(1.中南大学药学院,湖南长沙 410013)(2.湖南方盛制药股份有限公司,国家级博士后工作站,湖南长沙 410205)
肠道菌群是人体最庞大、最重要的微生态系统,健康成人肠道栖息着多达500余种细菌,包含的细菌数达1014个,其基因组信息的总和被称“肠道元基因组”,是控制人体健康的“人体第二基因组”。随着研究的不断深入,人们逐渐发现,肠道菌群在消化过程发挥作用,还与人体健康有着极为密切的联系,肠道菌群不仅参与宿主的消化、吸收、代谢、营养和免疫等生理过程,且与机体形成相互依存、相互收益、相互协调又相互制约的动态平衡。肠道菌群的平衡分布对人体健康尤为重要,与胃肠道疾病、阿尔兹海默症、肥胖、糖尿病、心血管疾病及自身免疫性疾病等的发生发展有着密切联系[1]。
小肠是营养物质消化和吸收的重要场所,小肠黏膜结构是抵抗有害菌入侵的坚固壁垒,同时肠道菌群形成一道生物保护屏障,对外来致病菌的侵入、定植起到拮抗作用,并且有助于肠道微绒毛的产生。小肠绒毛(A)可在环形皱襞的基础上进一步增大小肠吸收的面积,同时也起到过滤物质的作用,其对应的隐窝(V)深度越浅,营养物质的吸收能力更强,二者的比值(A/V)是衡量小肠消化吸收功能的重要指标。此外,人体肠道双歧杆菌等厌氧菌的繁殖,以及对乳酸发酵,产生丰富短链脂肪酸,导致肠道pH不断下降,抑制潜在致病菌生长,但当肠道菌群失衡时,肠道优势菌下降,产酸能力下降,导致pH上升,因此肠道内环境pH与肠道菌群的结构与数目息息相关[2]。
低聚半乳糖能使肠道益生菌大量增殖,形成数量优势,然后促进分泌更多的短链脂肪酸,形成酸性环境,抑制致病菌的正常生长,并且能够促进肠道蠕动,从而调节肠道菌群结构,具有公认的调节肠道菌群作用[3,4]。然而,越来越多的中草药或其制剂调节胃肠道功能的研究结果表明,中草药能够抗腹泻、扶植正常菌群生长,调节失调菌群,提高益生菌的定植能力,是理想的微生态调节剂[5,6]。进一步的研究表明中草药与微生态制剂在调节肠道菌群方面作用相同,殊途同归,二者联用效果更佳[7,8]。
本研究将低聚半乳糖与祛湿降浊、保健脾胃类中药组方联用,即复方苍术方,观察该配方对小鼠肠道菌群结构、肠道微环境、肠粘膜屏障的影响,综合评价其对胃肠功能的调节作用。
1 材料与方法
1.1 受试物
复方苍术方;深褐色悬浊液,口服液体玻璃瓶密封包装,10 mL/支,主要成分为苍术1 g、薏苡仁1.5 g、蒲公英0.5 g,山楂1 g及低聚半乳糖浆2.25 g,由中南大学药学院提供。低聚半乳糖为无色透明状糖浆;250 mL/瓶,纯度为43%,质量标准符合新食品原料的规定,批号709387,购自戴纬林国际贸易(上海)有限公司。
1.2 实验动物
雄性Balb/c小鼠60只(SPF级),平均体重21.2 g,体重范围19.2~22.9 g,购自湖南斯莱克景达实验动物有限公司。实验动物质量合格证号:No.43004700 028802。雄性ICR小鼠60只(SPF级),平均体重23.4 g,体重范围为20.5~24.9 g,购自湖南斯莱克景达实验动物有限公司,实验动物质量合格证号:No.430047 00028716。
1.3 主要试剂与仪器
主要试剂:0.01M pH 7.2磷酸盐缓冲液;伊红美蓝琼脂(EMB,批号3105410,广东环凯微生物科技有限公司);BBL琼脂(批号20161109,青岛高科园海博生物技术有限公司);LBs琼脂(批号160525,北京陆桥技术有限责任公司);胰䏡-亚硫酸盐-环丝氨酸琼脂(TSC,批号160601,北京陆桥技术有限责任公司);肠球菌(叠氮钠-结晶紫-七叶苷)琼脂(批号160512,北京陆桥技术有限责任公司);D-环丝氨酸(批号161020,北京陆桥技术有限责任公司);柠檬酸铁铵(批号160728,青岛高科园海博生物技术有限公司);复方地芬诺酯片(每片含盐酸地芬诺脂2.5 mg,批号1507013,常州康普药业有限公司,有效期至2018.06);阿拉伯树胶(批号20160104,国药集团化学试剂有限公司)。主要仪器:BSC-1100ⅡA2-X型生物安全柜(济南鑫贝西生物有限公司);PYL-230型电热恒温培养箱(天津市莱伯特瑞);BX43型生物显微镜+MD50型数码成像系统(奥林巴斯);PHSJ-5型pH计(上海雷磁仪器厂)。
1.4 实验方法[9,10]
1.4.1 剂量设计
复方苍术方人体拟食用量为20 mL/日,成人体重按60 kg计,该试验将复方苍术方人体推荐食用量的5倍、10倍、20倍,分别设置为低、中、高剂量组;阳性对照品低聚半乳糖糖浆人体推荐食用量为4.5 g/日,该试验采用人体推荐食用量的10倍进行试验,即给样剂量为0.75 g/kg(即1.74 mL原液/kg)。
1.4.2 分组及给药
选取检疫合格的雄性Balb/c小鼠60只(SPF级),体重范围19.2~22.9 g,实验动物按体重随机分为5组,即溶媒对照组、阳性对照组、复方苍术方低剂量组、复方苍术方中剂量组、复方苍术方高剂量组,每组12只,按20 mL/kg灌胃给予相应受试物(溶媒对照组灌胃给予等量蒸馏水),每日一次,连续给样30 d。给予受试物前及末次给样24 h后检测肠道菌群、盲肠内容物pH,并对十二指肠、空肠、回肠、结肠做病理切片,测量小肠绒毛长度、隐窝深度以及二者的比值。
选取检疫合格的雄性ICR小鼠60只(SPF级),体重范围为20.5~24.9 g,实验动物按体重随机分为6组,即溶媒对照组、模型对照组、复方苍术方低剂量组、复方苍术方中剂量组、复方苍术方高剂量组、阳性对照组,每组10只,按20 mL/kg灌胃给予相应受试物,溶媒对照组、模型对照组、阳性对照组灌胃给予等量蒸馏水或低聚半乳糖溶液,每日一次,连续给样30 d,用于检测小肠推进率。
1.4.3 肠道菌群培养计数
雄性Balb/c小鼠给予受试物前及末次给样后24 h,按《保健食品检验与评价技术规范》2003版规定检测肠道菌群菌落数,连续两只小鼠的粪便放入同一无菌离心管,结果以菌落数的对数值(lg CFU)表示,并按规范规定的结果判定标准对实验结果进行分析。
1.4.4 盲肠内容物pH值
末次给样24 h后,取盲肠内容物于离心管内,称重,用单蒸水以1:9稀释样品,涡旋、超声混匀,3000 r离心5 min,取上清液测定pH值,每个样品重复测三次,计算平均值。
1.4.5 肠道病理形态学分析及粘膜结构观察
取小鼠胃肠组织,用10%福尔马林溶液固定后,分别取十二指肠、空肠、回肠、结肠进行常规石蜡包埋、切片、染色,并于光学显微镜下观察小肠粘膜结构,每段小肠取3张切片,每张切片选2~5个视野拍照,应用Leica照相处理软件拍照,每张照片测量5根最长肠绒毛的长度(以肠腺绒毛连接处到绒毛顶端为准)及对应的隐窝深度(以肠腺绒毛连接处到肠腺基部为准),并计算二者的比值(A/V)。
1.4.6 小肠推进率测定
ICR小鼠末次给样前禁食不禁水14 h,按《保健食品检验与评价技术规范》2003版规定检测推进率。
1.4.7 统计学方法
采用SPSS 16.0进行统计分析,统计学意义的水平设定为p<0.05,计量资料采用均数±标准差(¯x±s)表示,用Leven’s test方法检验正态性和方差齐性,如果符合正态性和方差齐性(p>0.05),用单因素方差分析(ANOVA)和LSD test进行统计分析;如果不符合正态性和方差齐性(p≤0.05),则用Kruskal-Wallis检验。
如果Kruskal-Wallis检验有统计学意义(p≤0.05),则用Dunnett’s Test(非参数方法)进行比较分析;重复测量资料,满足球对称和齐性时,采用单样本重复测量资料方差分析或成组重复测量资料方差分析,不符合球对称时,要校正F界值;评价时考虑统计学差异和生物学意义。
2 实验结果
2.1 复方苍术方对小鼠体重的影响
如表1~2所示,与溶媒对照组相比,调节肠道菌群试验和小肠推进试验各给样组动物在各称重时间点的平均体重均未见统计学差异(p>0.05)。
表1 复方苍术方对调节肠道菌群试验小鼠体重的影响(±SD,n=12)Table 1 Effects of Atractylodes Decoction prescription on the body weight of Balb/c mice in intestinal flora experiment
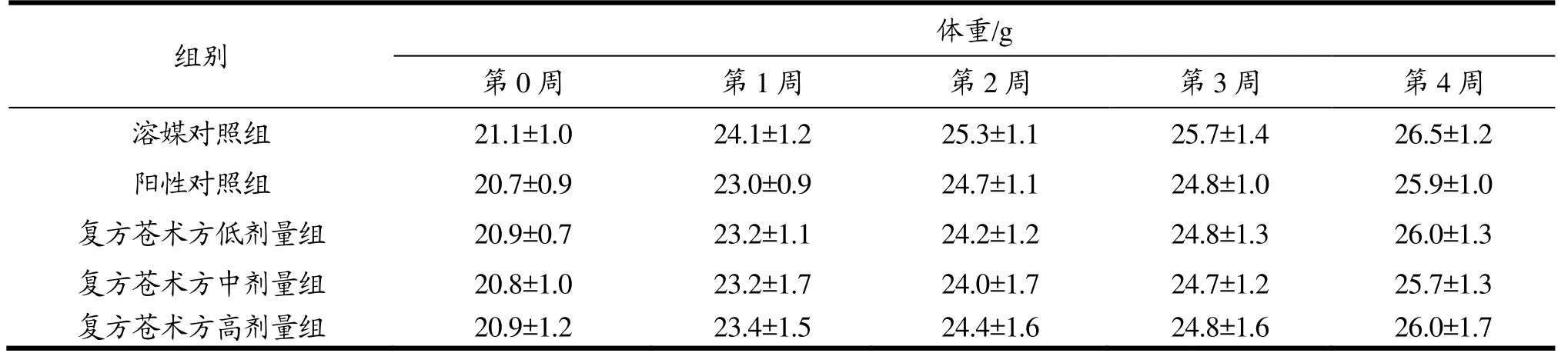
表1 复方苍术方对调节肠道菌群试验小鼠体重的影响(±SD,n=12)Table 1 Effects of Atractylodes Decoction prescription on the body weight of Balb/c mice in intestinal flora experiment
注:与溶媒对照组相比,*p<0.05。
组别体重/g第0周 第1周 第2周 第3周 第4周溶媒对照组 21.1±1.0 24.1±1.2 25.3±1.1 25.7±1.4 26.5±1.2阳性对照组 20.7±0.9 23.0±0.9 24.7±1.1 24.8±1.0 25.9±1.0复方苍术方低剂量组 20.9±0.7 23.2±1.1 24.2±1.2 24.8±1.3 26.0±1.3复方苍术方中剂量组 20.8±1.0 23.2±1.7 24.0±1.7 24.7±1.2 25.7±1.3复方苍术方高剂量组 20.9±1.2 23.4±1.5 24.4±1.6 24.8±1.6 26.0±1.7

表2 复方苍术方对小肠推进试验小鼠体重的影响(X±SD,n=10)Table 2 Effects of Atractylodes Decoction prescription on the body weight of Balb/c mice in intestine propulsion experiment
2.2 肠道菌群菌落数
试验结果表明:按lg CFU计,给样前各组间小鼠粪便肠杆菌、肠球菌、产气荚膜梭菌、乳杆菌和双歧杆菌菌落数均无统计学差异。给样后,与溶媒对照组相比,阳性对照组肠杆菌数显著降低(p<0.01),复方苍术方中、高剂量组虽具有降低趋势,但未见统计学差异;复方苍术方高剂量组及阳性对照组肠杆菌菌落数与同组给样前相比均明显或显著降低(p<0.05或p<0.01),lg CFU降低率分别为8.17%、11.86%(图1)。与溶媒对照组相比,复方苍术方低、高剂量组及阳性对照组肠球菌数均明显降低(p<0.05);复方苍术方中、高剂量组肠球菌菌落数与同组给样前相比均明显降低(p<0.05),lg CFU降低率分别为6.35%、5.69%(图2)。
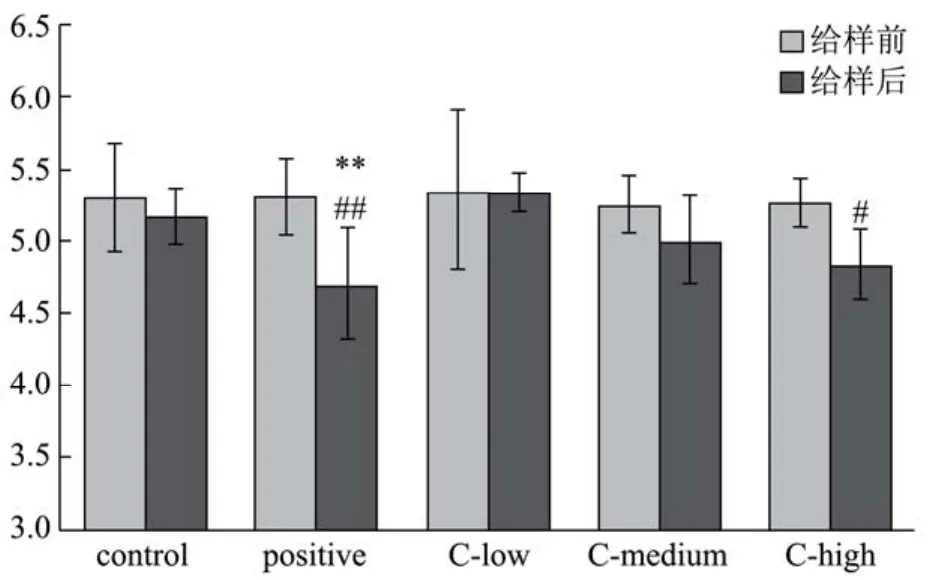
图1 复方苍术方对小鼠粪便肠杆菌的影响(C-复方苍术方)Fig.1 Effects of Atractylodes decoction prescription on the Escherichia coli of faeces in mice

图2 复方苍术方对小鼠粪便肠球菌的影响(C-复方苍术方)Fig.2 Effects of Atractylodes decoction prescription on the enterococcus of faeces in mice
与溶媒对照组相比,除复方苍术方中剂量组乳杆菌外,各剂量组及阳性对照组双歧杆菌、乳杆菌菌落数均明显或显著增加(p<0.05或p<0.01);复方苍术方中、高剂量组双歧杆菌、乳杆菌菌落数与同组给样前相比亦均明显或显著增加(p<0.05或p<0.01),lg CFU增加率分别为6.99%、8.10%、7.04%及6.74%;与阳性对照组相比,复方苍术方高剂量组乳杆菌菌落数及中、高剂量组双歧杆菌菌落数均明显增加(p<0.05),lg CFU增加率分别为3.03%、2.00%及2.33%(图3~4)。给样后复方苍术方各剂量组及阳性对照组产气荚膜梭菌菌落数未见统计学差异(图5)。

图3 复方苍术方对小鼠粪便乳杆菌的影响(C-复方苍术方)Fig.3 Effects of Atractylodes decoction prescription on the lactobacillus of faeces in mice

图4 复方苍术方对小鼠粪便双歧杆菌的影响(C-复方苍术方)Fig.4 Effects of Atractylodes decoction prescription on the bifidobacteria of faeces in mice

图5 复方苍术方对小鼠粪便产气荚膜梭菌的影响(C-复方苍术方)Fig.5 Effects of Atractylodes decoction prescription on the clostridium perfringens of faeces in mice
2.3 盲肠内容物pH

图6 复方苍术方对小鼠盲肠内容物pH值影响(C-复方苍术方)Fig.6 Effects of Atractylodes decoction prescription on pH value
如图6所示,与溶媒对照组相比,复方苍术方中、高剂量组小鼠盲肠内容物pH值均显著降低(p<0.01),阳性对照组盲肠内容物pH值具有降低趋势,但未见统计学差异。
2.4 肠道粘膜结构观察结果
给样30 d后,与溶媒对照组相比,复方苍术方各剂量组十二指肠、空肠、回肠绒毛长度均不同程度的增长,高剂量组十二指肠绒毛长度显著增长(p<0.01);其对应的隐窝深度均不同程度变浅,中剂量组十二指肠、高剂量组回肠以及中、高剂量组空肠隐窝深度均明显或显著变浅(p<0.05或p<0.01)。
与阳性对照组相比,中剂量组十二指肠以及低、中、高剂量组回肠隐窝深度亦明显或显著变浅(p<0.05或p<0.01)。低剂量组十二指肠、回肠及中、高剂量组十二指肠、空肠、回肠A/V比值明显或显著增加(p<0.05或p<0.01),增加率分别为29.84%、17.47%、56.01%、31.18%、20.09%、46.51%、30.52%和20.09%,与阳性对照组相比复方苍术方中、高剂量组空肠、回肠A/V比值亦明显或显著增加(p<0.05或p<0.01),增加率分别为12.08%、11.51%、15.06%和15.06%(如表3~5所示)。

表3 复方苍术方对Balb/c小鼠十二指肠粘膜结构的影响(X±SD,n=6)Table 3 Effects of Atractylodes Decoction prescription on the duodenal mucosal structure in Balb/c mice

表4 复方苍术方对Balb/c小鼠空肠粘膜结构的影响(X±SD,n=6)Table 4 Effects of Atractylodes Decoction prescription on the jejunal mucosal structure in Balb/c mice

表5 复方苍术方对Balb/c小鼠回肠粘膜结构的影响(X±SD,n=6)Table 5 Effects of Atractylodes Decoction prescription on the ileal mucosal structure in Balb/c mice
2.5 墨汁推进率

图7 复方苍术方对小鼠小肠墨汁推进率影响(C-复方苍术方)Fig.7 Effects of Atractylodes decoction prescription on the intestinal propulsion rates in mice
如图7所示,与溶媒对照组相比,模型对照组墨汁推进率显著降低(p<0.01)。与模型对照组相比,复方苍术方各剂量组动物墨汁推进率呈剂量依赖性显著增加(p<0.01),增加率分别为43.92%、69.93%和98.31%,阳性对照组墨汁推进率亦明显增加(p<0.05);与阳性对照组相比,复方苍术方中、高剂量组墨汁推进率显著增加(p<0.01),增加率分别为30.31%和52.07%。
3 讨论
肠道菌群与机体形成相互依存、相互收益、相互协调又相互制约的动态的统一平衡体,称为肠道微生态平衡。现有研究表明多种胃肠道疾病、肥胖、糖尿病、心血管疾病和自身免疫性疾病的发生及发展的过程中均伴有肠道菌群失衡现象[1]。益生菌制剂通过补充有益菌达到菌群平衡的状态,而中药可以通过抑制某些致病菌或者促进有益菌的增殖来维持菌群平衡。中药的这种双向调节功能对于严重疾病的治疗方面明显优于益生菌制剂。
随着人们对肠道菌群与疾病发生及人体健康之间相关性认识的日益深入,中药对肠道菌群的调节作用也日益受到研究者的关注。研究表明多种中药及其活性成分如四君子汤[11]、党参多糖[12]等均能促进肠道益生菌的生长,中药对人肠道菌群的调节作用,也可能是其发挥药效作用的重要环节之一。复方苍术方组方合理,山楂消食开胃,蒲公英清热解毒,苍术燥湿健脾,薏苡仁渗湿健脾[13],配伍使用具有健脾开胃、行气消食及清热解毒之功效。将公认的益生元低聚半乳糖与祛湿降浊、健脾开胃类中药配伍联用形成复方苍术方(原料为低聚半乳糖、苍术、薏苡仁、蒲公英、山楂),观察该配方对肠道菌群功能和胃肠蠕动的调节作用。
本研究按照《保健食品检验与评价技术规范》(2003年版)中调节肠道菌群试验、小肠推进试验方法的规定及相关文献资料报道的检测肠道pH值和肠道粘膜结构等研究方法,综合评价复方苍术方对肠道菌群、肠道pH值及胃肠蠕动功能的调节作用。试验结果表明复方苍术方能够调节肠道菌群结构,改善肠道微环境,增强肠道粘膜屏障作用,促进胃肠蠕动功能,且效果优于单用低聚半乳糖。上述结果提示,复方苍术方可能通过调节肠道菌群结构改善肠道微环境,且效果优于单用低聚半乳糖。
4 结论
研究发现复方苍术方具有改善肠道菌群的作用,同时对肠道微环境具有一定的调节作用,且效果优于单用低聚半乳糖,提示复方苍术方可用于改善肠道菌群保健食品的开发。
[1] Kåhrström C T, Pariente N, Weiss U. Intestinal microbiota in health and disease [J]. Nature, 2016, 535(7610): 47
[2] 龚锦文.菌群失调病人腹泻标本细菌学及pH值和球杆比变化的临床意义[C]//江西省第四次中西医结合消化系统疾病学术交流会论文汇编,2011
GONG Jin-wen. Clinical significance of Bacteriology, pH value and club to column ratio of diarrhea specimens in patients with bacterial imbalance [C]// Proceedings of the Fourth Academic Conference on digestive system diseases of traditional Chinese and Western medicine in Jiangxi Province,2011
[3] 李艳莉,李倩,霍贵成.低聚果糖和低聚半乳糖的肠道益生功能研究[J].食品工业,2012,8:79-82
LI Yan-li, LI Qian, HUO Gui-cheng. Study on probiotic function of fructooligosaccharides and galactooligosaccharides onintestinal microflora [J]. The Food Industry, 2012, 8: 79-82
[4] 辛跃强.低聚半乳糖对肠道益生菌作用机理的研究[D].济南:齐鲁工业大学,2015
XIN Yue-qiang. Research on the mechanism of GOS applied to intestinal probiotics [D]. Jinan: Qilu University of Technology, 2015
[5] 蔡子微,杨旭东,胡静,等.中药神曲及其肠道菌群调整和肠保护作用的实验研究[J].牡丹江医学院学报,2006,27(1):1-5
CAI Zi-wei, YANG Xu-dong, HU Jing, et al. Study on the Chinese drug “shenqu” and its effects on intestinal micro flora regulation and intestinal protection [J]. Journal of Mudanjiang Medical College, 2006, 27(1): 1-5
[6] 孙必强,伍参荣,周英,等.不同剂型七味白术散对肠道菌群失调小鼠小肠黏膜超微结构和sIgA的影响[J].中国微生态学杂志,2016,28(2):125-128
SUN Bi-qiang, WU Can-rong, ZHOU Ying, et al. Effects of different formulations of QiweiBaizhu powder on the ultrastructure of small intestinal mucosa and sIgA in mice with intestinal dysbacteriosis [J]. Chinese Journal of Microecology, 2016, 28(2): 125-128
[7] 邢广林,李同树,刘翠艳,等.甘露寡糖、中药和微生态制剂对肉鸡抗氧化性能的影响[J].家畜生态学报,2007,28(1):47-5
XING Guang-lin, LI Tong-shu, LIU Cui-yan, et al. The effect of sugar, Chinese medicine and microecological preparation on the antioxidant properties of chicken [J]. Acta Ecologiae Animalis Domastici, 2007, 28(1): 47-51
[8] 郭抗萧,谭周进,谢梦洲,等.超微七味白术散与酵母菌协同治疗小鼠菌群失调腹泻[J].应用与环境生物学报,2015,21(1):61-67
GUO Kang-xiao, TAN Zhou-jin, XIE Meng-zhou, et al. The synergic effect of ultra-micro power Qiweibaizhusan combined with yeast on dysbacteriotic diarrhea mice [J].Chinese Journal of Applied and Environmental Biology, 2015,21(1): 61-67
[9] 中华人民共和国卫生部:保健食品检验与评价技术规范(2003版)[S] 北京
China National Ministry of Health. Technical standards for testing & assessment of health food.2003[S] Beijing
[10] 苗明三.实验动物和动物实验技术[M].北京:中国中医药出版社,1997
MIAO Ming-san. Experimental animal and animal experimental technology [M]. Beijing: China Press of Traditional Chinese Medicine, 1997
[11] 王卓,彭颖,李晓波.四君子汤对两种脾虚模型大鼠肠道菌群紊乱的影响[J].中国中西医结合杂志,2009,29(9):825-829
WANG Zhuo, PENG Ying, LI Xiao-bo. Effect of Sijunzi decoction on the intestinal flora disturbance in two rat models of Pi-deficiency syndrome [J]. Chinese Journal of Integrated Traditional and Western Medicine, 2009, 29(9): 825-829
[12] 王广,马淑霞,胡新俊,等.党参多糖对双歧杆菌和大肠埃希菌体外生长的影响[J].中国微生态学杂志,2010, 22(3):199-201
WANG Guang, MA Shu-xia, HU Xin-jun, et al. Effects of polysaccharides from Radix Codonopsis on the growth of Bifidobacteria andE.coli in vitro [J]. Chinese Journal of Microecology, 2010, 22(3): 199-201
[13] 国家药典委员会.中国药典[M].北京:人民教育出版社,2015
Chinese Pharmacopoeia Commission. Chinese Pharmacopoeia [M]. Beijing: People’s Education Press, 2015
