炎琥宁对COPD大鼠肺组织IL-12/STAT4、IL-4/STAT6信号通路影响探讨
2018-03-01肖祖克
肖祖克 ,孙 慧 ,叶 东 ,李 星
(1、江西省人民医院呼吸科,南昌 330006;2、江西中医药大学附属医院,南昌 330006;3、江西省永修县人民医院,永修 330300)
越来越多的证据表明,IL-12/STAT4、IL-4/STAT6信号通路在CS引起的肺部炎症中起着重要的作用[1]。本次研究中,以炎琥宁对COPD大鼠肺组织IL-12/STAT4、IL-4/STAT6信号通路影响进行研究分析为目的,建立了COPD大鼠模型,并对正常对照组、COPD大鼠组、COPD炎琥宁注射液组大鼠血清以及肺泡灌洗液中的各项指标进行了检测,并对检测结果进行了统计分析,结果汇报如下。
1 材料与方法
1.1 材料 实验动物雄性SD大鼠,体重在180-220g,级别为SPF。适应性喂养1周后开始实验。脂多糖购自Sigma公司,批号为L2880;椰树牌香烟,焦油量为11mg,氯化钠注射液,购自贵州科伦药业有限公司,批号为B160623I;变色硅胶,购自青岛裕睿化工有限公司,批号为160802;苦味酸为分析纯,购自天津市大茂化学试剂厂,批号为160403;水合氯醛购自天津市科密欧化学试剂有限公司,批号为20160305;瑞姬氏染色试剂盒,购自西化仪(北京)科技有限公司,型号为81/M322967;磷酸盐缓冲液,购自赛默飞世尔生物化学制品有限公司,批号为NXH0696;自制烟熏箱(亚克力材质);电子天平购自深圳市华恒科技有限公司,分析天平购自香港佳立国际有限公司。
1.2 方法
1.2.1 分组方法 取大鼠(8周龄,雄性)60只,分为正常组、COPD造模组、COPD造模注射炎琥宁组,每组20只。分组后对各组大鼠进行标记并编号,分组标记后给予各组大鼠同样的饲料及饮用水。
1.2.2 给药方法 造模2个月后,开始给予各组分别进行药物治疗,共持续28d。正常对照组:10ml/kg注射用生理盐水,腹腔注射,每天1次;COPD组:10ml/kg注射用生理盐水,腹腔注射,每天1次;炎琥宁组:炎琥宁36mg/kg,腹腔注射,每天1次。
1.2.3 取材 肺泡灌洗液的采集:腹主动脉采血后,剪开大鼠的颈部皮肤,暴露颈部器官,打开胸腔,剥离覆盖肺组织的胸腺和心包,然后找到气管分支,结扎右主支气管,用0.9%的无菌生理盐水6ml,经气管注入左主支气管及左肺,反复慢慢回抽4次,回抽液大约 4-5ml,回收率 70%-80%,于 4℃,3000r/min 下离心10min,吸取上清液,置于2ml冷冻管中,-80℃超低温冰箱保存。肺泡灌洗液离心后所得的细胞沉淀用1ml灭菌的PBS重悬后,保存于2ml冷冻管中,4℃冰箱中保存,用于白细胞计数与分类计数。肺组织固定方法:结扎左肺,松开右肺,经气管注入4%的多聚甲酸溶液5ml,固定30s,取出右肺中叶,于4%的多聚甲酸中保存,用于HE染色。
1.2.4 检测方法 冰箱中取出大鼠血清、BALF上清液,放至室温,严格按照ELISA试剂盒操作说明书进行大鼠血清和 BALF 中 IFN-γ,IL-12,IL-12R,IL-4,IL-4R水平检测。
1.3 数据处理 采取SPSS 18.0统计学软件进行数据处理,计量资料经(x±s)形式表示,统计分析采取t检查,计数资料统计分析采取χ2检验,P<0.05时,视为差异存在统计学意义。
2 结果
COPD大鼠组IL-4R、IL-4水平较正常对照组发生显著降低 (P<0.05),IFN-γ、IL-12、IL-12R 水平较正常对照组发生明显升高(P<0.05);COPD炎琥宁注射液组大鼠血清和肺泡灌洗液中IFN-γ、IL-12、IL-12R水平较COPD大鼠组发生明显降低(P<0.05),IL-4、IL-4R 水平较 COPD 大鼠组发生明显升高(P<0.05)。 见表 1。

表1 各组大鼠血清以及肺泡灌洗液中IFN-γ检测结果比较
3 讨论
STAT是一种新型的转录因子家族,主要负责连接胞外细胞因子与Th分化转录因子之间的胞内信号传递[2]。在Th0细胞分化为Th1细胞和Th2细胞的过程中,一种细胞因子在信号转导中对STAT分子的选择具有一定特异性,IL-4激活STAT6诱导Th2分化,IL-12激活STAT4诱导 Th1分化[3]。STAT4是决定Th1细胞因子作用的关键信号因子,其信号途径由IL-12激活,可以诱导Th1效应因子IFN-γ的转录和表达。STAT6信号途径依赖IL-4诱导,其在Th2细胞基因表达及发育上发挥重大作用。因此可见,通过IL-12/STAT4、IL-4/STAT6信号通路活化和诱导的Th1、Th2细胞分化,可直接影响COPD气道炎症及病理改变的发生发展[4]。
炎琥宁系穿心连提取物经酯化、脱水、成盐精制而成,具有抗炎、灭菌的作用。本实验我们假设,炎琥宁IL-12/STAT4、IL-4/STAT6信号通路对抗CS对COPD大鼠肺部的免疫失衡,从而对延缓肺泡上皮细胞的炎症反应和氧化应激,达到保护肺部的作用[5]。
本研究通过建立COPD大鼠模型,设置正常组、COPD大鼠组及炎琥宁注射液COPD大鼠组,检测各组大鼠血清、肺泡灌洗液中细胞因子IFN-γ、IL-12、IL-12R、IL-4、IL-4R 水平,并提取大鼠肺组织, 检测STAT4、STAT6蛋白水平,及STAT4mRNA、STAT6mRNA的表达情况[6]。实验研究显示, 各组大鼠在 IFN-γ、IL-12、IL-12R、IL-4、IL-4R、STAT4、STAT6蛋白水平存在差异,由此证实,炎琥宁可通过IL-12/STAT4、IL-4/STAT6信号通路影响COPD疾病进展。
表2 各组大鼠血清及肺泡灌洗液中IL-12、IL-12R检测结果比较
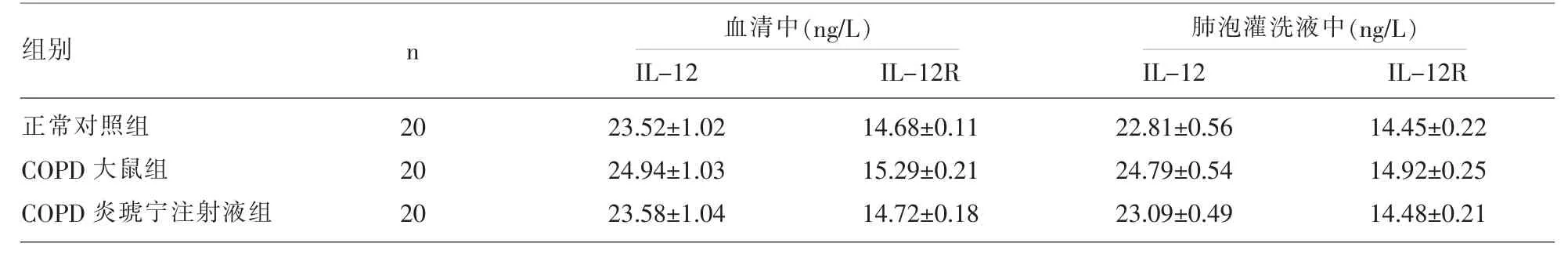
表2 各组大鼠血清及肺泡灌洗液中IL-12、IL-12R检测结果比较
?
表3 各组大鼠血清及肺泡灌洗液中IL-4、IL-4R检测结果比较(

表3 各组大鼠血清及肺泡灌洗液中IL-4、IL-4R检测结果比较(
?
[1]顾峰.中西医结合疗法治疗慢性阻塞性肺疾病急性加重合并呼吸衰竭临床疗效及安全性的Meta分析[J].中国实用医药,2013,11(8):14-15.
[2]中华医学会呼吸病学分会慢性阻塞性肺疾病学组,COPD诊断遵照慢性阻塞性肺疾病诊治指南 (2013年修订版)[S].全科医学临床与教育,2013,9(11):484-491.
[3]柳涛,蔡柏蔷.慢性阻塞性肺疾病诊断、处理和预防全球策略(2011年修订版)介绍[J].中国呼吸与危重监护杂志,2012,1(11):1-12.
[4]刘领,赵淑敏,杨霁,等.COPD患者Th1/Th2平衡失调临床观察[J].临床肺科杂志,2011,16(9):1335-1336.
[5]徐永芳,陈刚,徐长青.穿心莲内酯对内毒素诱导急性肺损伤大鼠TLR4、CD14、MD2 mRNA表达的影响 [J].中华中医药学刊,2015,33(5):1198-1200,1290.
[6]王爱华,李全新.IL-2、IL-4、IL-6和IL-8在慢性阻塞性肺部疾病发病中作用的初探[J].江西医药,2000,35(2):72-73.
