PRRSV感染对猪肺泡巨噬细胞IFITM3基因转录的影响
2018-03-01李玉明武专昌马改妮魏建超邵东华李蓓蓓邱亚峰石元元马志永
李玉明,武专昌,刘 珂,马改妮,魏建超,邵东华,李蓓蓓,邱亚峰,石元元,马志永
(中国农业科学院上海兽医研究所,上海200241)
PRRSV感染对猪肺泡巨噬细胞IFITM3基因转录的影响
李玉明,武专昌,刘 珂,马改妮,魏建超,邵东华,李蓓蓓,邱亚峰,石元元,马志永
(中国农业科学院上海兽医研究所,上海200241)
干扰素诱导跨膜蛋白3(interferon inducible transmembrane proteins 3,IFITM3)作为抗病毒蛋白可以抑制多种病毒的感染,本研究针对猪IFITM3基因设计特异性引物,构建重组质粒并作为阳性标准品,建立了检测IFITM3基因的SYBR Green I荧光定量RT-PCR方法。结果显示,该方法最低检出下限为102copies/μL,且线性关系好(R2≥0.997),敏感性高,特异性强,重复性好,批内、批间变异系数均小于3%。将猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)感染猪肺泡巨噬细胞(porcine alveolar macrophages,PAM)细胞,在不同感染时间对细胞中IFITM3 mRNA 进行检测。结果显示,PRRSV感染早期IFITM3转录水平保持不变,在感染后转录水平逐渐升高。IFITM3 mRNA在PRRSV感染PAM过程中转录变化,可能是PRRSV宿主免疫逃逸的机制之一。
猪干扰素诱导跨膜蛋白3;猪繁殖与呼吸综合征病毒;SYBR Green I荧光定量PCR;猪肺泡巨噬细胞
猪繁殖与呼吸综合征(porcine reproductive and respiratory syndrome,PRRS)是严重危害养猪业的重要疾病之一,对全球养猪业造成巨大的经济损失,主要引起母猪流产和仔猪呼吸困难等症状[1],感染后极易诱发继发感染。PRRS由猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)感染引起。PRRSV为单股正链RNA病毒,属动脉炎病毒科、动脉炎病毒属[2]。PRRSV主要感染猪单核巨噬细胞系统,尤其是猪肺泡巨噬细胞(porcine alveolar macrophages,PAM)[3]。由于PRRSV抗原和基因多样性以及病毒免疫抑制性,使得该病尚未具有有效的预防措施。
干扰素诱导跨膜蛋白 3(interferon inducible transmembrane proteins 3,IFITM 3)是一种抗病毒蛋白,可以抑制多种囊膜和非囊膜病毒的复制,如流感病毒、登革热病毒、冠状病毒等[4]。其抗病毒机制主要是干扰病毒和细胞膜的融合。在IFITM家族中至少有3个成员(IFITM1、IFITM2、IFITM3)具有抗病毒活性。越来越多的研究表明IFITM3在抵抗囊膜病毒的先天性免疫中起着关键作用。IFITM3主要在细胞内体中表达,通过抑制病毒囊膜和内体膜的融合阻碍病毒的进入,从而发挥抗病毒作用[5,6]。本实验室通过对PRRSV感染和未感染细胞的转录组分析发现,PRRSV感染细胞中IFITM3显著升高。本研究通过建立的荧光定量方法对感染PRRSV的PAM细胞中IFITM3基因转录水平进行检测,分析其动态表达变化,为研究IFITM3在PRRSV感染过程中的作用机制奠定基础。
1 材料与方法
1.1 实验动物与病毒 5周龄健康断奶仔猪3头购自上海农科院猪场,经PCR和ELISA检测PRRSV抗原及抗体均为阴性;猪肺泡巨噬细胞(porcine alveolar macrophages,PAM)按文献[7]中方法进行分离,并对分离的PAM进行PCR检测,选择PRRSV、猪瘟病毒(Classical swine fever virus,CSFV)、猪圆环病毒2 型(Porcinecircoviru-stype 2,PCV 2)、猪伪狂犬病病毒(Pseudorabies virus,PRV)阴性PAM细胞进行后续实验;PRRSV SH-PRRS01株由本实验室分离保存。
1.2 试剂和仪器 Trizol plus 试剂、反转录酶(MLV)、RNA酶抑制剂、ExTaqDNA聚合酶、Primescript RT master mix 快速反转录试剂盒、SYBR premix Ex Taq 荧光定量试剂盒、pMD-18T载体均购自 TaKaRa公司;胶回收试剂盒购于生工生物工程(上海)股份有限公司;大肠杆菌感受态(DH5a)、质粒提取试剂盒购自天根公司;Step one plus荧光定量PCR仪购自ABI 公司。
1.3 猪IFITM3及GAPDH 基因SYBR Green I qRTPCR检测方法的建立
1.3.1 引物设计 根据GenBank中登录的猪IFITM3及GAPDH基因序列,应用 Beacon Designer 7软件设计qRT-PCR特异性引物(表1)。所有引物均由上海Invitrogen生物公司合成。

表1 SYBR Green I qRT-PCR扩增引物和条件Table 1 Ampli fi cation conditions and primers of the SYBR Green I qRT-PCR
1.3.2 猪IFITM3及GAPDH 基因重组质粒的构建 取PAM细胞并按照 Trizol 法说明书提取细胞总RNA,按MLV说明进行反转录获得cDNA,反转录体系为:1 μL Random Primer、4 μL 5×RT Buffer、2 μL DTT、1 μL dNTP mix(10 mmol/L)、1 μL MLV(200 U/μL)、1 μL RNA酶抑制剂(20 U/μL)。然后以cDNA为模板,分别扩增IFITM3及GAPDH基因片段,PCR体系为:10×PCR Buffer 2.5 μL、dNTP Mixture(2.5 mmol/μL)4 μL、引物各0.5 μL(10 pmol/μL)、ExTaq酶0.5 μL、cDNA 模板3 μL,补H2O至25 μL。反应程序:95℃预变性2 min;95℃变性30 s,56℃退火30 s,72℃延伸30 s,共30个循环;72℃延伸7 min。PCR产物经胶回收后克隆至pMD18-T载体,并提取重组质粒,经PCR和测序鉴定后,测定DNA浓度,然后将质粒标准品进行10倍系列稀释至102copies/μL,做为绘制标准曲线的模板。
1.3.3 反应体系优化 在相同浓度模板的反应体系中,采用矩阵法优化引物的最佳浓度。在最佳引物浓度的反应体系中,通过分析PCR扩增效率,选择最佳引物使用量进行检测。
1.3.4 标准曲线的建立 以10倍系列稀释的质粒标准品为模板,经Step one plus荧光定量PCR仪检测,并自动生成标准曲线。然后对SYBR Green I qRT-PCR扩增产物进行凝胶电泳分析和熔解曲线分析,确认引物特异性后,对标准品进行3次批内重复检测和3次批间重复检测,同时设空白对照,通过计算批内批间变异系数(coefficient of variation,CV)评价重复性。
1.4 PRRSV感染对PAM细胞内IFITM3基因表达的影响 将分离的PAM细胞接种到24孔板中,以106细胞/孔进行接种。在细胞贴壁后,换完全培养基(含10% FBS、100 U/mL青霉素和100 mg/mL链霉素的RPMI-1640培养基)继续培养6~8 h后,以1 MOI剂量的PRRSV进行接种。接种1.5 h后,换维持培养基继续培养,并于接毒后不同时间收集细胞样品并提取细胞总RNA,利用建立的荧光定量方法检测IFITM3的mRNA拷贝数,并对PRRSV不同感染时间下,PAM细胞内IFITM3转录变化进行分析。
2 结果
2.1 目的基因扩增与重组质粒鉴定 分别扩增IFITM3及GAPDH的目的片段,并对PCR产物进行凝胶电泳鉴定。结果表明,获得大小分别为132、168 bp的片段(图1)。对重组质粒进行PCR反应,其条带大小与预计一致,测序结果与GenBank 数据库中的该基因序列完全相同,表明成功构建IFITM3及GAPDH重组质粒。
2.2 SYBR Green I qRT-PCR反应的条件优化 当上游引物浓度为8 pmol/μL,下游引物浓度为10 pmol/μL时,扩增效率最高。优化后反应体系为20 μL,包括:2×SYBR Green Premix ExTaqII 10 μL、上游引物8 pmol/μL、下游引物10 pmol/μL、模板(质粒或 cDNA(1 μg/mL))1 μL、ROX Reference Dye (50×) 0.4 μL,补DEPC水至20 μL。反应条件:95℃变性5 min;以95℃ 5 s,60℃ 30 s扩增35个循环,熔解曲线条件:60℃~95℃,每0.3℃读板1次。
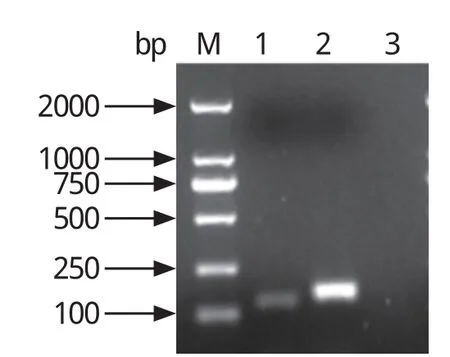
图1 猪IFITM3、GAPDH基因的PCR扩增结果Fig.1 Ampli fi cation of IFITM3 and GAPDH genes by PCR
2.3 SYBR Green I qRT-PCR 标准曲线的建立 分别以IFITM3及GAPDH重组质粒进行10倍系列稀释,制备6个浓度梯度,以此为模板进行SYBR Green I qRT-PCR 扩增并建立标准曲线。结果表明,扩增曲线线性关系良好,相关系数分别达到0.997和1,扩增效率分别为101.5%和95.8%(图2)。
2.4 SYBR Green I qRT-PCR特异性实验 对IFITM3及GAPDH基因模板进行SYBR Green I PCR检测。熔解曲线分析表明,各基因均为特异性单峰,无杂峰(图3),表明该反应为特异性扩增。
2.5 SYBR Green I qRT-PCR敏感性实验 IFITM3及GAPDH检测下限均为102copies/μL。对SYBR Green I qRT-PCR产物进行琼脂糖凝胶电泳,如图4所示,其不同浓度模板扩增产物亮度呈梯度变化,与实时荧光定量 PCR 结果一致。
2.6 SYBR Green I qRT-PCR重复性实验 取3个梯度标准品(103~105copies/μL)作为模板,用建立的方法分别进行批内和批间重复性试验,其批内批间变异系数均小于3%(表2),表明该方法具有较高的重复性。
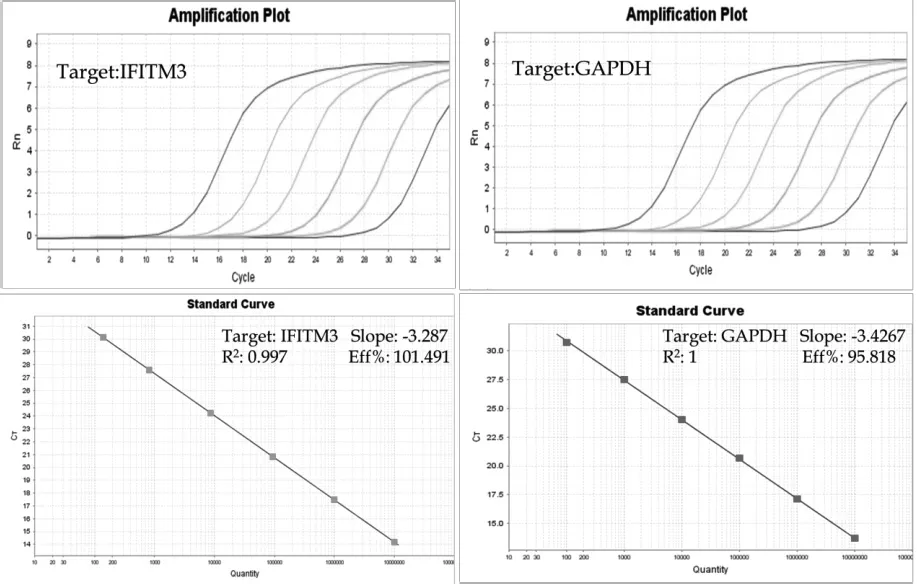
图2 SYBR Green I qRT-PCR检测猪IFITM3与GAPDH的扩增曲线(A)和标准曲线(B)Fig. 2 Ampli fi cation plots (A ) and standard curve (B) of SYBR Green I qRT-PCR

图3 IFITM3及GAPDH基因的SYBR Green I qRT-PCR 溶解曲线Fig. 3 Melting curves of IFITM and GAPDH gene by SYBR Green I qRT-PCR for porcine IFITM3 and GAPDH gene
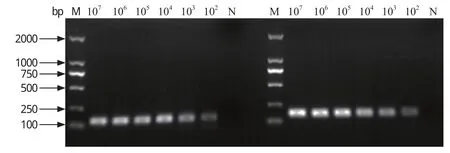
图4 猪IFITM3、GAPDH标准品PCR检测结果Fig.4 PCR results for porcine IFITM3, GAPDH standard

表2 IFITM3及GAPDH基因SYBR GreenⅠqRT-PCR重复性结果Table 2 Reproducibility assay of SYBR GreenⅠqRT-PCR for porcine IFITM3 and GAPDH gene
2.7 样品检测结果 应用建立的荧光定量方法对PRRSV感染的PAM中IFITM3和GAPDH进行检测,并计算其拷贝数,然后以IFITM3与GAPDH的拷贝数比值表示细胞内IFITM3的相对含量,结果显示在病毒感染初期(0~12 hpi),IFITM3基因转录水平几乎无变化;到感染后期(12~24 hpi),IFITM3转录水平随着感染时间的延长而持续增加,差异具有显著性统计学意义(图5)。

图5 PRRSV感染PAM细胞中IFITM3基因检测结果Fig.5 Detection of mRNA levels of IFITM3 genes in PAM infected with PRRSV
3 讨论
病毒和宿主属于一种博弈的状态,当病毒感染细胞时,细胞会通过表达干扰素等来抵抗病毒的入侵,同时病毒也会通过不同的策略抑制这些抵抗从而促进自身的复制。IFITM3蛋白是一个重要的先天性免疫调节因子,它可以通过阻碍病毒的进入来发挥抗病毒作用[5,6],因此通过研究病毒感染细胞后IFITM3的表达情况有助于了解病毒与宿主之间的关系。
实时荧光定量PCR因具有高敏感性、特异性强等优点从而成为实验室检测的主要方法之一。SYBR Green I PCR因其方法简便、成本低廉而被广泛应用[8]。本研究根据GenBank中猪IFITM3和GAPDH基因序列设计特异性引物,通过构建质粒标准品并绘制SYBR Green I qRT-PCR的标准曲线,建立了针对该基因的荧光定量方法。结果显示,标准曲线的相关系数以及扩增效率极高,并能够检出下限为102copies/μL的基因含量,具有较高的敏感性;SYBR Green I RT-PCR产物单一熔解曲线和琼脂糖凝胶电泳结果均表明该方法具有很强的特异性;组内及组间变异系数均小于3%,表明该方法重复性很好。因此本研究建立的STBR Green I荧光定量RT-PCR可以用于IFITM3基因转录水平的检测。
目前研究者对IFITM3的抗病毒机制尚不清楚,有研究报道IFITM3可抑制囊膜病毒与细胞膜的融合,从而阻碍病毒的进入[5,6]。本研究对PRRSV感染的PAM细胞中IFITM3基因转录情况进行检测发现,在感染早期,IFITM3转录水平保持不变;到感染后期,随着感染时间的增加,其转录水平逐渐升高。因此推测,PRRSV可能在早期抑制了IFITM3的表达来实现病毒的繁殖。PRRSV的这种免疫逃逸特性在其他方面也有报道,研究表明,PRRSV感染早期抑制细胞凋亡,晚期促进细胞凋亡过程,从而完成自身复制[9]。PRRSV在感染初期,干扰素的表达极低,后期才逐渐升高[10]。IFITM3是通过干扰素诱导表达的一种蛋白,因此PRRSV可能通过抑制干扰素的产生,进而抑制IFITM3等抗病毒蛋白的转录表达,从而实现免疫逃逸过程。
许多病毒在进化过程中都具有拮抗宿主细胞抵抗的机制,但有关抑制IFITM3蛋白的机制尚没有相关报道。本研究通过建立的SYBR Green I PCR荧光定量方法对IFITM3进行检测,为进一步研究IFITM3在PRRSV等病毒感染过程中的作用奠定基础。
[1]Albina E. Epidemiology of porcine reproductive and respiratory syndrome (PRRS): an overview[J]. Vet Microbiol, 1997, 55(1-4): 309-316.
[2]Meulenberg J J. PRRSV, the virus[J]. Vet Res, 2000,31(1): 11-21.
[3]Neumann E J, Kliebenstein J B, Johnson C D,et al. Assessment of the economic impact of porcine reproductive and respiratory syndrome on swine production in the United States[J]. J Am Vet Med Assoc,2005, 227(3): 385-392.
[4]Zhang H, Zheng H, Qian P,et al. Induction of systemic IFITM3 expression does not effectively controlfoot-andmouth disease viral infection in transgenic pigs[J]. Vet Microbiol, 2016, 191: 20-26.
[5]Bailey C C, Zhong G, Huang I C,et al. IFITM-family proteins: the cell’s first line of antiviral defense[J]. Annu Rev Virol, 2014, 1: 261-283.
[6]Amini-Bavil-Olyaee S, Choi Y J, Lee J H,et al. The antiviral effector IFITM3 disrupts intracellular cholesterol homeostasis to block viral entry[J]. Cell Host Microbe,2013, 13(4): 452-464.
[7]Qi P, Liu K, Wei J,et al. Nonstructural Protein 4 of Po rcine Reproductive and Respiratory Syndrome Virus M odulates Cell Surface Swine Leukocyte Antigen Class I Expression by Down regulating β2-Microglobulin Transcription[J]. J Virol, 2017, 91(5): eD1755-16.
[8]孟春春, 段云兵. 基因Ⅶ型新城疫病毒SYBR Green I实时荧光定量PCR检测方法的建立[J]. 中国动物传染病学报, 2011, 19(5): 8-14.
[9]Costers S, Lefebvre D J, Delputte P L,et al.Porcine reproductive and respiratory syndrome virus modulates apoptosis during replication in alveolar macrophages[J].Arch Virol, 2008, 153(8): 1453-1465.
[10]Nan Y, Wang R, Shen M,et al.Induction of type I interferons by a novel porcine reproductive and respiratory syndrome virus isolate[J]. Virology, 2012,432(2): 261-270.
EFFECT OF PRRSV INFECTION ON IFITM3 TRANSCRIPTION IN PORCINE ALVEOLAR MACROPHAGES
LI Yu-ming, WU Zhuan-chang, LIU Ke, MA Gai-ni, WEI Jian-chao, SHAO Dong-hua, LI Bei-bei,QIU Ya-feng, SHI Yuan-yuan, MA Zhi-yong
(Shanghai Veterinary Research Institute, CAAS, Shanghai 200241, China)
As an antivirus protein, interferon inducible transmembrane protein 3 (IFITM3) inhibits a broad spectrum of virus infections.In this study, the speci fi c primers were designed based on the genes of IFITM3 and GAPDH to detect IFITM3 expression in PRRSV-infected porcine alveolar macrophages (PAMs). The recombinant plasmids containing the target genes were constructed as a standard control and real time SYBR Green I RT-PCR method was developed for detection of IFITM3 expression. The results showed that the detection limit of this method was 102copies/μL with good linear relationship, specificity, sensitivity and repeatability. Moreover,the variation coef fi cient of the method was less than 3%. We used this method to detect the IFITM3 mRNA levels in PRRSV-infected PAMs. The results revealed that the IFITM3 mRNA levels showed no signi fi cant difference at the early stage of infection but increased significantly at the late stage of infection in PRRSV-infected PAMs as compared with mock-infected PAMs, demonstrating that the changes of IFITM3 mRNA levels in PRRSV-infected PAMs might be related to PRRSV infection as well as immune evasion.
Interferon inducible transmembrane protein 3; Porcine reproductive and respiratory syndrome virus; real time SYBR Green I RT-PCR; porcine alveolar macrophages
S852.44
A
1674-6422(2018)01-0007-06
2017-05-09
973项目计划课题 (2014CB542702);国家自然科学基金(31502046)
李玉明,男,博士研究生,预防兽医学专业
马志永,E-mail: zhiyongma@shvri.ac.an
