银杏外种皮多糖抑制J亚群禽白血病病毒在DF-1细胞中的复制
2018-03-01孔正茹秦爱建
钱 琨,孔正茹,张 杰,秦爱建
(1.扬州大学 教育部禽类预防医学重点实验室,扬州 225009;2.扬州大学 江苏省动物预防医学重点实验室,扬州 225009;3.江苏省动物重要疫病与人兽共患病防控协同创新中心,扬州225009)
银杏外种皮多糖抑制J亚群禽白血病病毒在DF-1细胞中的复制
钱 琨1,2,3,孔正茹1,2,张 杰1,2,秦爱建1,2,3
(1.扬州大学 教育部禽类预防医学重点实验室,扬州 225009;2.扬州大学 江苏省动物预防医学重点实验室,扬州 225009;3.江苏省动物重要疫病与人兽共患病防控协同创新中心,扬州225009)
为研究银杏外种皮多糖抑制J亚群禽白血病病毒(Avian leukosis virus subgroup J,ALV-J)复制的能力,在不同时间点加入银杏外种皮多糖处理DF-1细胞,利用qRT-PCR、免疫蛋白印迹以及病毒滴度检测等方法,观察银杏外种皮多糖对ALV-J复制的影响,结果表明银杏外种皮多糖就能够显著地抑制病毒基因表达、蛋白合成以及病毒在细胞内的增殖,并且这种抑制作用具有时间和剂量依赖性。同时银杏外种皮多糖处理还明显抑制病毒感染细胞中的IL-1β、TNFα等细胞因子的表达。银杏外种皮多糖在DF-1细胞中具有抑制ALV-J复制的能力,具有作为抗ALV-J药物的潜力。
J亚群禽白血病病毒;银杏外种皮多糖;病毒复制;抑制
禽白血病病毒(Avian leukosis virus,ALV)是逆转录病毒科、α-逆转录病毒属的成员。ALV在全世界范围内引起鸡群的免疫抑制,临床肿瘤和生产性能下降。根据病毒的宿主范围,囊膜蛋白的序列以及中和抗体的反应,将感染鸡的外源性ALV分为不同的亚群(A、B、C、D和J)[1]。流行病学调查数据表明,J亚群禽白血病病毒(ALV-J)是我国鸡群中的优势亚群。由于我国家禽饲养管理环境的复杂,ALV-J曾经在我国四处肆虐,不仅感染肉鸡,还大范围感染蛋鸡和地方品种鸡群,严重影响我国养禽业健康、快速的可持续发展[2]。由于病毒囊膜基因具有高突变率,病毒-宿主相互作用也不甚清楚,目前还没有特别有效的疫苗和治疗手段,主要采取核心种鸡群的检测与净化,从而控制禽白血病在鸡群中的流行。
研究表明,一些天然产物例如中药、植物衍生化合物等在体内外具有抑制病毒的潜力,可以作为抗病毒药物使用[3-5]。王英燕等[5]指出槟榔、常山浸出液与流感病毒混合可明显抑制流感病毒的感染;黄柏、虎杖、蚕砂、贯众、鱼腥草等对雏鸭病毒性肝炎病毒有抑制作用;此外,大青叶、黄答、金银花、板蓝根等对呼吸道病毒也具有抑制作用。银杏外种皮是银杏果仁的皮层,其化学成分与银杏叶相似,含有较多的黄酮类化合物、银杏内酯类化合物、银杏酚类化合物和类胡萝卜素等有效成分[6]。银杏外种皮多糖(ginkgo biloba exocarp polysaccharide,GBEP)是从银杏外种皮中提取出来的一种活性成分,毒副作用极低。研究报道银杏外种皮多糖具有抗肿瘤、免疫调节和抗衰老等多种活性[7-9],但对其抗病毒活性的研究鲜有报道。
本研究旨在探究银杏外种皮多糖在DF-1细胞中抑制ALV-J病毒复制的能力,为其作为药物在防控禽白血病净化工作中的应用提供理论依据。
1 材料与方法
1.1 生物材料和试剂 禽源DF-1细胞为本实验室保存;J亚群禽白血病病毒JS09-GY3毒株为本实验室分离并鉴定;针对J亚群禽白血病病毒囊膜蛋白env特异性单克隆抗体JE9由本实验室前期研制并保存;内参抗体α-Tubulin购自Sigma公司;银杏外种皮多糖(GBEP)由扬州大学李金贵教授馈赠,其纯度为71%,灭菌ddw溶解;总RNA提取试剂盒购自Axygen公司;BCA试剂盒购自碧云天公司;HRP标记的羊抗鼠IgG购自Sigma公司;RIPA细胞裂解液购自Cell Signaling公司;蛋白酶抑制剂购自Roche公司;HRP的增强型化学发光底物液购自Themer公司;其他试剂为国产分析纯试剂。
1.2 银杏外种皮多糖对细胞毒性的测定 将不同浓度的银杏外种皮多糖 (0、20、50、100、200 μg/mL)加入DF-1细胞培养72 h后,每孔加入20 μL CCK-8溶液,按照CCK-8细胞活力检测试剂盒(碧云天公司)说明书操作。
1.3 银杏外种皮多糖处理细胞 使用不同浓度银杏外种皮多糖(0、1、20 μg/mL)预处理DF-1细胞5 h后,加入银杏外种皮多糖与病毒的混合液进行病毒吸附3 h,换液后加入含有银杏外种皮多糖的维持液继续维持到病毒感染72 h,收集细胞裂解提取RNA,进行real-time PCR检测基因表达情况。部分细胞利用RIPA裂解进行Western blot检测病毒蛋白表达情况;同时细胞上清进行TICD50检测病毒增殖情况。此外,在时间依赖性实验中,使用固定银杏外种皮多糖溶度(20 μg/mL),在加入病毒感染后24、48、72 h分别收集细胞裂解提取RNA,进行real-time PCR检测病毒基因表达情况。
1.4 Western blot鉴定 细胞裂解液利用BCA蛋白定量试剂盒定量后,进行SDS-PAGE电泳;将蛋白转印到NC膜上后放入TBST稀释的5%脱脂乳中37℃摇床封闭1.5 h;针对J亚群禽白血病病毒囊膜蛋白env特异性单克隆抗体JE9和内参抗体α-Tubulin作为一抗4℃孵育过夜;TBST洗涤3次,5 min/次;二抗为1:10 000标记的山羊抗鼠IgG,37℃摇床孵育1 h;TBST洗涤5次,5 min/次;最后HRP增强型化学发光底物避光显色5 min,于超灵敏化学发光成像系统拍照并记录结果。
1.5 银杏外种皮多糖不同加入时间对ALV-J复制的影响 根据参考文献[10],银杏外种皮多糖(20 μg/mL)分别于预处理细胞5 h,药物与病毒共同吸附细胞3 h,病毒吸附后加入药物继续培养箱中培养72 h三个时间点单独加入DF-1细胞;另设置不加药物病毒感染作为对照,采用TCID50检测银杏外种皮多糖对病毒增殖的影响。实验设计如图1所示。
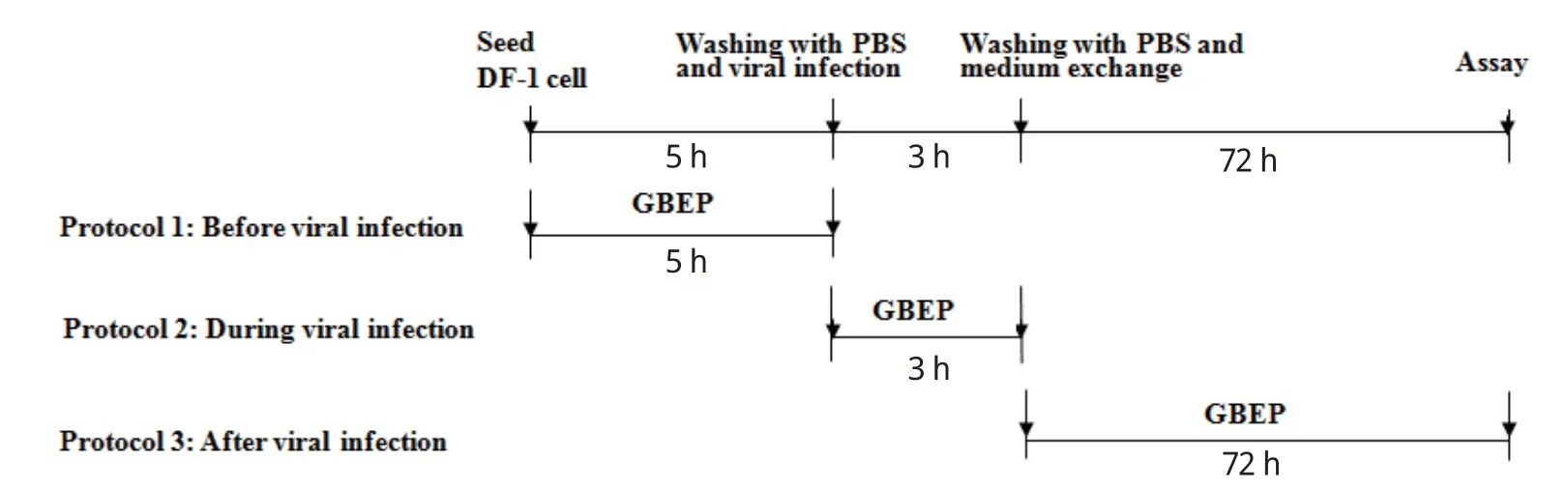
图1 银杏外种皮多糖不同加入时间对ALV-J感染复制的影响实验设计图Fig.1 Experiment design of antiviral effects of different treatment times of GBEP on ALV-J infection replication
1.6 real-time PCR检测 按照Axygen公司的总RNA小量制备试剂盒说明书提取组织总RNA,紫外分光光度计检测RNA的纯度和浓度。取1 μg总RNA作为模板,用TaKaRa公司的PrimerScriptTM RT reagent kit with gDNA Eraser(Perfect for Real Time)试剂盒反转录为cDNA作为检测模板。反转录好的cDNA作为模板用ddw对其进行1:10稀释。按照说明书配制反应液:SYBR Premix ExTaqTMⅡ 10 μL、ROX Reference DyeⅡ 0.4 μL、上下游引物各0.8 μL、ddw 6 μL、模板2 μL,共20 μL。PCR反应程序为:95℃预变性30s;95℃ 5 s,60℃ 34 s,共40个循环。real-time PCR数据采集在ABI 7500系统上进行,以GAPDH为内参基因对细胞样本进行归一化处理,每份样品设置3个重复。
为进一步研究银杏外种皮多糖抑制病毒复制的机制,将银杏外种皮多糖处理组与对照组细胞裂解提取RNA后,进行real-time PCR检测细胞因子IL-1β、IFNβ、TNF-α,从而反应银杏外种皮多糖对病毒感染细胞的作用。real-time PCR引物见表1。
2 结果
2.1 银杏外种皮多糖细胞毒性检测 不同浓度的银杏外种皮多糖(0、20、50、100、200 μg/mL)与 DF-1细胞孵育72 h后,加入CCK-8检测细胞毒性。结果显示银杏外种皮多糖在浓度达到200 μg/mL处理细胞时,仍然对DF-1细胞没有毒性,并且5~200 μg/mL对细胞作用没有差异,如图2所示。根据已发表的文献结合后期的抗病毒效果并考虑到实验用量以及以后的临床推广,选择20 μg/mL的银杏外种皮多糖剂量继续进行后续的实验。

表1 Real-time PCR引物序列Table1 Primer sequences of real-time PCR

图2 不同浓度GBEP的细胞安全性检测Fig.2 Cell viability of DF-1 cells treated by GBEP with various concentrations
2.2 银杏外种皮多糖抑制病毒基因表达 在ALV-J复制过程中加入银杏外种皮多糖,可以明显观察到在20 μg/mL浓度下,GBEP极显著地抑制病毒gp37基因的表达,并且这种抑制效果呈现剂量和时间依赖性,结果见图3。

图3 GBEP抑制病毒基因表达呈剂量与时间依赖性Fig.3 Inhibition of virus replication by GBEP in a dose and time dependent manner
2.3 银杏外种皮多糖抑制病毒蛋白合成与病毒增殖为了检测GBEP对病毒蛋白合成和增殖的影响,收集病毒复制72 h的上清进行TCID50检测,裂解细胞液进行Western blot检测病毒蛋白合成。图4结果清晰的显示,GBEP明显抑制病毒蛋白的合成以及病毒的增殖,进一步验证了GBEP在DF-1细胞中具有抑制ALV-J复制的能力。
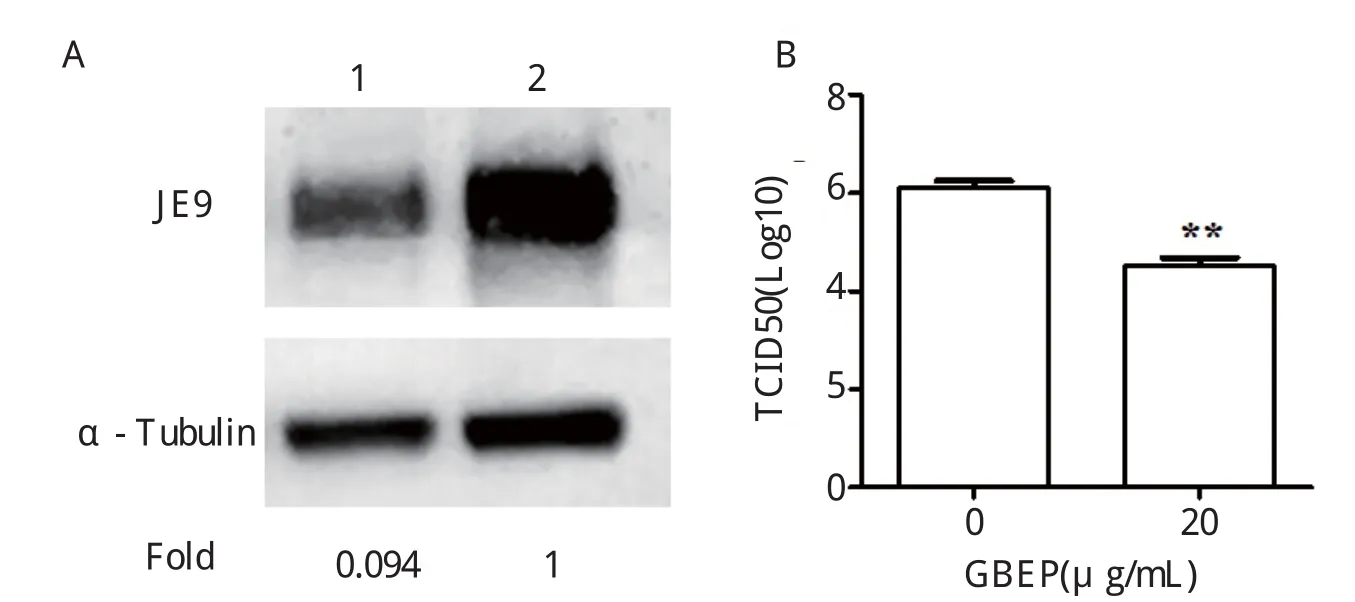
图4 GBEP抑制病毒蛋白合成和病毒增殖Fig.4 Inhibition of viral protein expression and viral proliferation by GBEP
2.4 银杏外种皮多糖不同加入时间对ALV-J复制的影响 为了进一步探究银杏外种皮多糖抑制病毒复制的作用环节,按照图1的实验设计,不同时间点加入GBEP处理细胞,待病毒感染72 h后收取细胞悬液,检测病毒的增殖情况。结果表明GBEP在细胞前处理、病毒吸附和病毒感染后3个阶段都发挥明显的抗病毒作用,呈现出多位点、多环节的作用,但具体的机制还有待日后实验来阐明(图5)。

图5 银杏外种皮多糖在不同加入时间抑制ALV-J增殖的作用Fig. 5 Antiviral effects of GBEP on ALV-J proliferation at different time points
2.5 银杏外种皮多糖对病毒感染细胞中细胞因子表达的影响 根据以往的报道,银杏外种皮多糖具有调节淋巴细胞免疫活性的作用[7,9]。因此,本研究检测了GBEP处理后病毒感染细胞中IL-1β、IFNβ和TNF-α的表达水平。结果显示,GBEP极其显著地抑制病毒感染细胞中IL-1β和TNF-α的表达,而对抗病毒细胞因子IFNβ的表达没有任何影响(图6)。GBEP抑制细胞因子表达与抑制病毒复制存在怎样的关联,还需进一步的深入研究。

图6 银杏外种皮多糖对ALV-J感染DF-1细胞因子表达影响Fig.6 Effects of GBEP on cytokines expression in ALV-J infected cells
3 讨论
近年来,由于国家相关机构和国内大型育种公司的重视,禽白血病在局部地区得到有效控制和净化,发病率和死亡率正在下降。在禽白血病净化工作中,除了严格的淘汰病毒感染阳性个体外,还需要有效的抗病毒化合物以防止鸡群再次感染和水平传播。随着国家对食品安全高度重视,抗生素和其他抗病毒药物的使用越来越标准化和规范化,许多药物由于其毒副作用高,对机体器官损伤大,已经成为禁用药。而传统中药有广泛的来源,具有副作用低、无残留的特点。此外,它还具有改善免疫系统,抗病毒和抗肿瘤的生物学特性,因此中药已经逐渐成为一个令人关注的热门话题,特别是在东亚、远东和非洲国家及地区[3,4]。抗病毒中药的研发为病毒的预防和治疗提供新型安全手段。
银杏是世界上珍贵的药用植物资源,它的叶、果和外种皮等都有药用开发价值。利用银杏叶生产的银杏提取物制剂是畅销国内外的天然药物之一,同时银杏果开发的各种营养食品在国内外市场中都有销售[11]。银杏外种皮多糖是从银杏外种皮中提取出来的一种活性多糖,毒副作用低。研究表明,银杏外种皮中GBEP含量较高,并具有提高机体免疫、延缓衰老、促进超氧化物歧化酶形成、杀灭肿瘤细胞等作用[12-14]。但是国内外利用银杏外种皮多糖进行抗病毒的研究非常少,仅夏前贤等[15]发现银杏外种皮多糖具有抵抗NDV在鸡胚内复制的能力。
本研究较为详细的研究了GBEP对ALV-J复制的抑制作用。首次发现,GBEP在DF-1细胞中显著地抑制病毒基因表达、蛋白合成以及病毒的增殖,而且这种抗病毒作用呈现剂量和时间依赖性。以往中药抗病毒作用主要集中于黄酮类化合物的抗病毒效果[3],而本研究发现GBEP具有抑制家禽白血病病毒的能力,而且这种抗病毒作用在病毒复制的多个环节都有效,说明GBEP抗病毒的活性值得关注。本研究还检测了GBEP对病毒感染细胞中免疫相关细胞因子的检测,发现GBEP强力抑制IL-1β和TNF-α的表达,而对常规抗病毒干扰素IFNβ的表达没有任何影响。临床中ALV-J病毒感染易感宿主最终引起多器官的肿瘤。肿瘤在形成过程中伴随着大量炎症因子的表达,过度的炎症因子表达对正常器官是一种损伤。虽然炎症因子表达高低与ALV-J复制的关系还不清楚,但是从临床肿瘤形成可以推断,炎症因子可能有助于病毒的复制。本研究结果显示,GBEP在抑制ALV-J复制过程中,明显抑制病毒感染细胞中IL-1β和TNF-α两种炎症因子的表达,是否是GBEP抗病毒的关键还需要更多的实验来证明。此外,ALV-J是一种免疫抑制性病毒,病毒感染后并不引起细胞或者宿主干扰素表达的增加[16]。GBEP的处理也未显著提高IFNβ的表达。这一结果提示我们,作为天然免疫抗病毒的主要干扰素家族在GBEP抑制ALV-J复制过程中并未发挥作用,其中具体的机理有待日后深入研究来阐明。
[1]Payne L N,Nair V. The long view: 40 years of Avian leukosis research[J]. Avian Pathol, 2012, 41(1):11-19.
[2]Sun S, Cui Z. Epidemiological and pathological studies of subgroup J avian leukosis virus infections in Chinese local"yellow" chickens[J]. Avian Pathol, 2007, 36 (3):221-226.
[3]Chattopadhyay D, Sarkar M C, Chatterjee T,et al. Recent advancements for the evaluation of anti-viral activities of natural products[J]. New Biotechnol, 2009, 25 (5): 347-368.
[4]Mukhtar M, Arshad M, Ahmad M,et al. Antiviral potentials of medicinal plants[J]. Virus Res, 2008, 131(2):111-20.
[5]王英燕, 王海. 抗病毒中药的研究进展[J]. 中医药学报,2006, 34(1): 25-26.
[6]余碧钰, 强静, 梁宪扬. 银杏外种皮多糖与银杏叶中黄酮含量比较[J]. 中草药, 1991, 22(8): 376.
[7]陈群, 杨桂文. 银杏白果多糖的免疫调节活性与抗肿瘤作用[J]. 中国实用医药杂志, 2004, 54(10): 29.
[8]许爱华, 陈华圣, 陈刚, 等. 银杏外种皮多糖对SGC-7901细胞p53基因的表达及端粒酶活性的影响[J]. 中国药理学通报, 2003(10): 12-13.
[9]余建国. 银杏叶多糖对雏鸡肿瘤坏死因子α和γ干扰素产生的影响[J]. 中国预防兽医学报, 2006(5): 81-83.
[10]Ding Y, Dou J, Teng Z J,et al. Antiviral activity of baicalin against influenza A (H1N1/H3N2) virus in cell culture and in mice and its inhibition of neuraminidase[J].Arch Virol, 2014, 159 (12): 3269-3278.
[11]陈静静. 银杏外种皮多糖的纯化, 组分分析和杭氧化活性研究[D]. 无锡: 江南大学, 2011.
[12]陈华圣, 许爱华, 王 , 等. 银杏外种皮多糖对免疫功能低下小鼠IL-2活性及sIL-2R的影响[J]. 中药药理与临床, 2001, 17(4): 17-19.
[13]贾玲昌, 许爱华, 宋根平, 等. 2种银杏外种皮多糖的成分及药效学比较研究[J]. 中国新药杂志, 2001,10(8): 592-594.
[14]仰榴青, 徐佐旗, 吴向阳, 等. 银杏多糖的研究进展[J]. 食品科学, 2004, 25(11): 372-375.
[15]夏前贤, 承南, 焦金英, 等. 银杏外种皮多糖的制备及其抗新城疫病毒作用的初步研究[J]. 黑龙江畜牧兽医,2017 (7): 216-219.
[16]Feng M, Zhang X. Immunity to avian leukosis virus:where are we now and what should we do? [J]. Front Immunol, 2016, 7:624.
ANTIVIRAL ACTIVITY OF GINKGO BILOBA EXOCARP POLYSACCHARIDE AGAINST SUBGROUP J AVIAN LEUKOSIS VIRUS IN DF-1 CELL
QIAN Kun1,2,3, KONG Zheng-ru1,2, ZHANG Jie1,2, QIN Ai-jian1,2,3
(1. Ministry of Education Key Lab for Avian Preventive Medicine, Yangzhou University, Yangzhou 225009, China; 2. Key Laboratory of Jiangsu Preventive Veterinary Medicine, Yangzhou University, Yangzhou 225009, China;; 3. Jiangsu Co-innovation Centre for the Prevention and Control of Important Animal Infectious Diseases and Zoonoses, Yangzhou 225009, China)
To investigate the antiviral effects of ginkgo biloba exocarp polysaccharide (GBEP) on the replication of Avian leukosis virus subgroup J (ALV-J), DF-1 cells were treated with GBEP at different time points. The results indicated that GBEP strongly inhibited viral gene transcription, protein expression and virus titers through dose and time dependent manners as detected using qRT-PCR, Western blot and TCID50assays. We also noted that GBEP greatly down-regulated the expression of IL-1β, TNFα and other immune related cytokines.Overall, this study highlighted that GBEP exerted its anti-avian leukosis virus activity and might be developed as a preventive drug for ALV-J infection in the future.
Avian leukosis virus subgroup J; ginkgo biloba exocarp polysaccharide; virus replication; inhibition
S852.659.3
A
1674-6422(2018)01-0013-06
2017-08-30
国家重点研发计划(2017YFD0500700、2016YFD0500800);国家自然科学基金(31772734);江苏省优势学科项目;扬州大学新世纪人才项目
钱琨,男,博士,副教授,主要从事动物微生物及免疫学研究;孔正茹,女,硕士研究生,预防兽医学专业
钱琨,E-mail: qiankun@yzu.edu.cn
