乳腺癌改良根治术后放疗患者上肢淋巴水肿与腋淋巴结手术结果的相关性分析
2018-03-01张顺康孙丽云
张顺康,孙丽云,陈 刚
上海市黄浦区中心医院放疗科,上海 200002
随着近年来乳腺癌综合治疗技术的不断进步,乳腺癌患者的长期生存率明显提高,5年总体生存率已达85%以上[1]。越来越多的乳腺癌患者在取得长期生存获益的同时,也面临着治疗相关不良反应的威胁。乳腺癌相关淋巴水肿(breast cancer-realated lymphedema,BCRL)是一种乳腺癌治疗后常见的不良反应[2]。由于其发生、发展过程可贯穿于乳腺癌患者的整个生存过程中[3],因此,BCRL对乳腺癌患者来说是一种终生性的威胁。
BCRL常表现为患侧上肢进行性加重的水肿,造成患肢不适从而影响患者的日常行为[4];严重者可出现水肿部位反复感染,并导致肢体疼痛、功能障碍,甚至发生恶性肿瘤,明显降低了患者的生存质量[5-7]。淋巴水肿在病理生理学上分为早期可逆和后期不可逆两个阶段[8]。而美国国家淋巴水肿网络在2012年即指出淋巴水肿在可逆阶段的早期诊断治疗对于改善患者症状和提高生存质量的重要性[9]。
已知的可增加BCRL发生风险的乳腺癌治疗相关因素包括腋淋巴结清扫术(axillary lymphnode dissection,ALND)、区域淋巴结放疗及化疗等[10-15]。ALND作为乳腺癌改良根治术的组成部分,由于其破坏腋窝淋巴引流系统的解剖结构,对BCRL发生、发展的影响更为直接。在已发表的相关研究结果中,关于ALND的具体结果对BCRL的影响却鲜有报道。本研究拟通过对乳腺癌改良根治术后放疗患者BCRL发生情况的观察,重点分析患者ALND结果(包括阳性淋巴结个数、切除淋巴结总数及两者的比值,即淋巴结阳性率)与发生BCRL之间的相关性,并同时分析患者年龄、体质量指数(body mass index,BMI)和其他治疗相关因素(化疗、靶向治疗、内分泌治疗及放疗范围等)对BCRL发生的影响,为筛选BCRL高危患者、开展BCRL的早期诊断治疗工作提供一定的临床依据。
1 资料和方法
1.1 患者的收集与筛选
前瞻性收集2015年1月1日—12月31日在上海市黄浦区中心医院放疗科行乳腺癌改良根治术后放疗的患者。在放疗开始前,每例患者均需进行入组筛选。
入组条件:① 符合2014版NCCN乳腺癌治疗指南[16]中规定的术后放疗指征的18~80岁女性乳腺癌改良根治术后患者;② 采用NSABP B-04研究[17]中BCRL的上肢周径测量诊断法与诊断标准,明确放疗开始前无BCRL;③ 患者放疗前已完成辅助化疗或由于某些因素无法继续完成化疗;④ 无近期患侧上肢外伤史。
排除条件:① 男性乳腺癌患者;② 放疗开始前已有BCRL或伴有由于静脉原因(深静脉血栓)、肿瘤复发、低蛋白血症、心因性、肾性及内分泌功能异常等因素引起的水肿;③ 有新辅助化疗情况或未行化疗的乳腺癌患者;④ 放疗开始前已有局部复发及远处转移情况。
按照上述条件进行收集和筛选,期间共有202例患者符合入组条件。放疗开始前对所有入组患者均测量身高和体质量以获得BMI。定义BMI<24为正常体质量范围,BMI≥24为超重[18]。所有入组患者放疗前进行血常规与生化指标检查、胸部摄片、全身B超检查、心电图及心脏彩超等常规检查以初步排除放疗禁忌证、肿瘤复发及远处转移等情况。在放疗定位前由主治医师向患者详细告知放疗的治疗内容及须知的细节(包括患侧上肢功能锻炼方法及上肢淋巴水肿风险与预防内容的告知),并签署《放射治疗知情同意书》。
1.2 术后放疗
术后放疗采用CT模拟定位。CT图像经重建后传输至Eclipse 11治疗计划系统,完成靶区与正常器官的勾画。放疗靶区包含患侧胸壁;对于pN1-3期的患者增加锁骨上野的照射,锁骨上野的范围包括同侧Ⅳ区颈淋巴结及腋窝第Ⅲ组淋巴结;对于原发肿瘤位于乳房内侧象限或中央区并且伴有腋窝淋巴结转移的患者增加内乳淋巴结区的照射;放疗靶区按照RTOG乳腺癌放疗靶区勾画图谱介绍的范围进行勾画[19]。胸壁及区域淋巴结的放疗处方剂量为5周内50 Gy/25次。放疗计划采用6~8野的逆向调强放疗计划。
1.3 上肢周径测量与淋巴水肿的诊断
入组患者分别在放疗开始前、放疗结束时及结束后3、6、9、12个月随访中进行上肢周径的测量。患者上肢周径的测量由放疗科医师进行操作,测量工具采用统一规格的软皮尺,测量精度为1 mm。上肢周径的测量部位与淋巴水肿的诊断标准均采用NSABP B-04研究[17]中的方案。具体测量方法为:患者取直立位并自肩关节以下裸露双侧手臂,手臂先自然下垂,然后手心朝前手臂轻微外展固定;医师明确标注测量部位,具体测量部位为双侧手臂的肩峰下15 cm处及尺骨鹰嘴下15 cm处;医师将软皮尺沿测量部位手臂绕一周,读取周径数值并记录。如有患侧上肢任一测量部位周径超过健侧上肢相同测量部位2 cm者即诊断为BCRL[17]。
1.4 统计学处理
记录患者从放疗开始至放疗结束后12个月的BCRL发生情况,对于观察期内未完成放疗或出现局部复发及远处转移的患者予停止观察并且不进入最后的统计。将患者年龄、阳性淋巴结个数、切除淋巴结总数及淋巴结阳性率4个连续变量做单因素方差分析;将BMI、化疗、内分泌治疗、靶向治疗及放疗范围5个分组变量做单因素χ2检验;对单因素分析有意义的变量进行Cox回归多因素分析。统计软件采用IBM SPSS Statistics version 19.0,作图采用Graph Pad Prism 6.0软件。P<0.05为差异有统计学意义。
2 结 果
2.1 患者临床特征
入组的202例乳腺癌术后患者均顺利完成放疗。其中,197例患者完成了放疗结束后12个月的随访观察;1例患者放疗结束4个月后出现胸壁转移而停止观察;4例患者在放疗完成后的12个月内失访,且失访前未发生BCRL。197例患者的临床特征分布见表1。
2.2 上肢周径测量结果与BCRL的发生情况
所有入组患者均完成了上肢周径测量数据的收集。观察期内共有38例患者诊断为BCRL,发生率为19.3%(38/197)。
入组患者因缺乏乳腺癌改良根治术前的上肢周径测量数据,故将放疗前测量的上肢周径作为初始参考值。除38例诊断为BCRL的患者外,其余患者在观察期内的上肢周径测量结果与初始参考值比较的变化均在1 cm以内。
不同时间段BCRL的发生情况见图1。
2.3 BCRL影响因素的单因素分析
将患者的年龄、切除淋巴结总数、阳性淋巴结个数及淋巴结阳性率做均值的单因素方差分析,将BMI、辅助化疗、靶向治疗、内分泌治疗及放疗范围等做单因素χ2检验,具体数据见表2。
单因素分析结果显示,切除淋巴结总数、阳性淋巴结个数及淋巴结阳性率与BCRL的发生具有相关性。
2.4 BCRL影响因素的多因素分析
根据单因素分析结果,在Cox回归多因素分析中将阳性淋巴结个数、切除淋巴结总数与淋巴结阳性率作为协变量进行分析,结果见表3。多因素分析结果显示,腋淋巴结切除总数是影响BCRL发生的独立危险因素,而阳性淋巴结个数与淋巴结阳性率并非影响BCRL发生的独立危险因素。

表 1 197例患者的临床特征分布Tab. 1 Clinical characteristics distribution of 197 patients
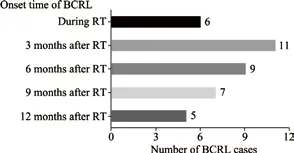
图 1 不同时间段BCRL的发生情况Fig. 1 The onset of BCRL in different time peroid

表 2 BCRL影响因素的单因素分析Tab. 2 Univariate analysis of inf l uence factors on BCRL

表 3 BCRL影响因素的多因素分析Tab. 3 Multivariate analysis of inf l uence factors on BCRL
3 讨 论
本研究以BCRL这一乳腺癌常见的治疗相关不良反应作为研究对象,在通过采用上肢周径测量法随访观察197例乳腺癌改良根治术后放疗患者的BCRL发生情况后,发现这些患者的腋淋巴结手术结果与BCRL的发生有一定的相关性。其中切除淋巴结总数在单、多因素分析中均显示与BCRL的发生密切相关,差异有统计学意义,提示切除淋巴结总数的增加是BCRL的独立危险因素。尽管多因素分析排除阳性淋巴结个数和淋巴结阳性率的独立危险因素地位,但单因素分析结果显示,两者的增加的确提高了患者BCRL的发生风险。而在本研究的患者中,年龄、BMI及其他治疗相关因素(化疗方案是否含紫杉醇、靶向治疗、内分泌治疗及放疗范围)均对BCRL的发生无显著影响。
关于切除淋巴结总数对BCRL发生风险的影响已有一些相关的研究报道[10-13,20-22]。Paskett等[11]观察622例年龄不超过45岁的乳腺癌患者术后3年的淋巴水肿发生情况后同样分析得出,手术切除淋巴结个数的增加导致了淋巴水肿发生风险的提升(HR=1.02,P<0.01)。Hayes等[12]的单中心大样本队列研究发现,乳腺癌保乳手术患者的淋巴水肿发生率随着腋淋巴结切取个数的增加而增加,且水肿的严重程度也随之加重(P<0.001)。
在过去的20年中,乳腺癌的手术治疗越来越提倡减少切除范围以降低手术相关损伤发生率,但在总体疗效方面并未作出妥协。例如,在腋窝淋巴结的术式方面,相关研究结果显示,前哨淋巴结活检(sentinel lymphnode biopsy,SLNB)阴性的乳腺癌患者10年随访区域淋巴结复发率不到1%,远低于ALND阴性患者的区域淋巴结复发率[23]。一项随访时间长达15年的针对老年早期(T1N0)乳腺癌患者的临床研究同样显示,与SLNB比较,ALND的临床获益非常有限:两者的肿瘤远处转移率、总体生存率及乳腺癌专项死亡率均较为接近,而SLNB组患者的腋窝复发率仅为6%[24]。而在SLNB显示有阳性淋巴结而行ALND的乳腺癌患者中,有50%的患者术后病理证实为仅存在前哨淋巴结转移[25]。另有两项随机研究结果显示,在前哨淋巴结转移的患者中,接受ALND治疗后无病生存率及总体生存率并无明显的改善[26-27]。因此,对于早期乳腺癌患者来说,SLNB已经可以作为替代传统的ALND成为区域淋巴结评价的有效手段,并在减少手术相关损伤的同时而不影响整体疗效。因此,在有效评估区域淋巴结分期的前提下,尽量减小腋窝手术范围、减少淋巴结切取总数对于预防和减少BCRL的发生有更加显著的意义。
阳性淋巴结个数与淋巴结阳性率提示区域淋巴结的肿瘤进展程度。在已报道的BCRL相关风险的研究中,几乎没有将这两者直接作为研究目标的,而肿瘤分期与BCRL发生的相关性研究却有一些。Clough-Gorr等[28]对660例Ⅰ~Ⅲ期乳腺癌患者7年随访观察发现,Ⅱ~Ⅲ期患者较Ⅰ期患者的淋巴水肿发生风险明显增加(OR=1.77)。Shah等[10]的研究同样显示,Ⅱ~Ⅲ期患者较Ⅰ期患者的淋巴水肿发生率明显升高(10.8% vs 2.9%,P<0.001)。吴佳等[29]对92例乳腺癌患者回顾性分析后发现,腋窝淋巴结阳性和阴性患者的BCRL发生率分别为41.5%和11.1%(P=0.005),而Ⅲ期患者对比0~Ⅱ期患者,BCRL发生率则分别为52.5%和17.3%(P=0.000)。上述研究结果均显示,肿瘤的进展程度与BCRL发生风险存在正相关,这与本研究的结果是基本一致的。结合BCRL发生的病理生理学机制进行分析,淋巴水肿的发生与局部淋巴循环结构破坏、淋巴液运输能力不足有关,当乳腺癌患者肿瘤累及腋淋巴结,肿瘤细胞破坏淋巴结的正常结构而使得腋窝局部淋巴循环受到影响,在受影响程度未达到一定阈值时不会表现出局部水肿,却增加了腋淋巴结清扫及放疗后发生BCRL的潜在风险;亦或在受累淋巴结超过一定数量后则可能直接造成水肿,这也是为何部分患者在初诊时已经有患侧上肢水肿的原因。
本研究结果显示,切除淋巴结总数增加是乳腺癌改良根治术后放疗患者发生BCRL的唯一独立危险因素,然而并不代表腋窝手术是本研究入组患者发生BCRL的唯一原因。Nguyen等[30]在对超过1 700例乳腺癌患者的大样本队列研究中发现,接受ALND与放化疗的患者的5年BCRL累积发生率最高,达到25%以上;在单纯手术治疗的患者中,行SLNB或ALND的两组患者间5年BCRL的累积发生率差异无统计学意义(4.1% vs 3.5%,P=0.36);而在接受ALND的患者中,放疗和未放疗患者的5年BCRL累积发生率的差异则有统计学意义(9.5% vs 3.5%,P=0.01)。提示BCRL的发生与多种治疗模式共同作用有关,而非手术单独作用的结果。本研究入组患者恰符合Nguyen等的研究队列中BCRL风险最高的一组患者的特征,虽因观察时间稍短而未达到25%以上的BCRL累积发生率,但本研究中38例患者BCRL的发生同样也是手术、放疗等多种治疗因素共同作用结果。
综上所述,乳腺癌改良根治术后放疗患者的BCRL发生情况与腋淋巴结手术结果之间存在相关性,其中切除淋巴结总数增加是BCLR的独立危险因素。对于切除淋巴结总数较多的患者,我们在制定术后相关治疗方案时要充分重视其较高的BCRL发生风险,并对这部分患者进行更加密切的随访观察,以便对其淋巴水肿做出早期诊断和早期治疗。
[1] ALLEMANI C, WEIR H K, CARREIRA H, et al. Global surveillance of cancer survival 1995—2009:analysis of individual data for 25,676,887 patients from 279 populationbased registries in 67 countries (CONCORD-2) [J]. Lancet,2015, 385(9972): 977-1010.
[2] ERICKSON V S, PEARSON M L, GANZ P A, et al. Arm edema in breast cancer patients[J]. J Natl Cancer Inst,2001, 93(2): 96-111.
[3] PETREK J A, SENIE R T, PETERS M, ROSEN P P, et al.Lymphedema in a cohort of breast carcinoma survivors 20 years after diagnosis [J]. Cancer, 2001, 92(6): 1368-1377.
[4] KARADIBAK D, YAVUZSEN T. Evaluation of kinesthetic sense and hand function in women with breast cancer-related lymphedema [J]. J Phys Ther Sci, 2015, 27(6): 1671-1675.
[5] CLARK B, SITZIA J, HARLOW W. Incidence and risk of arm oedema following treatment for breast cancer:a three-year follow-up study [J]. QJM, 2005, 98(5): 343-348.
[6] GELLER B M, VACEK P M, O’BRIEN P, et al. Factors associated with arm welling after breast cancer surgery [J].J Women’s Health, 2003, 12(9): 921-932.
[7] HUANG H P, ZHOU J R, ZENG Q. Risk Factors Associated with lymphedema among postmenopausal breast cancer survivors after radical mastectomy and axillary dissection in China [J]. Breast Care, 2012, 7(6): 461-464.
[8] BRORSON H, OHLIN K, OLSSON G, et al. Adipose tissue dominates chronic arm lymphedema following breast cancer:ananalysis using volume rendered CT images [J]. Lymphat Res Biol, 2006, 4(4): 199-210.
[9] National Lymphedema Network. National lymphedema network supplement to the national lymphedema network position statement breast cancer screening: Screening and early detectionof breast cancer-related lymphedema: the imperative.http://www.lymphnet.org/ pdfDocs/PP_Lymphedema_BC_Supplement.pdf
[10] SHAH C, WILKINSON J B, BASCHNAGEL A, et al. Factors associated with the development of breast cancer-related lymphedema after whole-breast irradiation [J]. Int J Radiat Oncol Biol Phys, 2012, 83(4): 1095-1100.
[11] PASKETT E D, NAUGHTON M J, MCCOY T P, et al. The epidemiology of arm and hand swelling in premenopausal breast cancer survivors [J]. Cancer Epidemiol Biomarkers Prev, 2007, 16(4): 775-782.
[12] HAYES S B, FREEDMAN G M, LI T, et al. Does axillary boost increase lymphedema compared with supraclavicular radiation alone after breast conservation? [J]. Int J Radiat Oncol Biol Phys, 2008, 72(5): 1449-1455.
[13] KIM M, KIM S W, LEE S U, et al. A model to estimate the risk of breast cancer-related lymphedema: combinations of treatment-related factors of the number of dissected axillary nodes, adjuvant chemotherapy, and radiation therapy[J].Int J Radiat Oncol Biol Phys, 2013, 86(3): 498-503.
[14] MILLER C L, SPECHT M C, SKOLNY M N, et al. Risk of lymphedema after mastectomy: potential benefit of applying ACOSOG Z0011 protocol to mastectomy patients [J].Breast Cancer Res Treat, 2014, 144(1): 71-77.
[15] DONKER M, VAN TIENHOVEN G, STRAVER M E, et al.Radiotherapy or surgery of the axilla after a positive sentinel node in breast cancer (EORTC 10981-22023 AMAROS): a randomised, multicentre, open-label, phase 3 non-inferiority trial [J]. Lancet Oncol, 2014, 15(12): 1303-1310.
[16] National Comprehensive Cancer Network. NCCN Clinical Practice Guidelines in Oncology: Breast Cancer, Version 3.2014. http://www.nccn.org/profe- ssionals/physician_gls/pdf/breast.pdf.
[17] DEUTSCH M, LAND S, BEGOVIC M, et al. The incidence of arm edema in women with breast cancer randomized on the National Surgical Adjuvant Breast and Bowel Project study B-04 to radical mastectomy versus total mastectomy and radiotherapy versus total mastectomy alone[J]. Int J Radiat Oncol Biol Phys, 2008, 70(4): 1020-1024.
[18] 中华人民共和国国家卫生和计划生育委员会. WS/T 455—2014卫生监测与评价名词术语 [Z]. 2014-11-15.
[19] LI X A, TAI A, ARTHUR D W, et al. Variability of target and normal structure delineation for breast cancer radiotherapy: an RTOG multi-institutional and multiobserver study[J]. Int J Radiat Oncol Biol Phys, 2009, 73(3): 944-951.
[20] YEN T W, FAN X, SPARAPANI R, et al. A contemporary,population-based study of lymphedema risk factors in older women with breast cancer [J]. Ann Surg Oncol, 2009,16(4): 979-988.
[21] PAIVA D M, LEITE I C, RODRIGUES VDE O, et al.Associated factors of lymphedema in breast cancer patients[J]. Rev Bras Ginecol Obstet, 2011, 33(2): 75-80.
[22] HONARVAR B, SAYAR N, TAHMASEBI S, et al. Correlates of lymphedema in women with breast cancer: a case control study in Shiraz, Southern Iran [J]. Asian Pac J Cancer Prev, 2016, 17(S3): 81-86.
[23] VERONESI U, VIALE G, PAGANELLI G, et al. Sentinel lymph node biopsy in breast cancer:ten-year results of a randomized controlled study [J]. Ann Surg, 2010, 251(4):595-600.
[24] MARTELLI G, BORACCHI P, ARDOINO I, et al. Axillary dissection versus no axillary dissection in older patients with T1N0 breast cancer: 15-year results of a randomized controlled trial [J]. Ann Surg, 2012, 256(6): 920-924.
[25] KIM T, GIULIANO A E, LYMAN G H. Lymphatic mapping and sentinel lymph node biopsy in early-stage breast carcinoma:a metaanalysis [J]. Cancer, 2006, 106(1): 4-16.
[26] GALIMBERTI V, COLE B F, ZURRIDA S, et al. Update of International Breast Cancer Study Group trial 23-01 to compare axillary dissection versus no axillary dissection in patients with clinically node negative breast cancer and micrometastases in the sentinel node [J]. Cancer Res,2011, 71(24 Suppl): S3-1.
[27] GIULIANO A E, HUNT K K, BALLMAN K V, et al. Axillary dissection vs no axillary dissection in women with invasive breast cancer and sentinel node metastasis:a randomized clinical trial [J]. JAMA, 2011, 305(6): 569-575.
[28] CLOUGH-GORR K M, GANZ P A, SILLIMAN R A. Older breast cancer survivors:factors associated with self-reported symptoms of persistent lymphedema over 7 years of follow-up[J]. Breast J, 2010, 16(2): 147-155.
[29] 吴 佳, 朱雅群, 田 野, 等. 乳腺癌放疗后上肢淋巴水肿的调查及危险因素分析 [J].临床肿瘤学杂志, 2013,18(10): 905-909.
[30] NGUYEN T T, HOSKIN T L, HABERMANN E B, et al. Breast cancer-related lymphedema risk is related to multidisciplinary treatment and not surgery alone: results from a large cohort study [J]. Ann Surg Oncol, 2017, 24(10): 2972-2980.
