口服营养补充对鼻咽癌同期放化疗患者的影响
2018-03-01丁慧萍窦圣金朱国培凌轶群
丁慧萍,窦圣金,汪 琼,吴 焱,钱 泳,朱国培,凌轶群
1.复旦大学附属肿瘤医院营养科,复旦大学上海医学院肿瘤学系,上海 200032;
2.上海交通大学医学院附属第九人民医院放疗科,上海 200011
同步放化疗是局部晚期鼻咽癌患者的首选治疗方案,但治疗相关的不良反应会造成患者吞咽困难、经口进食减少,从而导致体质量下降甚至营养不良[1]。营养不良的鼻咽癌患者常常会出现疲乏、疼痛、食欲丧失和身体功能下降,更容易加重放化疗不良反应,甚至引起放化疗的中断,影响患者的生活质量[2]。国外有研究报道,强化营养咨询和口服营养补充(oral nutritional supplements,ONS)可明显提高头颈部及胃肠道肿瘤患者营养状况和生活质量[3]。虽然ESPEN指南指出,ONS是营养不良患者的首选营养治疗途径[4],但是,目前国内外还没有针对强化营养教育和ONS与鼻咽癌同期放化疗患者营养状况的相关性研究。因此,我们采用前瞻性、随机对照的方法,在鼻咽癌患者同期放化疗期间对其进行强化营养咨询和ONS,观察其对营养状况及生活质量的影响,以期优化营养干预的方法。
1 资料和方法
1.1 研究对象
选择2014年6月—2015年12月在复旦大学附属肿瘤医院放疗科及上海交通大学第九人民医院放疗科就诊的64例鼻咽癌患者。
入选标准:年龄18~70岁;病理学确诊为WHO Ⅰ~Ⅲ型鼻咽癌;临床分期为Ⅲ~ⅣA期;需要接受同期放化疗的鼻咽癌患者;预计生存期至少6个月;KPS评分大于等于70;签署知情同意书;无严重心脏疾病及冠心病史;白细胞计数大于等于4.0×109/L,中性粒细胞绝对值大于等于2.0×109/L,血小板计数大于等于100×109/L,血红蛋白大于等于80 g/L;总胆红素、丙氨酸氨基转移酶及天门冬氨酸氨基转移酶均小于等于正常值上限;尿肌酐小于等于正常值上限并且肌酐清除率大于等于60 mL/min。
排除标准:具有其他恶性肿瘤病史;妊娠期或哺乳期妇女;同时伴有的疾病或情况影响患者的正常入组和研究期间的安全性;存在活动性精神障碍或有其他影响患者签署知情同意书和理解力的心理疾患;具有严重的活动性感染(包括肝炎);过敏体质或对该受试样品过敏者;糖尿病患者;研究者认为依从性差的患者。
1.2 ONS
试验组由营养师给予个体化营养咨询和ONS,营养咨询频率为放疗开始前1次,放疗开始后每周1次,持续6周;ONS为每天300~600 kcal,从放疗开始至放疗结束。ONS剂为愈素Ⅱ型(营养强化蛋白复合粉),由玛士撒拉(上海)医疗科技有限公司生产提供,25 g/袋,7袋/盒。主要原料包括乳清分离蛋白、大豆分离蛋白、海洋鱼低聚肽、麦芽糊精及维生素等。每袋提供热量100 kcal,蛋白质12 g。放疗开始后,在每天常规三餐外,试验组口服愈素Ⅱ型(营养强化蛋白复合粉),每次1袋,每天3次,能量每天300 kcal,14 d后愈素Ⅱ型服用量改为每天6袋,分3次以上服用,能量每天600 kcal,至治疗结束。对照组给予常规治疗。
1.3 鼻咽癌治疗情况
所有入组患者均采用调强适形放疗技术。DT 66.0~70.4 Gy/30~32 F常规分割,同期化疗:顺铂80 mg/m2,静脉滴注,第1~3天,每3周为1个疗程,共完成2个疗程。
1.4 观察指标
1.4.1 主要观察指标(营养相关指标)
1.4.1.1 人体成分分析
采用韩国Biospace InbodyS10人体成分分析仪进行人体成分检测。测量指标包括脂肪组织(fat mass,FM)、去脂组织(free fat mass,FFM)、体细胞量(body cell mass,BCM)、骨骼肌量(skeletal muscle mass,SM)及相位角(phase angle,PA)等。所有研究对象测量前2 h禁食,平卧5 min开始测量,测量前用乙醇将皮肤和电极接触点擦湿。本研究的人体成分仪器测定均由专人经过统一培训后进行操作。患者在接受治疗前测量1次,同期放化疗开始后每周固定时间测量1次及治疗结束后的3个月测量1次。
脂肪组织指数(fat mass index,FMI)和去脂组织指数(fat-free mass index,FFMI)均用以下公式计算:FFMI(kg/m2)=FFM(kg)/height2(m2),FMI(kg/m2)=FM(kg)/height2(m2)。
1.4.1.2 患者主观整体评估(patient-generated subjective global assessment,PG-SGA)
经过筛查得出PG-SGA分级,A级表示营养良好(0~3分),B级表示中度或可疑营养不良(4~8分),C级代表严重营养不良(≥9分)。患者将在治疗前、同期放化疗后每2周及治疗结束后的3个月测量。
1.4.2 次要观察指标(生活质量评估)
患者生活质量采用欧洲癌症研究与治疗组织生活质量核心量表QLQ-C30和头颈肿瘤模块量表QLQ-H&N35进行评价。量表以问卷的形式由患者自我填写,患者将在治疗前、同期放化疗后每2周及治疗结束后的3个月分别接受问卷调查。
1.5 统计学处理
应用SPSS 20.0软件对数据进行统计学分析。测量方法采用重复测定方差分析,测量值用±s 表示,相关性采用Pearson线性相关分析,采用非条件Logistic回归分析的方法,分析营养状况的影响因素,建立预测模型,P<0.05为差异有统计学意义。
2 结 果
2.1 基本资料
研究对象基本资料见表1,共入组64例患者,42例患者按要求完成了营养评估,其中,试验组23例,对照组19例。其中,男性42例,女性17例,年龄(45.20±1.86)岁,基线KPS评分在80~90分之间的患者占95%,顺铂同步化疗完成次数2次以上患者占92%。
2.2 两组在放疗期间人体成分的变化
同步放化疗期间随着观察时间的变化,所有患者人体成分指标均有不同程度的下降,体质量、BMI、FMI及FFMI从第2周开始出现明显降低,第6周达到最低;PA从放疗开始逐渐下降,第6周达到最低。试验组与对照组相比,体质量、BMI、FMI、FFMI及PA在同步放化疗期间下降的趋势有所缓和,且在整个放疗期间,上述指标结果试验组均高于对照组,差异无统计学意义(P>0.05,表2)。
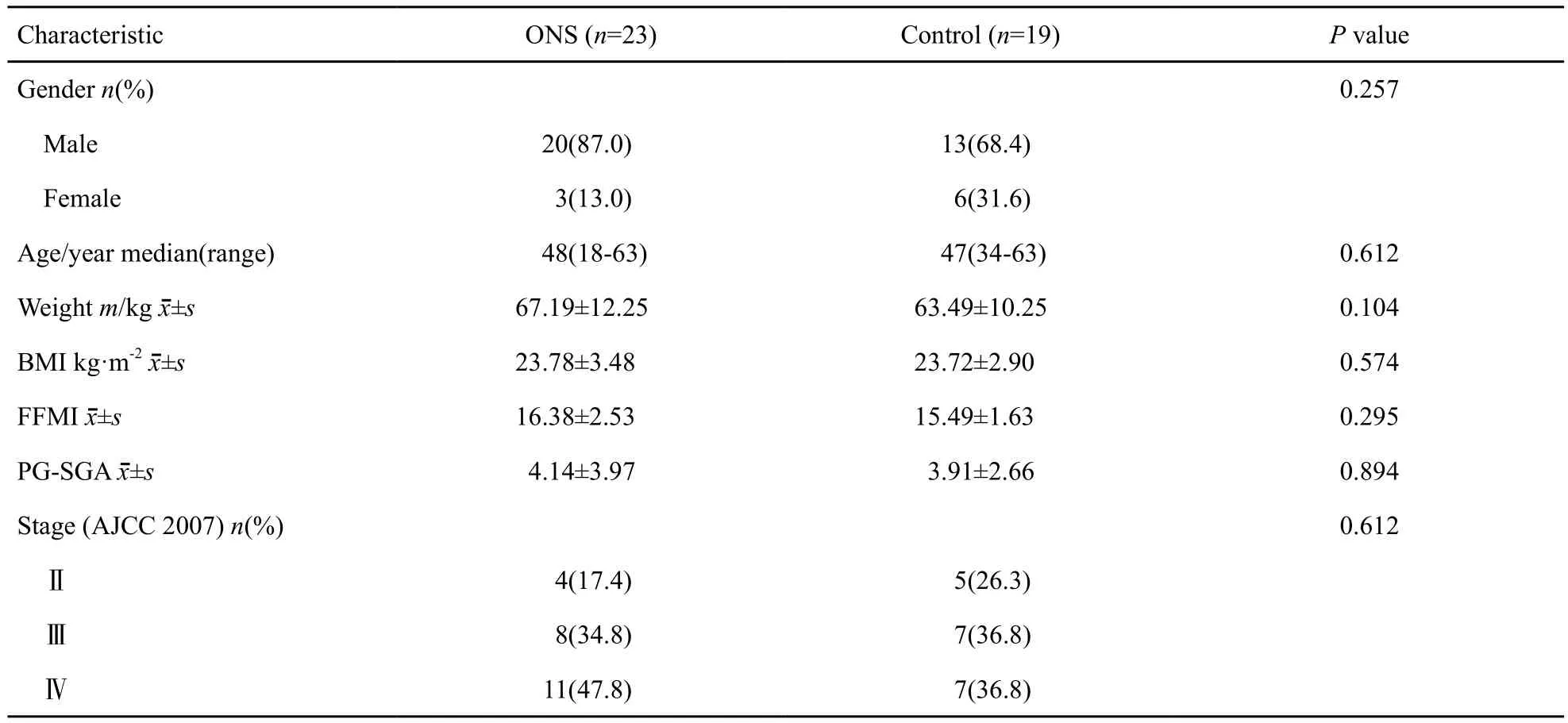
表 1 研究对象基本资料Tab. 1 Characteristics of study samples
2.3 两组在放疗期间PG-SGA的变化
PG-SGA的评分值在第2周开始急剧上升,第6周达到最高。PG-SGA的评分值,试验组均低于对照组,差异无统计学意义(P>0.05,图1)。
2.4 两组在放疗期间生活质量的变化
在同步放化疗期间,总体健康状况、恶心与呕吐、疼痛、食欲丧失、便秘及腹泻,ONS组均好于对照组,差异无统计学意义(P>0.05)。在放疗期间,以上各项指标的平均变化值,ONS组均小于对照组,差异无统计学意义(P>0.05,表3)。
表 2 两组在放疗期间人体成分的变化Tab. 2 Changes in nutritional parameters of two groups during radiation therapy

表 2 两组在放疗期间人体成分的变化Tab. 2 Changes in nutritional parameters of two groups during radiation therapy
PA: Phase angle
Change Baseline W1 W2 W3 W4 W5 W6 ONS Control ONS Control ONS Control ONS Control ONS Control ONS Control ONS Control Weight m/kg 67.19±12.2563.49±10.2567.28±12.6163.58±11.3366.58±12.4863.07±11.4465.29±12.2962.13±11.2764.13±12.2561.10±11.2262.71±12.6360.15±11.1261.38±12.2758.05±10.64 BMI/(kg·m-2) 23.78±3.4823.72±2.9023.29±3.4523.33±3.2523.54±3.4223.13±3.0323.08±3.3922.81±3.2822.68±3.3822.41±3.3022.16±3.4822.07±3.3921.69±3.3521.33±3.24 FMI/(kg·m-2) 7.26±2.027.81±2.097.07±2.027.86±2.147.03±2.007.73±2.136.89±1.847.68±2.106.71±1.897.49±2.046.45±1.987.36±2.126.22±1.726.84±2.15 FFMI/(kg·m-2) 16.38±2.5315.49±1.6316.50±2.5715.48±1.9216.37±2.4515.40±1.8916.00±2.5815.10±1.9415.83±2.3114.93±1.7914.96±4.3514.72±1.7513.76±5.4414.48±1.91 PA/º 5.51±0.945.32±0.565.80±1.105.58±0.555.73±0.965.46±0.535.75±0.925.46±0.725.62±0.915.58±0.515.58±1.025.24±0.715.50±0.855.52±1.01

图 1 两组在放疗期间PG-SGA的变化Fig. 1 Changes of PG-SGA score between the two groups
2.5 营养补充摄入量大于2/3计划量组与对照组在放疗期间人体成分的比较
ONS摄入量大于2/3计划量的患者与对照组相比,人体成分指标FFMI和SM在放疗期间下降的趋势较缓和,而且两个指标的结果ONS组明显好于对照组,差异有统计学意义(P<0.05,图2)。
2.6 营养补充摄入量大于2/3计划量组与对照组在放疗期间生活质量的比较
在放疗期间,生活质量评分指标如总体健康状况、恶心与呕吐、疼痛及便秘的平均变化值,ONS组均小于对照组,差异无统计学意义(P>0.05,图3)。
表 3 两组在放疗期间生活质量的变化Tab. 3 Changes in QOL of two groups during radiation therapy(±s)

表 3 两组在放疗期间生活质量的变化Tab. 3 Changes in QOL of two groups during radiation therapy(±s)
Baseline W2 W4 W6 Change P value ONS Control ONS Control ONS Control ONS Control Global QOL 4.83±1.13 5.42±1.20 4.25±1.57 4.58±1.69 2.92±1.20 3.42±1.11 3.67±1.86 3.33±0.82 0.976 Nausea and vomiting 1.40±0.65 1.08±0.20 2.00±0.79 1.67±0.82 2.50±1.00 2.42±1.20 3.00±0.94 2.00±0.63 0.291 Pain 1.25±0.29 1.40±0.89 1.75±0.50 1.40±0.55 2.00±0.58 2.60±0.66 1.88±0.85 2.70±0.67 0.41 Appetite 2.00±1.00 1.67±1.21 2.60±0.89 3.33±1.21 2.80±0.84 3.67±0.52 3.40±0.54 3.33±0.82 0.478 Constipation 1.20±0.45 1.33±0.52 1.00±0.71 1.67±1.03 2.00±0.71 2.17±1.17 2.40±1.14 2.33±0.82 0.545 Diarrhea 1.40±0.65 1.00±0.63 2.00±1.00 1.17±0.41 1.20±0.84 1.17±0.41 1.20±0.45 1.33±0.52 0.429

图 2 营养补充摄入量大于2/3与对照组在放疗期间人体成分的比较Fig. 2 Changes of FFMI and SM between patients with total intake >2/3 planed and the control group

图 3 营养补充摄入量>2/3与对照组在放疗期间生活质量的比较Fig. 3 Changes of nausea and vomiting, global QOL, pain and constipation between patients with total intake >2/3 planed and the control group
3 讨 论
35%~60%的头颈肿瘤患者在诊断时已发生营养不良,而放化疗引起的味觉和嗅觉改变、胃肠道反应、黏膜炎、涎腺功能下降及吞咽困难等不良反应会进一步加重患者的营养不良。营养不良又可导致机体免疫力下降、放疗毒性的增加、较低的化疗缓解率、生活质量的下降及不良预后[5]。虽然已有大量研究证实放疗会引起以上的不良反应,加重患者的营养不良状况,但是对于如何有效的改善鼻咽癌同期放化疗患者的营养状况,以及采用哪种方式更适合目前还没有定论。因此,本研究首次就强化营养咨询和ONS对于改善鼻咽癌同期放化疗患者的营养状况进行了探索性的干预研究。
在本项研究中,采用PG-SGA法动态观察鼻咽癌患者放疗期间营养状况的变化。人体成分分析在反映身体质量变化的同时,更能够了解是由于哪一部分组织丢失导致的体质量变化,十分适用于动态观察人体组成的变化,在营养评估的应用中逐步受到重视,为临床诊治及判断疗效提供依据[6]。本研究发现,人体成分指标如体质量、BMI、FMI、FFMI及PA随着放疗时间的变化,呈逐渐下降的趋势,到放疗结束时,各指标达到最低;PG-SGA的评分值在第2周开始急剧上升,第6周达到最高。ONS组与对照组相比,体质量、BMI、FMI、FFMI及PA在同步放化疗期间下降的趋势有所缓和,且在整个放疗期间,上述指标结果试验组均高于对照组,差异无统计学意义(P>0.05)。PG-SGA的评分值,试验组均低于对照组,差异无统计学意义(P>0.05)。但是,当我们将ONS组总摄入量大于2/3计划摄入量的患者与对照组比较发现,人体成分指标FFMI、SM在两组之间差异有统计意义(P=0.028和P=0.040)。这与国外的一些观察性研究相似,放化疗期间体质量丢失是由于FMI和FFMI丢失引起的,说明这些患者在放化疗期间已处于恶病质前期[7]。Sliver等[8]研究显示,放化疗期间FMI丢失达到25%,FFMI丢失达到75%。鼻咽癌患者营养不良是一种普遍现象,不仅仅来自治疗的不良反应,很大程度上源于疾病本身,而这些出现的临床症状无法保证患者在同期放化疗期间摄入正常所需的能量及其他营养素,会进一步加重原有的营养不良,进而影响治疗的耐受性及生活质量[8]。有多项研究证明,密集的强化营养咨询和足量的营养摄入,可改善患者放化疗期间体质量下降及人体成分指标如FFMI的降低[9]。正如本研究所示,若患者ONS摄入量达到原计划的2/3,每日补充摄入量为500~600 kcal时,反应患者营养状况的人体成分指标,如FFMI、SM在两组之间差异有统计学意义(P<0.05)。因此,除了关注如何对鼻咽癌同期放化疗的患者进行营养干预,保证营养摄入量也同样重要。ONS是营养干预的重要措施,对于接受放疗的患者,营养评估后存在有营养不良的,可给予ONS治疗,能有效改善患者的营养状况。对于头颈部、消化道和腹盆腔部位放疗患者选用合适的ONS治疗,可改善患者营养状况,还可减轻放疗引起的不良反应[3]。
FFMI指人体所有的无脂组织,包括骨骼肌和水分;SM指骨骼肌量,低SM肿瘤患者在化疗过程中更易出现药物聚集及不良反应[10-11]。在本研究中,ONS大于2/3的患者与对照组相比,人体成分指标FFMI和SM在放疗期间下降的趋势较缓和,而且这两个指标的结果ONS组明显好于对照组,但体质量及BMI在两组之间差异无统计学意义。目前,全球还没有统一的诊断营养不良的标准。2015年,ESPEN声明了一项专家共识,提出了营养不良诊断的3个选择[12]。本研究小组之前的一项观察研究发现,鼻咽癌患者采用非意向性体质量下降+低FFMI评判标准检出营养不良发生率与PG-SGA的检出率更为一致。提示FFMI和SM较体质量下降和BMI更敏感。
放化疗期间的体质量丢失常伴随着FFM、SM和BCM的丢失,QOL的下降,不良反应的增加及生存时间的缩短[13-14]。Ravasco等[15]的研究也表明,对头颈部肿瘤患者进行积极的营养干预,有利于提高患者的QOL。本研究显示,在同步放化疗期间,生活质量各项评分,总体健康状况、恶心与呕吐、疼痛、腹泻、便秘及食欲丧失,ONS组均好于对照组,差异无统计学意义(P>0.05)。在放疗期间,以上各项指标的平均变化值,ONS组均小于对照组。良好的营养状况可以减轻患者的急性放疗反应,而较轻的放疗反应可增加患者的能量摄入,从而改善营养状况,一定程度上提高患者的生活质量。虽然在本项研究中,QOL在两组之间差异无统计学意义(P>0.05),但是我们在本项研究中看到营养干预及良好的营养状况对于鼻咽癌同期放化疗的患者有实质性的健康获益,因此,为了进一步验证此假设,我们将会在后续扩大样本量进行研究。
本研究对所有研究对象进行每周1次的营养咨询及营养监测,期间共进行营养咨询及检测288次,但因为患者依从性的不同,有些患者并未完成所有的检测项目,为得到更加有效的结论,需要后期增加样本量再进一步研究。
综上所述,鼻咽癌患者在同步放化疗期间营养状况有不同程度的下降,营养不良程度在放疗结束时达到最高。及时给予个体化的营养咨询和口服营养补充可在一定程度上缓解营养不良的进一步下降,但可能因为样本量的原因两组变化趋势差异无统计学意义,需要在今后增加样本量作进一步研究;对于口服营养补充改善鼻咽癌同期放化疗患者的生活质量及提高放化疗的依从性需要在日后的随访及研究中进行验证。
[1] HONG J S, WU L H, SU L, et al. Effect of chemoradiotherapy on nutrition status of patients with nasopharyngeal cancer[J]. Nutr Cancer, 2016, 68(1): 63-69.
[2] LI G, GAO J, LIU Z G, et al. Influence of pretreatment ideal body weight percentile and albumin on prognosis of nasopharyngeal carcinoma: long-term outcomes of 512 patients from a single institution [J]. Head Neck, 2014,36(5): 660-666.
[3] LANGIUS J A, ZANDBERGEN M C, EERENSTEIN S E,et al. Effect of nutritional interventions on nutritional status,quality of life and mortality in patients with head and neck cancer receiving (chemo) radiotherapy: a systematic review[J]. Clin Nutr, 2013, 32(5): 671-678.
[4] ARENDS J, BODOKY G, BOZZETTI F, et al. ESPEN guidelines on enteral nutrition: non-surgical oncology [J].Clin Nutr, 2006, 25(2): 245-259.
[5] ALSHADWI A, NADERSHAH M, CARLSON E R, et al.Nutritional considerations for head and neck cancer patients:a review of the literature [J]. J Oral Maxillofac Surg, 2013,71(11): 1853-1860.
[6] MULASI U, VOCK D M, KUCHNIA A J, et al. Malnutrition Identified by the Academy of Nutrition and Dietetics and American society for parenteral and enteral nutrition consensus criteria and other bedside tools is highly prevalent in a sample of individuals undergoing treatment for head and neck cancer [J]. JPEN J Parenter Enteral Nutr, 2016.[Epub ahead of print]
[7] DE CARVALHO T M, MIQUEL MARIN D, DA SILVA C A, et al. Evaluation of patients with head and neck cancer performing standard treatment in relation to body composition,resting metaboLnc rate, and inflammatory cytokines [J].Head Neck, 2015, 37(1): 97-102.
[8] SILVER H J, DIETRICH M S, MURPHY B A. Changes in body mass, energy balance, physical function, and inflammatory state in patients with locally advanced head and neck cancer treated with concurrent chemoradiation after low-dose induction chemotherapy [J]. Head Neck, 2007,29(10): 893-900.
[9] WLADYSIUK M S, MLAK R, MORSHED K, et al.Bioelectrical impedance phase angle as a prognostic indicator of survival in head-and-neck cancer [J]. Curr Oncol,2016, 23(5): 481-487.
[10] MEZA-JUNCO J,MONTANO-LOZA A J, BARACOS V E,et al. Sarcopenia as a prognostic index of nutritional status in concurrent cirrhosis and hepatocellular carcinoma [J]. J Clin Gastroenterol, 2013, 47(10): 861-870.
[11] MASSICOTT M H, BORGET I, BROUTIN S, et al. Body composition variation and impact of low skeletal muscle mass in patients with advanced medullary thyroid carcinoma treated with vandetanib: results from a placebo-controlled study[J]. J Clin Endocrinol Metab, 2013, 98(6): 2401-2408.
[12] CEDERHOLM T, BOSAEUS I, BARAZZONI R, et al.Diagnostic criteria for malnutrition-an ESPEN consensus statement [J]. Clin Nutr, 2015, 34(3): 335-340.
[13] MEYER F,FORTIN A, Wang C S, et al. Predictors of severe acute and late toxicities in patients with localized head-andneck cancer treated with radiation therapy [J]. Int J Radiat Oncol Biol Phys, 2012, 82(4): 1454-1462.
[14] LANGIUS J A, KRUIZENGA H M, UITDEHAAG B M, et al.Resting energy expenditure in head and neck cancer patients before and during radiotherapy [J]. Clin Nutr, 2012, 31(4):549-554.
[15] RAVASCO P, MONTEIRO-GRILO I, MARQUES VIDAL P,et al. Impact of nutrition on outcome: a prospective randomized controlled trial in patients with head and neck cancer undergoing radiotherapy [J]. Head Neck, 2005, 27(8): 659-668.
