miR-16对人肝癌细胞BEL-7402增殖与凋亡的影响
2018-03-01李晓敏贾筱琴李国利
缪 欣,丁 岚,刘 浩,李晓敏,徐 聪,贾筱琴,李国利
1.扬州大学医学院病理学教研室,江苏 扬州 225009;
2.扬州市江都人民医院病理科,江苏 扬州225000
微小RNA(microRNA,miRNA)长度一般为18~25个核苷酸,广泛存在于真核生物中,属于高度保守与非编码的小分子单链RNA的一种。miRNA具有癌基因和抑癌基因的作用,直接或间接参与肝癌的发生、发展。成熟的miR-16来源于两个不同的前体miR-16-1和miR-16-2。miR-16-1位于人类基因组脆弱点11q24,同时也是秀丽线虫lin-4的同源基因,在人类卵巢癌、子宫癌、乳腺癌和肺癌患者体内均可发现此位点基因的缺失突变。课题组前期研究应用miRNA芯片技术筛选出肝癌组织差异表达miRNA,发现miR-16在肝癌组织中表达下调。推测出现miR-16表达的下调可能与肿瘤细胞的快速增殖有关。本实验初步探讨miR-16对BEL-7402肝癌细胞的增殖及凋亡的影响。
1 材料和方法
1.1 材料
人BEL-7402肝癌细胞及293T细胞购自上海酶研生物科技有限公司;RPMI-1640及DMEM购自美国Gibco公司,胎牛血清购自杭州四季青生物工程材料有限公司,凋亡试剂盒购自美国eBioscience公司;倒置荧光显微镜购自日本Olympus公司;流式细胞仪购自美国BD公司。
1.2 方法
1.2.1 细胞培养
配制含10%胎牛血清、100 U/mL青霉素和0.1 mg/mL链霉素的RPMI-1640完全培养基,接种人BEL-7402肝癌细胞株,置于37 ℃、CO2体积分数为5%的饱和湿度培养箱中培养,细胞贴壁生长,0.25%胰酶消化传代。
1.2.2 过表达miR-16慢病毒稳定细胞株的建立
将慢病毒载体质粒(LV-hsa-miR-16-1)和包装质粒混合物(Lenti-Easy Packaging Mix)混合,在混合后的物质中加入脂质体(LipofectamineTM2000),形成脂质体复合物(DNA-LipofectamineTM2000复合物),加入293T细胞(要求293T细胞的细胞密度在80%左右,并处于对数生长期、已进行共转染),将集中的细胞混匀,置于37 ℃、CO2体积分数为5%的培养箱中进行细胞培养。转染8 h后,将培养液更换为DMEM细胞培养基(含胎牛血清10%),培养48~72 h后,收集慢病毒颗粒的细胞上清液,将搜集到的上清液进行浓缩与纯化处理,可得到滴度与纯度均较高的慢病毒浓缩液,转染293T细胞后进行病毒滴度测定。
1.2.3 慢病毒感染人BEL-7402肝癌细胞
感染前24 h,取对数生长期的BEL-7402肝癌细胞,胰酶消化制成细胞悬液,计数调整细胞的浓度,置于37 ℃、CO2体积分数为5%的培养箱中培养,待细胞融合度达到30%左右时停止。根据BEL-7402肝癌细胞的MOI值,加入适量的浓缩病毒液,感染16 h后,更换培养基;感染96 h后,采用倒置荧光显微镜观察绿色荧光的强度,检测慢病毒颗粒的感染效率。
1.2.4 采用细胞计数试剂盒(cell counting kit-8,CCK-8)检测细胞增殖
选择对数生长期的细胞,胰酶消化后培养基重悬制成细胞悬液。使用血球计数板计数细胞,以每孔2 000个细胞的标准,于96孔板中进行细胞接种。实验分为miR-16感染组和阴性对照组,每组5个复孔,每孔100 μL,置于37 ℃、CO2体积分数为5%的培养箱中培养。分别培养0、1、2、3、4和5 d后,每孔加入10 μL CCK-8,2~4 h后,振荡器振荡5~10 min,酶标仪450 nm进行吸光度(D)值检测,以各时间点的D值为依据,绘制出详细的细胞生长曲线图。
1.2.5 流式细胞术检测细胞周期
确保细胞还未进入生长平台期时,选择生长覆盖率在80%左右的细胞进行试验,收集转染48 h的人BEL-7402肝癌细胞,PBS洗涤,细胞浓度调整为1×106/mL,使用70%的乙醇进行固定,加入36 μL的PI(2 mg/mL)、14.5 μL的RNase(10 mg/mL)及1 450 μL的PBS重悬,室温避光温育10 min,流式细胞仪检测细胞周期。
1.2.6 流式细胞术检测细胞凋亡
收集人BEL-7402肝癌细胞,将细胞浓度调整为1×106/mL,加入10 μL的annexin V-PE进行细胞染色,室温避光10~15 min,流式细胞仪检测细胞凋亡。
1.3 统计学处理
应用SPSS 17.0软件对本次研究中的数据进行处理和统计,实验数据为计量资料,用x±s表示,采用t检验对组间差别进行检验。P<0.05为差异有统计学意义。
2 结 果
2.1 过表达miR-16慢病毒稳定细胞株
目的质粒转染293T细胞荧光显微镜观察结果见图1。过表达miR-16慢病毒BEL-7402肝癌细胞稳定株荧光显微镜下观察结果见图2。
2.2 感染miR-16慢病毒对BEL-7402肝癌细胞增殖能力的影响
miR-16慢病毒对BEL-7402肝癌细胞感染后,采用CCK-8检测细胞的生长情况,根据细胞的生长状况,绘制细胞增殖曲线图(图3)。结果显示,感染组在2 d前差异无统计学意义(P>0.05),而在2~5 d差异有统计学意义(P<0.05)。表明感染miR-16慢病毒后,BEL-7402肝癌细胞的增殖能力明显降低。

图 1 目的质粒转染293T细胞Fig. 1 The target plasmid was transfected into 293T cells

图 2 过表达miR-16慢病毒稳定细胞株Fig. 2 Over-expression of miR-16 lentivirus stable cell lines
2.3 感染miR-16慢病毒对BEL-7402肝癌细胞周期的影响
BEL-7402肝癌细胞感染miR-16慢病毒,流式细胞术检测细胞周期(图4)。与阴性对照组相比,BEL-7402细胞周期的G1期细胞百分率下降,S及G2/M细胞的百分率数值上升,差异有统计学意义(P<0.05),证明miR-16可使BEL-7402肝癌细胞部分停滞于S及G2/M期,延缓了细胞分裂的速度,抑制了细胞增殖。
2.4 感染miR-16慢病毒对Bel-7402肝癌细胞凋亡的影响
人BEL-7402肝癌细胞感染miR-16慢病毒后,采用流式细胞仪对两组细胞凋亡率进行检测,差异有统计学意义(P<0.05,图5、6),证明miR-16对7402肝癌细胞的凋亡有较为明显的作用和影响。

图 3 过表达miR-16慢病毒对BEL-7402肝癌细胞增殖能力的影响Fig. 3 Effects of over-expression of miR-16 lentivirus on the proliferation of BEL-7402 hepatocarcinoma cells
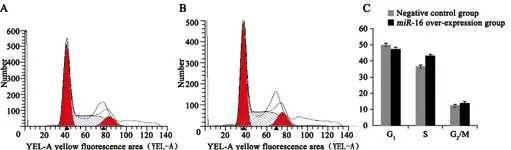
图 4 过表达miR-16对Bel-7402肝癌细胞周期影响Fig. 4 Overexpression of miR-16 on cell cycle of BEL-7402 hepatocarcinoma cells
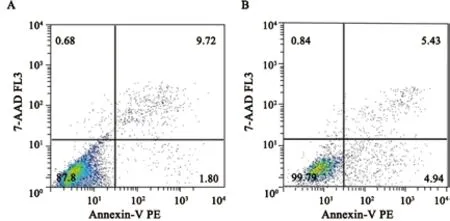
图 5 流式细胞术检测两组细胞凋亡情况Fig.5 Detect the apoptosis of the two groups by fl ow cytometry
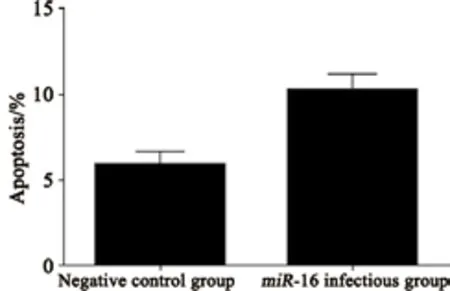
图 6 过表达miR-16对BEL-7402肝癌细胞凋亡的影响Fig. 6 Effects of over-expression of miR-16 on apoptosis of BEL-7402 hepatocarcinoma cells
3 讨 论
肝癌对于人类的生存健康有着极大的威胁,属于病死率较高的恶性肿瘤。据统计,近年来我国死于肝癌的患者逐渐增多,年平均值已达到30万左右,占全球肝癌死亡人数的50%左右,肝癌的高死亡率为我国医学界造成了极大的难题和负担[1-4]。肝癌治疗研究虽然已深入至基因水平,但目前仍没有找出对治疗有效且具有特异性的分子靶点。
miRNA目前多数存在于真核生物中,属于高度保守及非编码的小分子单链RNA的一种。miR-16/miR-15a主要靶向抑制Bcl-2、WT-1、WNT3A、MCA1、MCL1及CCDN1等致癌基因的活性,进而促进肿瘤细胞的凋亡[5]。miR-16最早被发现在白血病中表达下调[7],miR-16在肝癌、胃癌、垂体腺瘤、肺癌、前列腺癌和多发性骨髓瘤中表达均下调[8]。近年来研究发现,miR-16/miR-15a亦可靶向抑制血管内皮生长因子的分泌而发挥抗肿瘤活性[6]。
本研究表明,相对于阴性对照组,BEL-7402细胞周期中G1期细胞百分率下降,S及G2/M期细胞的百分率上升,表明miR-16可使BEL-7402肝癌细胞部分停滞于S及G2/M期,从而延缓细胞分裂的速度。因此,进一步证实了miR-16抑制癌细胞的机制之一是通过影响细胞周期从而抑制细胞的增殖。
有研究报道,miR-16负调控Bcl-2,miR-16的缺失或下调,导致Bcl-2表达的升高,促进白血病、淋巴瘤和前列腺癌的发生。进一步研究发现,miR-16通过激活外源性APAF-1-胱天蛋白酶-9-PARP凋亡途径,参与凋亡过程[11]。本研究初步证实,miR-16能抑制肝癌Bel-7402细胞增殖及促进细胞凋亡,而miR-16介导肝癌细胞增殖和调节细胞凋亡的分子机制,仍需后续实验进一步探讨。
综上,本研究发现,miR-16过表达能抑制肝癌BEL-7402细胞增殖及促进细胞凋亡,提示miR-16有望成为肝癌基因治疗重要的新靶点。相信随着研究的深入,miR-16在癌症治疗方面的应用价值将逐渐展现出来。
[1] PARK J A, LEE K Y, OH Y J, et al. Activation of caspase-3 protease via a Bcl-2 insensitive pathway during the process of ginsenoside Rh2-inducedapoptosis[J]. Cancer Lett, 1997,121(1): 73.
[2] NAKATA H, KIKUCHI Y, TODE T, et al. Shinomiya inhibitory effects of ginsenoside Rh2 on tumor growth in nude mice bearing human ovarian cancer cells[J]. J Cancer Res,1998, 89(7): 733.
[3] ZENG X L, TU Z G. In vitro induction of differentiation by ginsenoside Rh2 in SMMC-7721 hepatocarcinoma cell line[J]. Pharmacol Toxicol, 2003, 93(6): 275.
[4] OH M, CHOI Y H, CHOI S, et al. Anti-proliferating effects of ginsenoside Rh2 on MCF-7 human breast cancer cells[J].Int J Oncol, 1999, 14(5): 869-875.
[5] PEKARSKY Y, CROCE C M. Role of miR-15/16 in CLL[J]. Cell Death Differ. 2015, 22(1): 6-11.
[6] TUNG Y T, HUANG P W, CHOU Y C, et al. Lung tumorigenesis induced by human vascular endothelial growth factor (hVEGF)-A165 overexpression in transgenic mice and amelioration of tumor formation by miR-16 [J]. Oncotarget,2015, 6(12): 10222-10238.
[7] DAL BO M, ROSSI F M, ROSSI D, et al. 13q14 deletion size and number of deleted cells both influence prognosis in chronic lymphocytic leukemia[J]. Genes Chromosomes Cancer, 2011, 50(8): 633-643.
[8] CIMMINO A, CALIN G A, FABBRI M, et al. miR-15 and miR-16 induce apoptosis by targeting BCL2[J]. Proc Natl Acad Sci U S A, 2005, 102(39): 13944-13949.
[9] STELLER H. Mechanisms and genes of celluar suicide[J].Science, 1995, 267(5203): 1445.
[10] RONINSON I B. Tumor senescence as a determinant of drug response in vivo[J]. Drug Resist Updat, 2002, 5(5): 204-208.
[11] ZHANG X, WAN G, MLOTSHWA S, et al. Oncogenic Wip1 phosphatase is inhibited by miR-16 in the DNA damage signaling pathway[J]. Cancer Res, 2010, 70(18): 7176-7186.
