基于网络药理学的“黄芩苷-栀子”作用机制研究Δ
2018-03-01吴嘉瑞蔺梦娟刘鑫馗
吴嘉瑞,蔺梦娟,刘鑫馗
(北京中医药大学中药学院,北京 100102)
清开灵注射液是在古方“安宫牛黄丸”的基础上研制而成的中药注射剂,具有清热解毒、化痰通络和醒神开窍之功效,尤其在脑血管疾病、上呼吸道感染、肝炎和高热等方面具有良好的临床疗效,其已进入国家基本药品目录,是首批全国中医院急诊科(室)必备中成药之一。“黄芩苷-栀子”为清开灵注射液中的重要药物组合。黄芩、栀子均为清热药中的代表药,黄芩性味苦寒,功效清热燥湿、泻火解毒,能泻胆、肺之实火,兼除湿热,其主要有效成分为黄芩苷。现代药理学研究结果表明,黄芩具有抗菌、抗病毒、抗炎、抗肿瘤、抗过敏和抗氧化等生物活性,其应用前景极其广阔[1]。黄芩苷为黄芩根中的黄酮类化合物,具有抑菌、利尿、抗炎、抗变态、解痉和抗肿瘤等多种生理活性[2],清开灵注射液中黄芩苷代表其原方安宫牛黄丸中的黄芩。栀子苦寒清降,泻三焦火邪而导热下行、泻心火而除烦,兼清利肝胆湿热、凉血解毒[3-4]。现代药理学研究结果表明,栀子具有抗炎、解热、镇痛、保肝、利胆、降血脂、抗血栓、神经保护和抗阿尔茨海默病等作用[5]。以往多采用动物实验、细胞实验等方法对中药某一作用机制进行研究,难以获得中药作用机制网络的整体面貌。近年来,网络药理学融合系统生物学、多向药理学、生物信息学、计算机科学等多学科的技术和内容,进行“疾病表型-基因-靶点-药物”等多层次网络的构建,探索药物与疾病间的关联性,指导新药研发,阐明药物作用机理,其整体性、系统性及复杂性的研究视角和研究方法,与中医药的特点不谋而合[6]。因此,本研究基于网络药理学方法,通过构建“黄芩苷-栀子”的“药物-成分-靶标-疾病”多层次生物网络,结合基因功能注释和京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析,开展“黄芩苷-栀子”的作用机制研究。
1 资料与方法
1.1 药物分子信息的收集和活性分子的筛选
通过检索中药系统药理学数据库和分析平台(traditional Chinese medicine systems pharmacology database and analysis platform,TCMSP)获得黄芩苷和栀子的分子信息,包括分子名称、InChI Key、相对分子质量(molecular weight,WM)、辛醇-水分配系数(ALogP)、氢键配位电子供体数目(Hdon)、氢键配位电子受体数目(Hacc)、可旋转键数目(RBN)、分子极性表面积(TPSA)、类药性(drug-likeness,DL)、血-脑脊液屏障(blood brain barrier,BBB)、半衰期(half life,HL,t1/2)和分子结构。其中,考虑到含糖基的化合物在体内可能通过糖苷酶水解作用被去糖基,TCMSP数据库中也收录了这些化合物的糖苷配基,并将其命名为“化合物_qt”,因此,所获得栀子的药物分子中可能也包括这些化合物的糖苷配基[7]。中药成分复杂,经过制剂工艺和体内过程,并非所有成分均能进入体内发挥药效;考虑中药注射剂的剂型特点,结合对药物体内过程(ADME)相关性质的预测,筛选可能功效物质和活性分子。在TCMSP平台中,设置参数ALogP<5和DL≥0.18作为栀子中活性成分的筛选条件。
1.2 分子互作靶标和疾病信息的收集以及靶标相应基因的获取
检索TCMSP数据库获得黄芩苷的作用靶标、栀子所预测活性分子的靶标,根据所获靶标,进一步检索TCMSP数据库获得靶标相关的疾病。靶标相应基因通过Uniprot(http://www.uniprot.org/)获取,检索Uniprot中的UniprotKB数据库,检索式为“organism:‘homo sapiens’ AND reviewed:yes”。将检索结果以Excel格式导出,即获得UniprotKB/Swiss-Prot数据库中人类的相关靶蛋白及其对应基因的记录。利用Excel软件的“VLOOKUP”函数匹配所获得靶标对应的基因信息。非蛋白质的靶标或其他致病菌中的靶标,通过检索NCBI(https://www.ncbi.nlm.nih.gov/)或者利用多种搜索引擎检索获得。
1.3 网络构建与网络分析
将“黄芩苷-栀子”的药物、成分、作用靶标和相关疾病导入Cytoscape 3.4.0软件(http://www.cytoscape.org/)构建其“药物-成分-靶标-疾病”网络,利用Cytoscape 3.4.0软件的Network Analyzer工具计算网络拓扑参数,包括度值(Degree)、介数(betweenness centrality,BC)等[7-9]。在生物网络中,Degree指一个节点与其他节点相连的边的数目[10];BC指网络所用的最短路径中经过当前节点的数目,反映节点在特定网络拓扑结构中所处位置的枢纽程度[11]。利用节点Degree及BC排序确定网络关键节点是目前网络分析的主要策略之一[10]。因此,本研究采用该网络分析方法,确定关键节点,探讨“黄芩苷-栀子”的主要作用靶标、主治疾病及其作用机制。
1.4 基因本体(gene ontology,GO)分类富集分析
GO是主要为了统一表征所有物种的基因及基因产物的性质而发起的生物信息学计划[12]。GO数据库(www.geneontology.org)旨在建立一套适用于所用物种的、对基因和蛋白质功能进行限定和描述的、并能随着研究不断深入而更新的语义词汇标准。GO有3个分类:(1)细胞组分(cell component,CC),指基因产物位于何种细胞器或基因产物组中(如糙面内质网、核或核糖体和蛋白酶体等),表明基因产物在什么地方起作用;(2)分子功能(molecular function,MF),描述基因产物在分子生物学上的活性,如催化活性或结合活性;(3)生物学过程(biological process,BP),指由分子功能有序组成的,具有多个步骤的一个过程。GO的结构是个有向无环图,每个语义多在自己的类别中与其他语义相关联,有时会与其他类别的语义相关联;语义之间的关系为“is a”或“part of”。利用Cytoscape 3.4.0软件Apps中的BiNGO 3.0.3对“黄芩苷-栀子”对应的基因分别进行GO分类富集分析[13-14]。BiNGO Settings面板的参数设置如下:簇名分别命名为“DZ-MF”“DZ-BP”和“DZ-CC”;选择“paste genes from text”,将基因名称复制粘贴到输入框中,每个基因单独占一行;输出内容和方式依次选择“overrepresentation”“visualization”和“overrepresented categories after correction”,参照集合选择“use whole annotation as reference set”,物种选择“Homo Sapiens”,以Cytoscape层次网络图形式输出该基因集合相较于人类基因组比例更高的GO分类注释;选择“Hypergeometric test”的统计方法和“Benjamini & Hochberg False Discovery Rate(FDR)correction”的P校正法,设置显著性水平为P<0.01;分别选择“GO_Molecular_Function”“GO_Cellular_Component”和“GO_Biological_Process”进行GO-MF、GO-CC和GO-BP的富集分析。
1.5 KEGG通路富集分析
利用DAVID 6.8数据库(the Database for Annotation,Visualization and Integrated Discovery,https://david.ncifcrf.gov/)进行通路富集分析[15]。在DAVID的基因列表通用管理面板中复制粘贴基因列表,选择基因名称对应的基因标示符“OFFICIAL_GENE_SYMBOL”,提交基因列表;为所提交的基因列表选择对应的物种“Homo Sapiens”,背景也选择“Homo Sapiens”,即以人类全基因组为背景基因和参照集合。选择分析工具“Functional Annotation Tool”,采用默认的阈值EASE=0.1 and Count=2(EASE Score的阈值指最大P,Count的阈值指与某一通路相关的基因数目的最小值,统计检验基于modified Fisher Exact法),可获得通路富集结果,点击链接可以查看KEGG数据库(http://www.genome.jp/kegg/pathway.html)中对应的通路图及其详情。
2 结果
2.1 化学成分分子信息分析
“黄芩苷-栀子”共筛选出20个药物分子,主要包括环烯醚萜苷类、黄酮类和绿原酸类化合物。其中,10个(50.0%)分子符合“Lipinski’s rule of five”;5个分子的BBB>-0.3且TPSA<90Å2,分别为异前胡醚(C0041)、番红花酸(C0077)、伞房花耳草素(C0024)、欧前胡素(C0073)和白杨素(C0090),提示这5个分子可能具有一定的BBB穿透性。利用SPSS 20软件统计“黄芩苷-栀子”20个药物分子的分子信息的最小值、最大值、均值和标准差,结果显示,20个药物分子的均值符合“Lipinski’s rule of five”,且DL≥0.18,说明20个药物分子总体具有较好的DL,见表1。
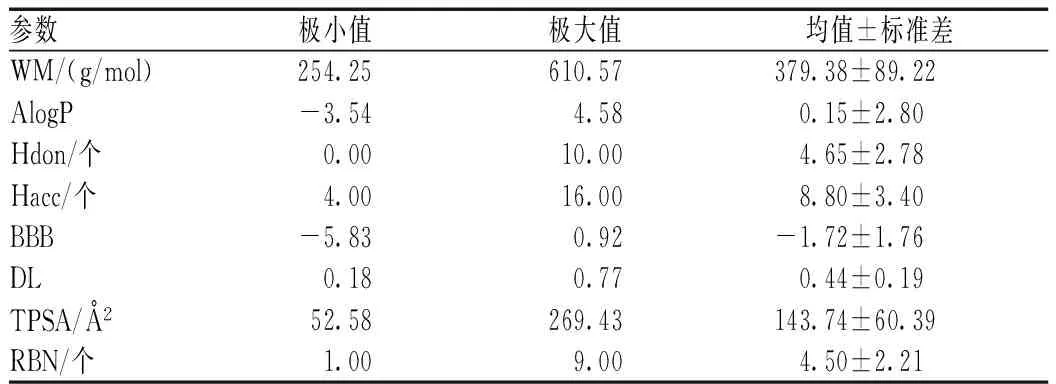
表1 “黄芩苷-栀子”20个药物分子的分子信息统计结果 Tab 1 Statistical results of information of the 20 drug molecules of “baicalin-gardenia”
2.2 “药物-成分-靶标-疾病”网络分析
“黄芩苷-栀子”的“药物-分子-靶标-疾病”网络见图1,该网络图含有589个节点(2个药物,20种成分,198个靶标,369种疾病)和927条连线,节点大小、节点名称字号大小与Degree呈正相关,连线粗细与Edge Betweenness呈正相关。其节点Degree分布和最短路径长度分布见图2;采用Degree和BC排序确定关键节点,网络中Degree≥10的成分、靶标和Degree≥5疾病节点见表2。由图1、表2可见,在“黄芩苷-栀子”网络中:(1)Degree≥10的化合物分子为槲皮素、山柰酚、芦丁、白杨素、伞房花耳草素、番红花酸、3-甲基山柰酚、丁香脂素,其中,槲皮素和山柰酚的Degree分别为151和62,远高于其他化合物节点。(2)Degree≥10的靶标分别为前列腺素内环氧酶2(prostaglandin G/H synthase 2,COX-2)、过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor gamma,PPARγ)、5-脂氧合酶(arachidonate 5-lipoxygenase,5-LOX)、凝血酶原、肝药酶CYP1A2、肿瘤坏死因子(tumor necrosis factor,TNF)、热休克蛋白90α、β2肾上腺素能受体、表皮生长因子受体(epidermal growth factor receptor,EGFR)、谷胱甘肽S-转移酶P(glutathione S-transferase P,GSTP1-1)、内皮型一氧化氮合酶3、丝裂原活化蛋白激酶14(mitogen-activated protein kinase 14,MAPK-14)、白细胞介素6(interleukin-6,IL-6)、雄激素受体、细胞周期蛋白依赖性激酶2、DNA拓扑异构酶2α、72 kDa的Ⅳ型胶原酶(72 kDa type Ⅳ collagenase,MMP-2)、凝血因子X、二肽基肽酶4(dipeptidyl peptidase 4,DPP-4)、雌激素受体、间质胶原酶(interstitial collagenase,MMP-1)、毒蕈碱型乙酰胆碱受体M2、磷脂酰肌醇-4,5-二磷酸-3-激酶催化亚基γ亚型(phosphatidylinositol 4,5-bisphosphate 3-kinase catalytic subunit gamma isoform,PI3K-γ)、碳酸酐酶2(carbonic anhydrase 2,CA-Ⅱ)。其中,COX-2、PPARγ和5-LOX的Degree分别为41、30和29,相对较高。(3)Degree≥5的疾病包括乳腺癌、结直肠癌、前列腺癌、非小细胞肺癌及肺癌等肿瘤和非胰岛素依赖性糖尿病、心血管疾病、阿尔茨海默症、骨关节炎及哮喘等。结合已有的研究证据,黄芩苷和栀子苷为清开灵注射液的主要成分[6],应进行重点分析。在图1中,黄芩苷(C0045)和栀子苷(C0040)共涉及10个靶标和18种疾病,主要靶标包括凝血因子X、CA-Ⅱ、细胞凋亡调节因子、蛋白质酪氨酸磷酸酯酶(mRNA of protein-tyrosine phosphatase, non-receptor type 1,PTP-1B)、血红素氧化酶-1(heme oxygenase 1,HO-1)、谷胱甘肽转移酶1(glutathioneS-transferaseMu 1,GSTM1-1)和谷胱甘肽转移酶2(gGlutathioneS-transferaseMu 2,GSTM2-2),主要疾病包括心血管疾病、胰腺癌、非胰岛素依赖性糖尿病、肥胖、血栓性疾病和凝血障碍等,见表3。

图1 “黄芩苷-栀子”的“药物-成分-靶标-疾病”网络 Fig 1 “Drug-composition-target-disease” network of “baicalin-gardenia”
2.3 GO分类富集分析
通过BiNGO获得了“黄芩苷-栀子”的基因集合中194个基因的分子功能注释信息,195个基因的细胞组分注释信息,192个基因的生物学过程注释信息。进一步对以上基因注释信息进行分类富集分析:(1)GO-MF获得143条富集结果,其层次网络见图3(节点大小代表基因数量多少,颜色深浅代表P大小),主要涉及蛋白结合、酶结合、受体结合、受体结合、蛋白二聚化活性、序列特异性DNA结合、激酶活性、氧化还原酶活性、分子传感器活性、信号传导活性和转录因子活性等方面;(2)GO-CC获得62条富集结果,其层次网络见图4(节点大小代表基因数量多少,颜色深浅代表P大小),主要涉及细胞外间隙、细胞外区域、细胞碎片、细胞质基质、细胞膜、蛋白复合物、大分子复合物和细胞器内腔等方面;(3)GO-BP获得1 209条富集结果,其层次网络过于复杂庞大,未在文中表示,仅列出其中P<0.01且基因数量百分比≥10.0%的前20条注释信息,主要涉及化学刺激响应、压力响应、内源性刺激响应、生物过程正/负调控、细胞过程正调控、细胞增殖调控、细胞凋亡调控、细胞程序性死亡调控和发育过程调控等方面,见表4。
2.4 KEGG通路富集分析
利用DAVID数据库对“黄芩苷-栀子”的基因集合进行KEGG通路富集分析,阈值参数设置为EASE=0.05,Count=5,共获得130条富集结果,列出EASE<0.05,Count≥10,FDR<0.01的前20条通路,包括TNF信号通路、HIF-1信号通路等2条信号通路和18条疾病通路,见表5。18条疾病通路中,涉及10条恶性肿瘤通路,分别为恶性肿瘤通路、前列腺癌、膀胱癌、胰腺癌、神经胶质瘤、非小细胞肺癌、小细胞肺癌、慢性粒细胞白血病、结直肠癌和恶性肿瘤蛋白多糖;涉及8条感染性疾病通路,分别为乙型肝炎、美洲锥虫病、利什曼病、百日咳、弓形虫病、人类T淋巴细胞白血病病毒Ⅰ型感染、肺结核和甲型流行性感冒。

a.节点Degree分布;b.最短路径长度分布 a.distribution of values of node degrees;b.distribution of lengths of the shortest paths图2 “黄芩苷-栀子”的“药物-成分-靶标-疾病”网络性质分析 Fig 2 Properties analysis of “drug-composition-target-disease” network of “baicalin-gardenia”

节点名称DegreeBCC0086槲皮素1510.6239C0048山柰酚620.1695C0024伞房花耳草素270.0793C0044芦丁220.0438C0090白杨素200.0464C0077番红花酸150.0443C01003-甲基山柰酚120.0203C0056丁香脂素100.0057C0040栀子苷90.0117C0073欧前胡素90.0032T0998前列腺素G/H合成酶2410.1042T0922PPARγ300.0598T01545-LOX290.0749T1024凝血酶原180.0389T0356肝药酶CYP1A2180.0380T1218TNF180.0371T0582热休克蛋白90α180.0354T0202β2肾上腺素能受体170.0387T0430EGFR170.0350T0545GSTP1-1160.0391T0851内皮型一氧化氮合酶3160.0387T0762MAPK-14150.0187T0655IL-6140.0354T0120雄激素受体140.0338T0342细胞周期蛋白依赖性激酶2140.0310T0391DNA拓扑异构酶2α140.0295T0036MMP-2140.0151T0310凝血因子X130.0222T0385DPP-4130.0196T0441雌激素受体130.0192T0657MMP-1120.0171T0783毒蕈碱型乙酰胆碱受体M2110.0206T0934PI3K-γ100.0148T0239CA-Ⅱ100.0050D0247非特异性恶性肿瘤170.0240D0175阿尔茨海默病100.0130D0231乳腺癌90.0089D0259心血管疾病,未指定70.0077D0747胰腺癌70.0062D0792前列腺癌70.0019D0574炎症60.0059D0203哮喘60.0053D0715非小细胞肺癌60.0044D0181镇痛药50.0043D0714非胰岛素依赖型糖尿病50.0026D0735骨关节炎50.0025D0629肺癌50.0010

表3 黄芩苷和栀子苷及其靶标、疾病的网络参数(靶标和疾病Degree≥3) Tab 3 Network parameters of baicalin, geniposide and their targets and diseases(degree of targets and diseases ≥3)
3 讨论
为了从系统层面研究“黄芩苷-栀子”的作用机制,本研究构建了“黄芩苷-栀子”的“药物-成分-靶标-疾病”网络,从整体角度体现出了“黄芩苷-栀子”多成分、多靶标和多途径的治疗机制。进一步通过网络拓扑学分析,发现该网络同样具备部分无标度和小世界的网络特性,说明网络中存在关键节点。以节点Degree和BC排序,结果显示,化合物分子槲皮素、山柰酚,靶标COX-2、PPARγ和5-LOX,疾病乳腺癌、结直肠癌、前列腺癌、非小细胞肺癌及肺癌等肿瘤疾病和非胰岛素依赖性糖尿病、心血管疾病、阿尔茨海默症、骨关节炎及哮喘等可能为关键节点。另外,结合已有研究成果,黄芩苷和栀子苷为清开灵注射液主要成分,将两者纳入重点分析。
通过“黄芩苷-栀子”的“药物-成分-靶标-疾病”网络可见,槲皮素、山柰酚、黄芩苷和栀子苷均对多个靶标具有调控作用。其中,槲皮素和山柰酚均作用于关键靶标COX-2、PPARγ和5-LOX,推测两者可能在相关疾病的治疗中存在协同作用。槲 皮素和山柰酚均为黄酮类化合物,均具有抗肿瘤、抗氧化、抗炎、抗病原微生物、心血管系统保护、降糖和降脂等多种药理活性[16-17]。山柰酚可抑制大鼠肝癌细胞CBRH 7919,人胃癌MGC-803细胞、人食管鳞癌Eca-109细胞及小细胞肺癌H446细胞等的增值并诱导其凋亡,从而发挥抗肿瘤作用[18-21];槲皮素也可通过诱导肿瘤细胞凋亡、抑制肿瘤细胞的生长及增殖和逆转肿瘤耐多药等途径发挥预防恶性肿瘤、抗恶性肿瘤作用[18]。COX-2为诱导性酶,在促癌剂、炎性因子等刺激下,通 过表达上调,参与炎症和肿瘤的发生与发展[22]; PPARγ是由配体激活的核转录因子,属于Ⅱ型核激素受体超家族成员,其生物学功能复杂,包括调控脂肪和糖代谢、能量平衡,抑制炎症反应,诱导肿瘤细胞分化和凋亡,抑制肿瘤血管生成,抗动脉粥样硬化,降脂降压,改善心功能并参与心室重构等,与肿瘤疾病、心血管疾病和糖尿病等疾病密切相关[23-24];5-LOX是催化花生四烯酸转化为白三烯和氢氧化物5-羟基花生四烯酸的关键酶,主要与过敏性疾病、炎症、肿瘤和脑缺血损伤等疾病相关,研究结果表明,5-LOX抑制剂能抑制多种恶性肿瘤的增殖,并诱导细胞凋亡[25]。说明槲皮素和山柰酚可能通过作用于关键靶标COX-2、PPARγ和5-LOX,在肿瘤、炎症和心血管系统疾病等疾病中发挥治疗作用。由此可见,“黄芩苷-栀子”体现出了清开灵注射液的部分药理活性。

图3 “黄芩苷-栀子”相应基因GO分子功能分类的层次网络 Fig 3 Hierarchical network of GO classified molecular function of “baicalin-gardenia” related genes
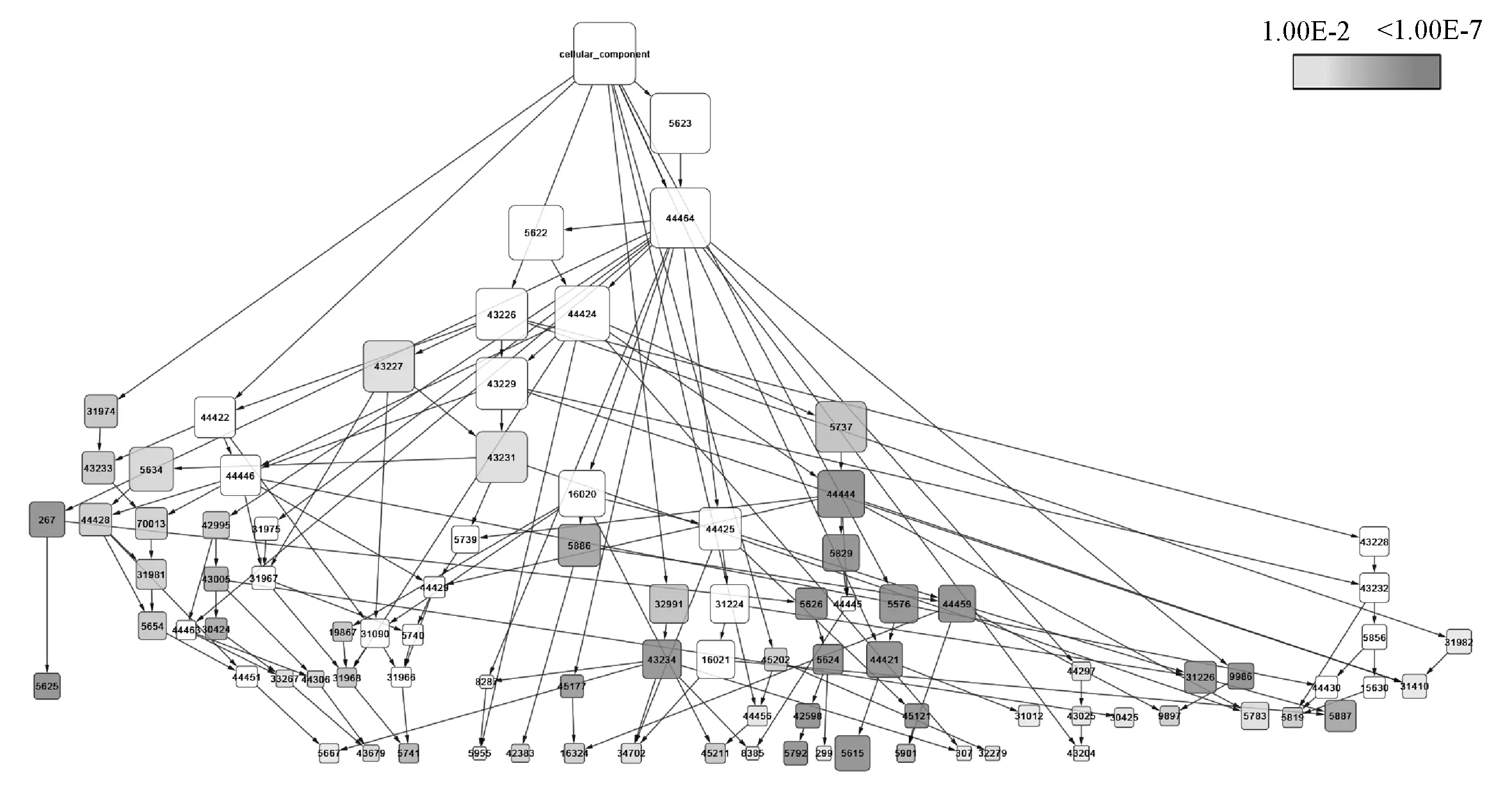
图4 “黄芩苷-栀子”相应基因GO细胞组分分类的层次网络 Fig 4 Hierarchical network of GO classified cellular compositions of “baicalin-gardenia” related genes

GO-IDGO生物学过程注释P校正后P基因数量(n/N)基因42221化学刺激响应4.49×10-591.39×10-55110/192SERPINE1|PLAT|AHR|MPO|TNF等6950压力响应1.88×10-472.90×10-44107/192NCF1|SERPINE1|PLAT|AHR|MPO等48518生物过程正调控1.87×10-461.9×10-43116/192RB1|CHRM3|CHRM1|SERPINE1|AHR等10033有机物响应1.11×10-438.59×10-4177/192CDKN1A|SERPINE1|PTEN|HSPB1|PLAT等50896刺激响应3.55×10-402.19×10-37136/192CHRM2|NCF1|SERPINE1|PLAT|AHR等42127细胞增殖调控2.99×10-381.54×10-3571/192RB1|CDKN1A|CHRM1|CXCL8|SERPINE1等48522细胞过程正调控4.65×10-372.05×10-34101/192RB1|CHRM1|SERPINE1|AHR|ELK1等48519生物过程负调控6.88×10-362.66×10-33100/192RB1|SERPINE1|PLAT|ELK1|MPO等51239多细胞生物过程调控2.20×10-357.54×10-3375/192RB1|CHRM2|ACHE|CHRM3|SERPINE1等42981细胞凋亡调控3.71×10-341.15×10-3167/192TOP2A|GSK3B|CDKN1A|SERPINE1|PTEN等43067细胞程序性死亡调控6.62×10-341.86×10-3167/192TOP2A|GSK3B|CDKN1A|SERPINE1|PTEN等10941细胞死亡调控1.09×10-332.81×10-3167/192TOP2A|GSK3B|CDKN1A|SERPINE1|PTEN等48523细胞过程负调控2.10×10-334.99×10-3193/192RB1|ACHE|GSK3B|CDKN1A|CXCL8等9719内源性刺激响应2.31×10-335.10×10-3153/192CDKN1A|SERPINE1|PTEN|PLAT|ADRA1B等32879定位调控1.70×10-313.50×10-2960/192ACHE|GSK3B|SERPINE1|PTEN|TNF等43066细胞凋亡负调控2.50×10-314.82×10-2946/192GSK3B|CDKN1A|GSTP1|SERPINE1|PTEN等43069细胞程序性死亡负调控4.53×10-318.23×10-2946/192GSK3B|CDKN1A|GSTP1|SERPINE1|PTEN等60548细胞死亡负调控1.15×10-301.98×10-2846/192GSK3B|CDKN1A|GSTP1|SERPINE1|PTEN等48583刺激响应调控6.57×10-301.07×10-2751/192CXCL8|SERPINE1|TNF|ICAM1|THBD等50793发育过程调控1.79×10-292.76×10-2760/192RB1|SERPINE1|ITGB2|PTEN|TNF等
注:FDR为错误发现率
Note:FDR means false discovery rate
GO富集分析结果表明,“黄芩苷-栀子”主要在化学刺激响应、细胞增殖、细胞凋亡及细胞程序性死亡调控等生物学途径中发挥作用。KEGG通路富集分析结果表明,“黄芩苷-栀子”作用的大部分基因富集在与恶性肿瘤有直接关系的通路上,包括恶性肿瘤通路、前列腺癌、膀胱癌、胰腺癌、神经胶质瘤、非小细胞肺癌、小细胞肺癌、慢性粒细胞白血病、结直肠癌和恶性肿瘤蛋白多糖等;另有大部分基因富集在与感染性疾病相关的通路,包括乙型肝炎、美洲锥虫病、利什曼病、百日咳、弓形虫病、人类T淋巴细胞白血病病毒Ⅰ型感染、肺结核和甲型流感等。由此推断,“黄芩苷-栀子”发挥抗菌、抗炎和抗肿瘤等药理活性可能与其作用于多种恶性肿瘤、炎症等相关信号通路密切相关。本研究为“黄芩苷-栀子”发挥多种药理活性的潜在作用机制提供了一定的参考。
[1]吉晓丽.黄芩的化学成分与药理作用研究进展[J].中医临床研究,2017,9(9):128-129.
[2]杨萍.清开灵注射液中黄芩苷和栀子苷的药代动力学研究[D].武汉:湖北中医药大学,2012.
[3]叶任高,傅玉素.实用方剂速记便览[M].北京:人民卫生出版社,2007:229-232.
[4]谢鸣.方剂学[M].3版.北京:人民卫生出版社,2016:213-214.
[5]王亭.中药栀子有效成分及药理作用的研究进展[J].中国药师,2015,18(10):1782-1784.
[6]罗国安,王义明,梁琼麟,等.中医药系统生物学[M].北京:科学出版社,2011:2-8,426-427.
[7]姚瑶.基于系统药理学的中药复方配伍及作用机制研究[D].咸阳:西北农林科技大学,2014.
[8]刘惠.基于系统药理学的甘草作用机制和新药发现研究[D].咸阳:西北农林科技大学,2013.
[9]张新庄,萧伟,徐筱杰,等.利用网络药理学方法研究热毒宁注射液抗流感病毒的分子作用机制[J].物理化学学报,2013,29(7):1415-1420.
[10] 冯春来,顾於梅,秦悦,等.基于模块分解的生物网络分析算法及其应用[J].中成药,2016,38(10):2227-2232.
[11] 黄海滨,杨路明,王建新,等.基于网络拓扑的生物网络关键节点识别研究进展[J].数学的实践与认识,2011,41(7):114-125.
[12] The Gene Ontology Consortium.The Gene Ontology project in 2008[J].Nucleic Acids Res,2008,36(Database issue):D440-D444.
[13] 杨蓉,蔡琳.BiNGO及DAVID在miR-155靶基因富集分析中的应用[J].福建医科大学学报,2012,46(6):408-414.
[14] Maere S,Heymans K,Kuiper M.BiNGO:a Cytoscape plugin to assess overrepresentation of gene ontology categories in biological networks[J].Bioinformatics,2005,21(16):3448-3449.
[15] Huang da W,Sherman BT,Lempicki RA.Systematic and integrative analysis of large gene lists using DAVID bioinformatics resources[J].Nat Protoc,2009,4(1):44-57.
[16] 骆明旭,罗丹,赵万红.槲皮素药理作用研究进展[J].中国民族民间医药,2014(17):12-14.
[17] 孔令希.山柰酚抗动脉粥样硬化作用机理探讨及其药代动力学研究[D].重庆:重庆医科大学,2014.
[18] 周瑶,杜标炎,谭宇蕙,等.山柰酚对大鼠肝癌细胞CBRH 7919的增殖抑制及诱导凋亡作用[J].广州中医药大学学报,2010,27(3):250-253.
[19] 杜标炎,周瑶,谭宇蕙,等.山柰酚对人胃癌MGC-803细胞的生长抑制及诱导凋亡作用[J].肿瘤,2010,30(6):477-480.
[20] 李瑞君,梅家转,刘桂举.山奈酚诱导人食管鳞癌Eca-109细胞凋亡及其机制[J].南方医科大学学报,2011,31(8):1440-1442.
[21] 廖峥嵘,沈永青,赵娟,等.山奈酚对人小细胞肺癌H446细胞凋亡的影响[J].河北师范大学学报:自然科学版,2011,35(5):510-514.
[22] 刘智豪,刘叔文,余乐.COX-2抑制剂联合抗肿瘤的研究进展[J].中国药理学通报,2012,28(12):1651-1654.
[23] 刘贵波,刘跃光,孙成,等.山奈酚对2型糖尿病大鼠糖脂代谢及胰岛素抵抗的影响[J].实用临床医药杂志,2012,16(9):1-3.
[24] 马晶晶,章涛.PPARγ功能与疾病关系研究进展[J].中国药理学通报,2012,28(5):601-604.
[25] 许辉.5-脂氧合酶在肿瘤中的作用和机制[J].长沙医学院学报,2008,7(15):36-41.
