对测量反应速率实验的思考及改进
2018-02-28魏毅鸣
魏毅鸣
摘要:通过查阅参考文献,对人教版《化学反应原理》实验2-1进行思考和改进。经过对原实验数据的量化分析,指出误差产生的原因。设计用Y型反应器结合排水量气法的实验装置,测量不同浓度硫酸与锌粒的反应速率。改进后实验装置简易严谨,克服了原教材实验的不足,有良好的教学效果。
关键词:反应速率测定;实验装置改进;Y型反应器;起始反应浓度;实验探究
文章编号:1005-6629(2018)1-0075-04 中图分类号:G633.8 文献标识码:B
化学是一门以实验为基础的科学,实验可分为定性实验和定量实验。定性实验要求现象明显清晰,能够说明问题;而定量实验要求更严谨,因为涉及数据的精确性。因此,对于定量实验的测定一定要控制好不确定的因素,确保所得数据的可信度。教科书上的演示实验和探究实验在定量测量上必须科学严谨,马虎不得。
1对测量反应速率实验的思考
在人教版《化学反应原理》第二章第一节“化学反应速率”教学时碰到了一个问题,发现某些因素导致了演示实验2-1的实验数据不能准确测定,且误差较大。现将该实验介绍如下:
按图1安装两套装置,在锥形瓶内各盛有2g锌粒(颗粒大小基本相同),通过分液漏斗分别加入40mL1.0mol/L和40mL4.0mol/,L的硫酸,比较二者收集10mLH2所用的时间。把实验结果填入表1:
教参上对于这个实验的活动建议是:
实验2-1注意检验装置的气密性,尤其是注射器的内外管是否密合得很好。酸的浓度要适中,否则控制生成H2的速率会发生困难。气体收集可以用排水量气装置代替。
在室温24.6℃下进行以上实验,通过排水量气法测得从反应开始到收集满10mL气体所需的时间,数据如表2所示。
实际所得的以上数据是不能真正反映两种不同浓度硫酸与相同质量的锌粒反应速率的对比状况的。
在实验时发现存在以下几方面问题:(1)若从硫酸注入时进行测量,随着酸液的流入,容器中的气体同时会排出,无法确定何时为收集10mLH2的时刻。收集的气体主要是由注入的硫酸排开的空气所导致的。由于密度不同,浓度不同的硫酸等体积时对空气施加的压力不同,且由于黏度不同,流速也不同,会导致排出空气的速率不同;不同分液漏斗活塞释放液体的流速不同也影响排出空气的速率。通过实验发现在该实验中影响数据准确性的有以下干扰因素:分液漏斗活塞旋钮的开合程度(不同的开合程度影响酸液的流速,进而影响排出气体的速度);酸液本身的黏性(较浓的硫酸黏滞性较强,导致流速偏慢,进而排出气体的速度反而慢)。(2)如果用体积差法进行测量,当硫酸注入完毕即排出气体达到40mL时开始测量收集10mL气体所用的时问,则该方案不足之处在于此时并不是相同温度下测定的指定浓度的硫酸溶液与锌粒的反应,此时温度的差异是否可以忽略不计是值得思考的;且此时反应速率会达到比较快的程度,用分钟作为计时单位也是值得商榷的。(3)当注入40mL硫酸后,分液漏斗应该处于液封状态或者保持气密状态,但本装置无法实现这样一个目标,少量气体会从分液漏斗上口逸出。
2对测量反应速率实验的改进
带着以上的思考,查阅了一些资料,发现前人对本实验已经有所反思和改进。如吴名胜等对该实验进行了改进,设计了多种测量反应速率的方案。他们发现该实验有以下不足:
(1)硫酸溶液浓度太大,反应时间太短,来不及计时,造成结果误差大。
(2)由于气体顶托,造成酸液流速慢。刚开始时(漏斗下端还没有被液封时),有气体从分液漏斗中逸出(H2密度小于空气),导致测出收集10mL气体所需时间不准。
(3)针筒活塞的静摩擦力,致使移动过程是跳跃式的,读数不准。若用同一针筒实验使用多次就有滞动情况(因针筒内有氢气带人的水蒸气,使活塞滞动)。
(4)不同厂家生产的锌粒与相同浓度的硫酸溶液反应,速率相差较大。
针对这些不足,他们在反应装置上进行了一些改进,如图2、图3所示。
上述文献中还对收集装置和操作作了改进,改用收集30mL气体,并对针筒活塞用挡板处理防止掉落,并做了润滑处理。另外还对硫酸浓度作了改动,他们用3.0mol/L和2.0mol/L的硫酸进行对比实验,速率适中,对比明显。最后他们也提到该反应为放热反应,只有初始反应时测量速率才有比较意义。
就装置改进来说上述两个装置都是存在一定问题的。首先是过于复杂的实验装置会使定量实验的测量存在众多变数,增大了产生误差和失败的可能性。其次,从测量的严谨性上对这两个装置进行分析。图2的改进装置1虽然能够很好地测量10mL气体产生的时间,但是存在两个问题:第一,铜丝与锌粒接触会产生原电池,对反应的速率产生影响,并可能使浓度的影响成为次要因素。第二,铜丝如果能灵活地上下移动则必然会对整个装置的气密性产生影响,本实验成败就在于整个装置的气密性。铜丝的灵活性和装置的气密性不可兼得:具有一定机械强度的铜丝必然有一定的粗度,而粗铜丝若要通过胶塞上下灵活移动没有一定的孔径是无法实现的,而孔径越大则气密性越差。图3的改进装置2虽然解决了气密性的问题,但是在测量时不能解决实验2-1的两个问题:(1)若从硫酸注入时进行测量,主要是容器中的空气同时会排人注射器,无法确定何时为开始收集H,的时刻。(2)若等硫酸注入完毕开始测量,则温度较高,速度较快,难以测量,且浓度不同硫酸反应后体系温度差异较大,不能满足体系温度一致的要求。
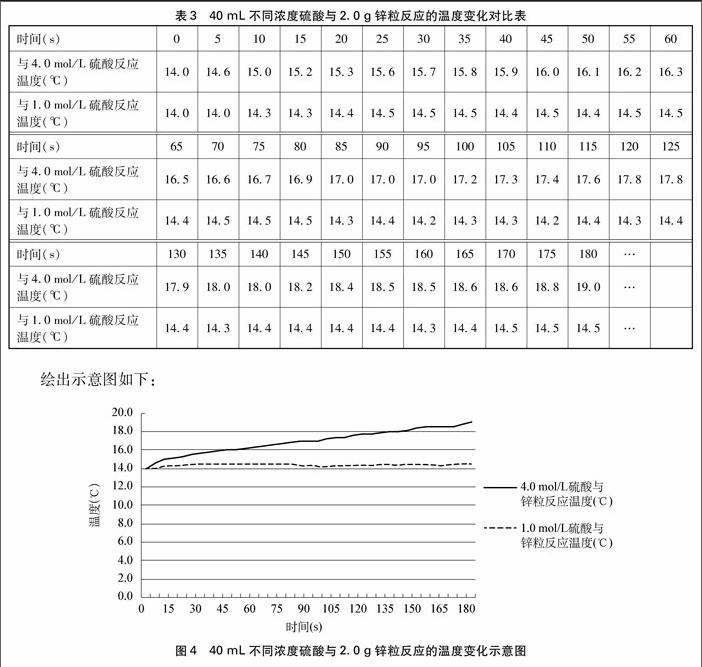
因此,只有初始反应时测量速率才有比较意义。原因一是硫酸的浓度相近具有可比性,二是温度在初始反应时才是相等的,处于室温,随着反应进行由于是放热反应,温度必然会有所升高。当然,短时间内不同浓度的硫酸与锌粒反应温度是否升高到有所差异的程度,需作实验探究才能得出结論。为此,设计了以下方案来比较该实验反应后短时间内温度的变化差异。
实验设计:对40mL4.0mol/L硫酸和40mL1.0mol/L硫酸分别与2.0g锌粒的反应体系,考察从开始反应随时间温度的升高趋势,以判断多长时间内注入硫酸可以忽略温度对反应速率的影响。
实验仪器:250mL烧杯2只,电子测温仪,秒表,托盘天平
用电子测温仪分别测量40mL4.0mol/L硫酸和1.0mol/L硫酸与2.0g锌粒(粒径1.5~2.0mm)反应的温度变化,每5秒钟读取一次读数。读取3分钟之内的数据(室温15.3℃),如表3所示。
实验仪器:Y型反应器,导管,50mL量筒,水槽,秒表,托盘天平
实验药品:4.0mol/L硫酸,1.0moL/L硫酸,锌粒(粒径1.5~2.0mm)
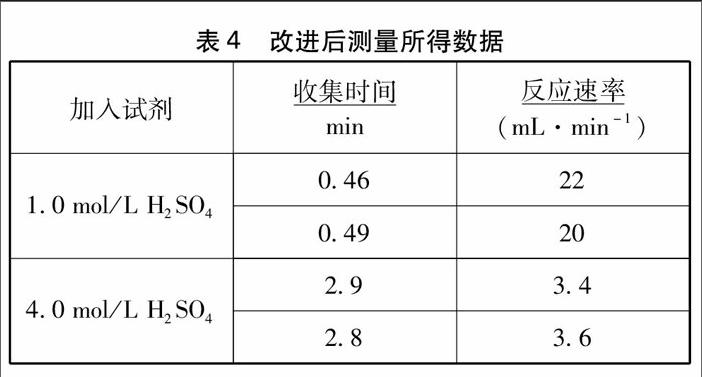
实验步骤:用纸槽先在Y型反应器的一支管装入1.0g锌粒,再在Y型反应器的另一支管小心倒入10mL4.0mol/L硫酸,用导气管、水槽和装满水的50mL量筒组成装置3,通过调整倾角迅速使硫酸与锌粒混合,用排水集气法收集气体,同时用秒表测量收集10mL气体所需时间。再改用1.0mol/L硫酸用相同装置重复以上步骤。
在室温27.6℃下进行以上实验,得到以下数据(见表4):
由以上数据明显看出较浓的硫酸在同等条件下和锌粒反应产生氢气的平均速率较快。该改进装置仪器都是中学常见仪器,且连接简单,气密性容易保证,装置反应体系空间小,出气迅速,操作简单方便,速率适中,药品消耗也少。这样既能测量到从起始反应开始的平均速率,又能保证实验的严谨性,顺利克服了原教材实验2-1的诸多不足,教学效果良好。endprint