“化学平衡移动方向与转化率的关系”课例研究
2018-02-28张道年
张道年
摘要:从化学学科观念、化学学科思维和化学学科价值追求角度分析探讨“平衡移动方向与转化率之间的关系”教学,以促进学生平衡观的发展,落实学科核心素养培养目标,切实提升了学生的化学学习能力。
关键词:化学学科观念;化学学科思维;平衡观;化学教学;课例研究
文章编号:1005-6629(2018)1-0048-05 中图分类号:G633.8 文献标识码:B
2014年教育部《关于全面深化课程改革落实立德树人根本任务的意见》提出在基础教育阶段应帮助学生形成适应个人终身发展和社会发展需要的必备品格和关键能力。高中化学核心素养是学生发展核心素养的重要组成部分,是高中生通过化学课程学习所获得的在知识与技能、过程与方法、情感态度与价值观等方面的综合品质与关键能力。高中化学核心素养包含化学学科观念、化学学科思维、科学探究实践和化学学科价值追求等方面,其中化学学科观念是化学学科知识和原理的高度抽象和概括,处于化学知识的核心位置。因此在教学实践中教师应深化对学生学科核心观念的培养。平衡观就是化学学科核心观念之一。从知识价值来看,平衡观是解决问题的理论依据;从方法價值来看,平衡观是一种体验模型认知、科学探究和强化信息意识的有效平台;从情意价值来看,平衡观又是培育创新意识、科学精神和社会责任的优质载体,因此与“平衡观”有关的知识点是培养学生化学核心素养的优质素材。本文选取“化学平衡移动方向与转化率之间的关系”教学主题进行教学设计(见图1),以促进学生平衡观的发展,落实学科核心素养的培养目标。
1初步建立平衡观念
“知识与技能”是形成和发展学生核心素养的基础、前提和载体,机械灌输、被动接受的学科知识和技能是不可能形成核心素养的,而主动建构知识的过程才是核心素养发展的前提。化学平衡移动所导致的反应物转化率的变化与反应方程式前后的系数大小有很大的关系,学生在这个方面也经常会犯错误。例如,恒温恒容容器中,对于2NO2(g)←→N2O4(g)和2HI(g)←→H2(g)+I2(g)两个典型反应,当提出“增加反应物的浓度”,得出“化学反应进行的方向”都向右进行,而得出“反应物的转化率”分别“增大”和“不变”这两个结论并不难。但学生并未认识到反应前后系数间大小关系与转化率变化问的关系,所以对于反应N2O4(g)←→2NO2(g),当提及“增加反应物的浓度”时,多数学生仍会认为反应物的转化率会增大。因此,笔者针对这一问题进行了如下的教学设计:
1.1勒夏特列原理
如果改变影响平衡的条件之一(如温度、压强,以及参加反应的化学物质的浓度),平衡向着能够减弱这种改变的方向移动。
[问题1]请勾出经验规则勒夏特列原理的关键词。
因为勒夏特列原理是经验规则,所以在利用其原理解决问题时一定要抓住关键词。强调勒夏特列原理中“减弱”和“改变”这两个关键词有利于学生把握要点。
1.2运用勒夏特列原理分析化学反应进行方向
[问题2]表1呈现了三个典型反应。在一定温度条件下,分别向三个恒容容器中增加反应物。三个容器中的反应分别是2HI(g)←→H2(g)+I2(g),2NO2(g)←→N2O4(g)和N2O4(g)←→2NO2(g),请用勒夏特列原理分析化学反应进行的方向。
[分析]见表2。
利用表1,让学生认识到2HI(g)←→H2(g)+I2(g)、2NO2(g)←→N2O4(g)和N2O4(g)←→2NO2(g)三个反应在反应前后体积变化是不同的,分别是不变、减小和增大。再结合表2对问题2进行思考分析,根据勒夏特列原理可知只要增大反应物的浓度,无论反应前后系数是不变、增大,还是减小,化学反应肯定是向正反应方向移动的,这是本节课第一次运用勒夏特列原理分析化学反应进行的方向。
1.3反应物的转化率
定义:反应掉的反应物浓度占总反应物浓度的百分比。(注:“某个指定反应物的转化率”定义见人教版选修4第29页下方小字部分)
公式:某个指定反应物的转化率=(c(反应掉的反应物)/c(该反应物))×100%
[问题3]向恒容容器中增加反应物,化学反应向正反应方向移动,那么反应物的转化率是不是增大了?
[回答]不一定。因为观察公式可发现反应物转化率情况不但与“分子”的数值有关,还与“分母”的数值有关。虽然“分子”增大了,但是“分母也同样增大了。
通过问题引导和图表信息分析,帮助学生认识到物质是在不停运动和变化着的,平衡和运动是密不可分的,客观世界在不断地沿着由不平衡到平衡、再由平衡到不平衡的轨迹运动着。所以当增加反应物时,可逆反应必定发生变化,反应物的转化率也将会发生变化。三个典型反应,增加反应物虽然反应方向都是向右进行的,但反应物的转化率如何变化还是需要慎重考虑的,从而为深入了解化学平衡移动所导致的反应物转化率的变化与反应方程式前后的系数大小关系奠定了基础。
2建立“虚拟容器法”模型
[问题4]一定温度下,恒容容器中有反应2NO2(g)←→N2O4(g),增大NO2的浓度,反应物NO2的转化率如何变化?endprint
[教师]分析“虚拟容器法”。
[分析]如图2所示,向反应2NO2(g)←→N2O4(g)的体系中增加反应物,第一步运用虚拟容器法,反应向正反应方向移动,反应物的转化率是不变的。第二步,将上方虚拟的容器中的气体“压人”下面容器中,由于反应容器中的所有物质总的物质的量增加了,而反应物的系数大于生成物的系数,所以平衡应该是向正反应方向移动,最终NO2的转化率是升高的。容器Ⅱ相对于容器I而言,反应物的转化率变化情况可用表3来表示。表3增大反应物浓度和反应物转化率的变化情况
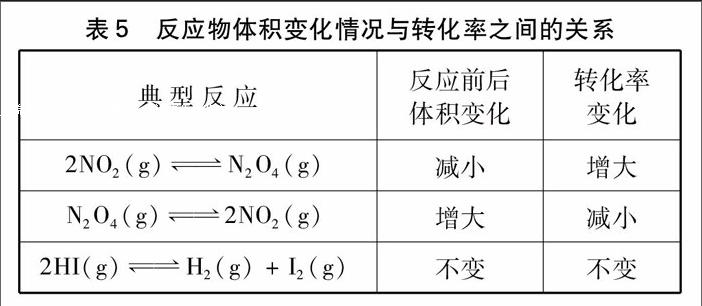
[结论]一定温度,恒容容器有反应2NO2(g)←→N2O4(g),再加入反应物NO2,NO2的转化率将增大。反应物体积变化情况与转化率之间的关系小结见表4。
[问题5]若把反应2NO2(g)←→N2O4(g)换成N2O4(g)←→2NO2(g),情况又将如何呢?
[分析]仍按照虚拟容器法来分析,见图3。
[问题6]又如2HI(g)←→2(g)+I2(g),情况又会发生怎样的变化?
[分析]再次按照虚拟容器法分析,见图4。
[小结]反应物体积变化情况与转化率之间的关系小结见表5。
(1)以反应2N02(g)←→N:0。(g)为例,第一次运用勒夏特列原理说明增加N02后化学反应向右移动了。由于2>1,第二次运用勒夏特列原理,这个反应还有“一股向右的力量”,使得N02的转化率增大了;
(2)以反应N2O4(g)←→2NO2(g)为例,第一次运用勒夏特列原理说明增加N2O4后化学反应向右移动了。由于1<2,所以第二次运用勒夏特列原理,这个反应还有“一股向左的力量”在掣肘着向右的移动,所以N2O4的转化率减小了,这也是学生最难以理解的;
(3)以反应2HI(g)←→H2(g)+I2(g)为例,第一次运用勒夏特列原理说明增加HI后化学反应向右移动了。但由于2=2,所以第二次运用勒夏特列原理,化学反应不移动,所以Hl的转化率不变。
这一环节采用了三个反应体系,分别是2NO2(g)←→N2O4(g),反应物的系数大于生成物;N2O4←→2NO2,反应物的系数小于生成物的系数;2HI(g)←→H2(g)+I2(g),反应物系数等于生成物,逐一呈现反应,并提出增加反应物,平衡移动的问题,引导学生依据勒夏特列原理,利用虚拟容器法不断思考和比较分析,形成对化学平衡移动所导致的反应物转化率的变化与反应方程式前后的系数大小关系的全面认识。
人类运用化学方法探索物质世界时,常常对大量实验事实进行比较分析、归纳概括后,还需要通过抽象和简化的方法建立模型,再现物质及其变化的基本规律,这就是“模型认知”思维。对于“平衡移动的方向”与“转化率”之间的关系,教师引导学生认识化学模型——“虚拟容器法”,并利用该模型分析不同类别的具体化学反应,归纳总结出在不同类型的可逆反应中,增加反应物的量,反应物的转化率变化的规律和本质。
3“诊断→反思→总结”的历程
基于上述环节中三个典型反应的模型分析,学生对化学平衡移动的方向与转化率变化之间的关系形成了深刻认识。这时需要进一步创设条件让学生运用知识进行问题解决,以促进知识的内化和问题解决能力的发展。
人教版《化学反应原理(选修4)》不仅有“化学平衡”,还有与化学平衡息息相关的“电解质溶液”,其中的弱电解质的电离、盐类的水解等内容,均涉及浓度的变化对弱电解质的电离程度,或盐类水解程度的影响。但在之前必须要建立“微粒观”,要介绍给学生无论是CH3COOH(aq)←→CH3C00-(aq)+H+(aq),还是Fe3+(aq)+3H2O←→Fe(OH)3(胶体)+3H+(aq),都属于微粒数“1→多”的形式,与上述介绍的N2O4(g)F←→2NO2(g)类似,因此可以以弱电解质的电离程度,或是盐类的水解程度为研究问题,并运用“类推法”予以解决。
3.1弱电解质的电离
[问题6]恒温恒容,N2O4(g)←→2NO2(g)类推CH3COOH(aq)←→CH3COO-(aq)+H+(aq),若改变醋酸的浓度,那么CH3COOH的电离程度如何变化?(见表6)
3.2盐类的水解
[问题7]恒温恒容,N2O4(g)←→2NO2(g)类推Fe3+(aq)+3H2O(1)←→Fe(OH)3(胶体)+3H+(aq)。若改变Fe3+的浓度,那么Fe3+的水解程度如何变化?(见表7)
在学习“弱电解质的电离程度”和“盐类的水解程度”时,运用“模型认知”,学生惊讶地发现,原来“化学平衡的移动与转化率之间的关系”在这两部分中仍然是可以应用的!学习化学的热情被极大地激发了,而且还能更深刻地理解了化学科学的人文内涵。
《普通高中化学课程标准》以培养学生核心素养为终极目标,并明确指出“高中化学课程以进一步提高学生的科学素养为宗旨,是科学教育的重要组成部分,它对提高学生的科学素养,促进学生的全面发展有着不可替代的作用”。化学学科观念包括“结构决定性质”思想、“守恒”思想、“平衡”思想和“能量”思想等,它們是化学学科核心素养的重要组成部分,是学科中深层次的寓意。在可逆反应中“改变外界条件,转化率如何变化?”这个基本认识形成后,通过“诊断→反思→总结”的思考路径,运用“类推法”顺理成章地解决电解质溶液中的“转化率”问题,实现了知识的联系,让学生充分感悟到化学学科的魅力。与“平衡观”相关的知识还远不止这些,例如可逆反应中K和Q的大小比较可以作为判断反应进行方向的判据,而在“弱电解质的电离”、“沉淀溶解平衡”和“盐类的水解”等章节判断反应的方向也可以广泛应用,这又是“平衡观”在化学学科中的体现,有待于今后继续研究。endprint