光动力抗微生物化学疗法对解脲脲原体体外活性的影响
2018-02-28叶庭路陈办成于波杨虹姜彬邵勇黄国新
叶庭路,陈办成,于波,杨虹,姜彬,邵勇,黄国新
1.北京大学深圳医院皮肤科,深圳 518036;2.北京大学深圳医院检验科,深圳 518036;3.汕头大学医学院,汕头 515041
解脲脲原体(Ureaplasmaurealyticum,U.urealyticum)是一种重要的病原微生物。近年来,其耐药形势十分严峻,尤其是对喹诺酮类及大环内酯类[1-2]耐药。从怀孕患者中分离的解脲脲原体及合并人型支原体(Mycoplasmahominis)感染的解脲脲原体耐药形势更严重[3]。其耐药主要与抗生素的不合理应用有关,这种情况如果得不到有效遏制,耐药形势必将更严峻。因此,寻找一种全新的有效替代治疗方案尤为重要。
光动力抗微生物化学疗法(photodynamic antimicrobial chemotherapy,PACT)是一种以光敏剂、光及氧分子相互作用为基础的新型抗感染方法。文献报道 PACT对病毒、细菌、真菌及寄生虫有抑制或灭活作用,但对解脲脲原体的体外活性是否有影响目前尚不清楚。本研究拟探讨以甲苯胺蓝(toluidine blue)为光敏剂的PACT对解脲脲原体的体外灭活作用,为其新型治疗方法的研发提供理论基础。
1 材料与方法
1.1 材料
1.1.1研究对象Uu-1(ATCC 27813,属Parvo生物群)和Uu-5(ATCC 27817,属T960生物群)两种标准菌株由中山大学附属第三医院皮肤性病科转赠。解脲脲原体临床株于2014年8月收集于北京大学深圳医院皮肤性病科门诊,菌株1(Uu-c1)经聚合酶链反应(polymerase chain reaction,PCR)分群确定为Parvo生物群,菌株2(Uu-c2)经PCR分群确定为T960生物群,均来自临床表现典型的男性尿道炎患者尿道拭子标本。
1.1.2主要试剂与设备解脲脲原体液体培养基购于珠海丽珠试剂股份有限公司,固体鉴定培养基购于广州市怡林园生物工程有限公司。甲苯胺蓝购于美国Sigma公司,以去离子水配制成25 mmol/L的储存液,实验前用支原体液体培养基稀释成 5 mmol/L 的工作液。DNA分群鉴定引物为:上游5′-GTATTTGCAATCTTTATATGTTTTCG-3′,下游5′-CAGCTGATGTAAGTGCAGCATTAAAT-TC-3′,由上海英骏生物技术有限公司合成。PCR反应试剂盒及DNA marker购自天根生化科技(北京)有限公司,琼脂糖购自广州威佳科技有限公司。光源为武汉亚格光电技术有限公司的LED-IB光动力治疗仪,波长(633±10)nm,最大功率密度100 mW/cm2。LRH-70F生化培养箱购于上海一恒科技有限公司。
1.2 方法
1.2.1解脲脲原体的纯化、鉴定及密度测定解脲脲原体临床株收集后,培养于液体培养基,24 h内待培养基颜色由黄色转为淡红色(仍保持澄清,不浑浊),转种于固体鉴定培养基纯化,待出现典型棕黑色海胆状细小菌落,挑取单个典型菌落转种于液体培养基增菌,以保证菌株的纯度。另取一份标本行PCR鉴定及分群,具体操作参照本课题组以前的报道[4-5]。解脲脲原体临床株及标准株均采用颜色改变单位(color change unit,CCU)法测定菌液密度,于96孔聚苯乙烯酶标板进行,具体操作见参考文献[6]。将菌液增菌或稀释至CCU为104~105,于-70 ℃保存以备用。
1.2.2解脲脲原体与光敏剂孵育菌株的孵育于96孔聚苯乙烯酶标板(12行标记为1~12,8列标记为A~H,详见图1)中进行。首先将液体培养基加入预先准备好的96孔酶标板第1、3、5、7、10行的第1~8孔,每孔90 μL。从第2孔起,每孔加入90 μL 5 mmol/L 甲苯胺蓝工作液,充分均匀后吸取90 μL至第3孔,均匀后再从第3孔吸取90 μL至第4孔,如此进行倍比稀释,依次形成2.5~0.039 062 5 mmol/L的甲苯胺蓝溶液。每行第1孔(A列)不加任何光敏剂,作为光敏剂空白对照。将保存的密度为104~105的解脲脲原体菌液复苏,于第1、3、5、7行每孔分别加入菌株Uu-1、Uu-5、Uu-c1、Uu-c2各10 μL。第10行光照前不加菌株,光照后再加入菌株作为非光照对照组(见下述)。盖好酶标板盖后,置于37 ℃生化箱中避光孵育。按孵育时间分两组,分别为30、60 min(图1)。每株菌株均操作3个96孔聚苯乙烯酶标板,取均值。
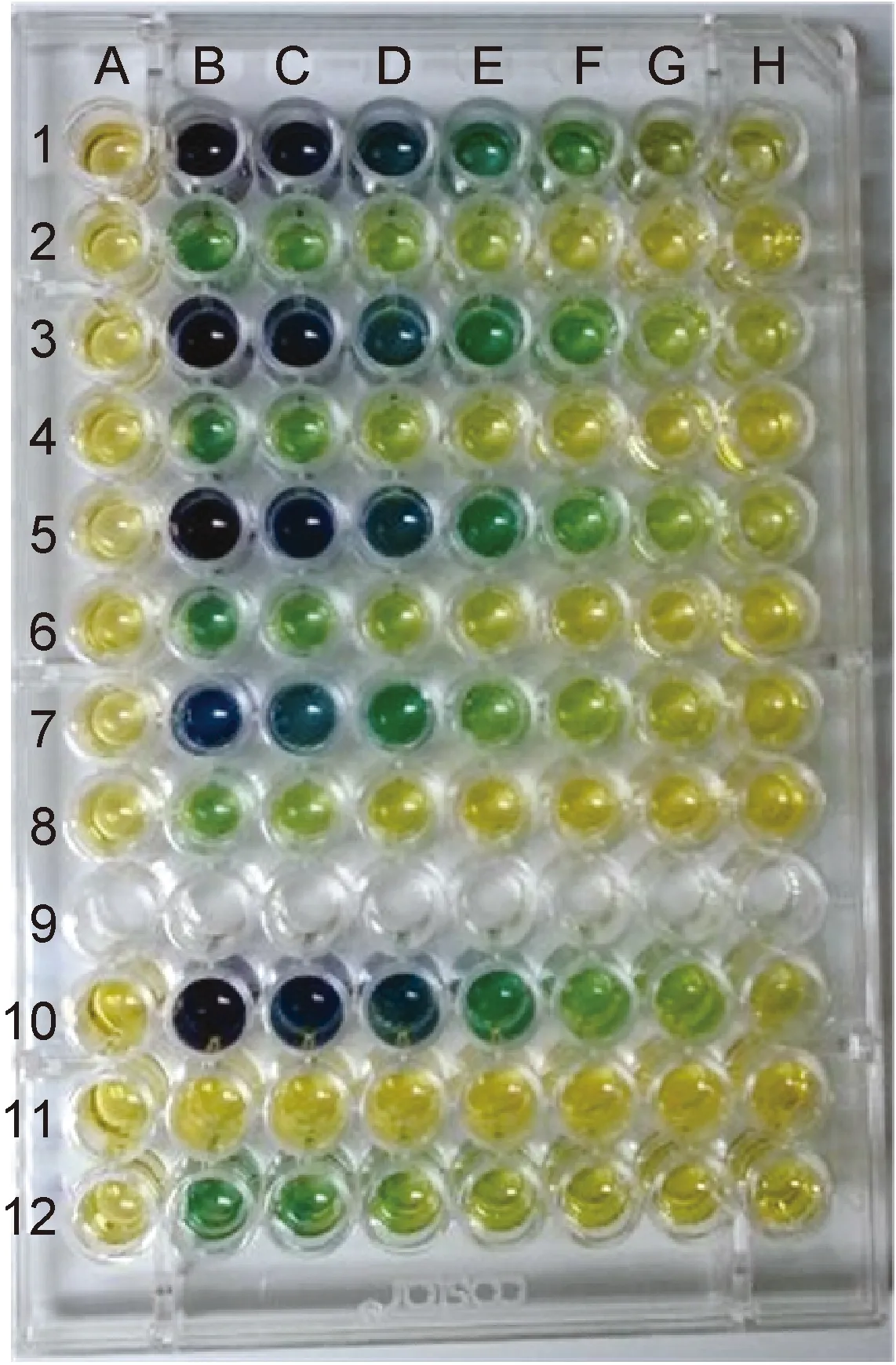
图1实验操作示意图
Fig.1Diagramofexperimentoperation
1.2.3光照孵育后,将酶标板置于黑房中进行光照。光源波长633 nm,能量功率密度均为100 mW/cm2,照射时间分别为8、17、34和68 min,故总能量密度分别为48、102、204和408 mJ/cm2。保证光源垂直照射,光源距离酶标板20 cm。
1.2.4再培养光照后,在原酶标板第2、4、6、8行每孔分别加入解脲脲原体液体培养基90 μL。将第1、3、5、7行每孔内解脲脲原体菌液各吸取10 μL,分别转种至第2、4、6、8行对应孔内。第10行每孔在光照后加入10 μL解脲脲原体菌株(Uu-1、Uu-5、Uu-c1或Uu-c2,每张酶标板只加1种)。加样完成后,每孔均滴加1滴无菌石蜡油覆盖以避免培养基挥发。第10行菌株孵育20 min或60 min后,按上述方法转种于第11行(图1)。另在第12行加入与第2、4、6、8行内含相同浓度甲苯胺蓝的支原体培养基,作为判读结果的标准颜色参照。接种完成后,将酶标板置于生化培养箱同样环境中进行再培养。
1.2.5结果判读孵育48 h后观察并判读结果。相对于第12行的标准颜色参照,孔内液体颜色明显变深,提示解脲脲原体生长,判读为解脲脲原体阳性(图2)。
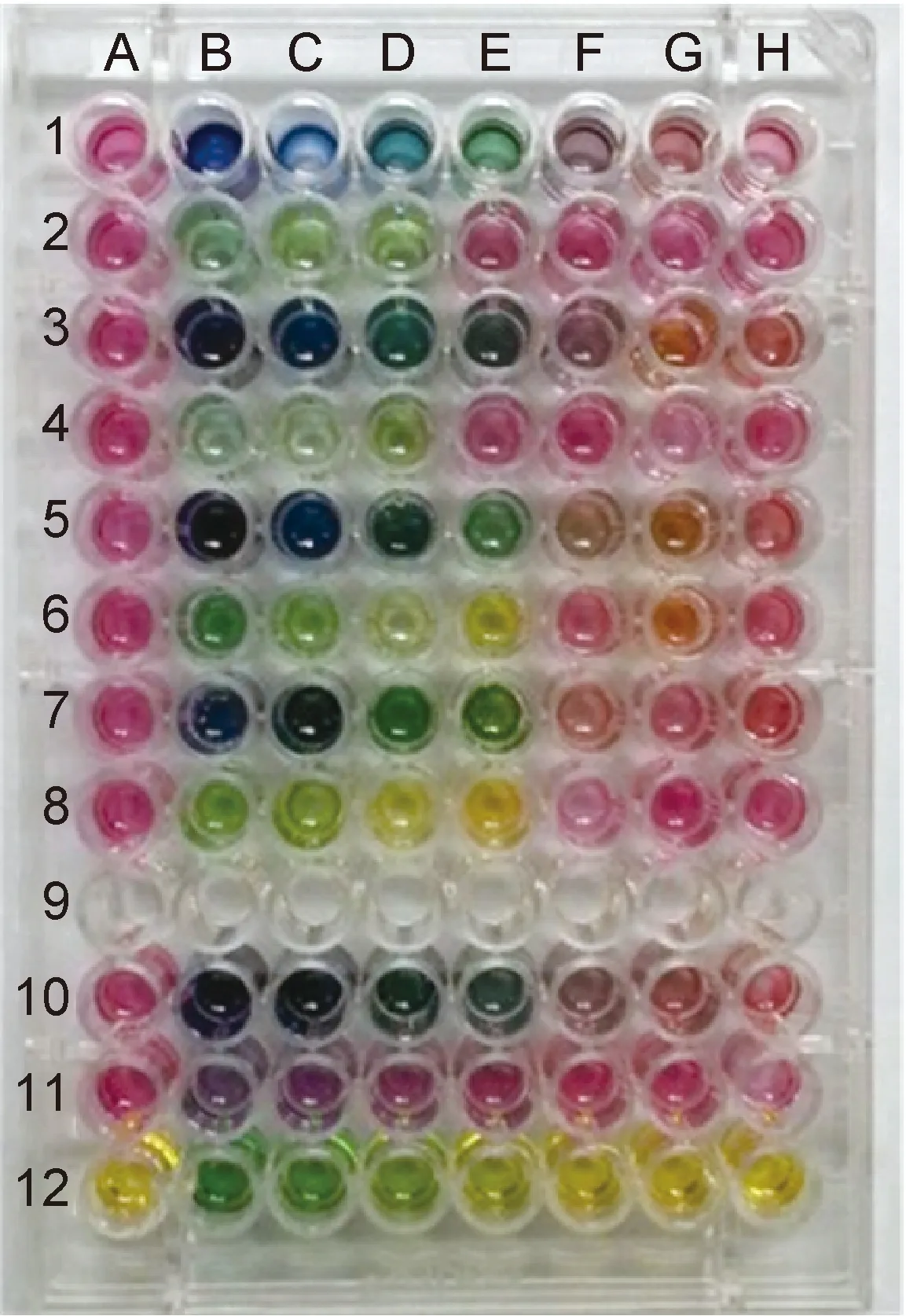
图2结果示意图
Fig.2Diagramofexperimentresults
2 结果
2.1 PACT中甲苯胺蓝浓度对解脲脲原体活性的影响
每块酶标板第10、11孔的对照组显示,接种的Uu-1、Uu-5、Uu-c1或Uu-c2菌株在每孔中均能良好生长。但与不加光敏剂的A列相比,甲苯胺蓝≥0.312 5 mmol/L的孔较更低浓度或不加甲苯胺蓝的孔出现颜色变化要晚6~12 h。在光照能量密度及解脲脲原体与甲苯胺蓝孵育时间固定的前提下,PACT对解脲脲原体的灭活作用随甲苯胺蓝浓度的增加而增强,即呈甲苯胺蓝浓度依赖的模式(表1)。
2.2 PACT中光照能量密度对解脲脲原体活性的影响
在无光敏剂时,以不同能量照射解脲脲原体,4种能量密度下所有菌株均能生长,且生长速度与非光照且不加甲苯胺蓝的解脲脲原体相当,提示本研究所用的633 nm红光光源在408 J/cm2及以下的能量密度对解脲脲原体的活性无明显影响。在甲苯胺蓝浓度及其与解脲脲原体孵育时间固定的条件下,PACT对解脲脲原体的灭活作用随光照能量密度的增加而增强,即呈光照能量密度依赖的模式(表1)。
表1PACT处理后解脲脲原体仍可生长的甲苯胺蓝最高浓度
Tab.1ThemaximumtoluidineblueconcentrationofU.urealyticumsurvivalafterPACTtreatment(mmol/L)
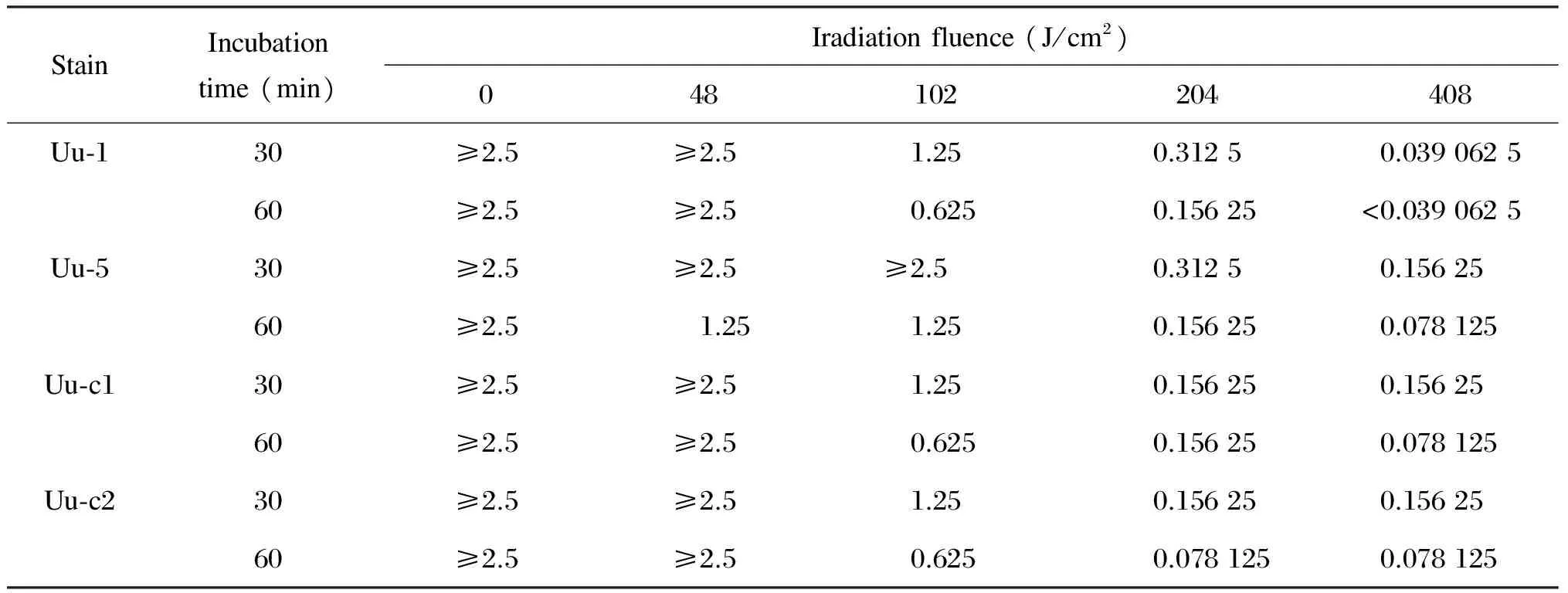
StainIncubationtime(min)Iradiationfluence(J/cm2)048102204408Uu⁃130≥2.5≥2.51.250.31250.039062560≥2.5≥2.50.6250.15625<0.0390625Uu⁃530≥2.5≥2.5≥2.50.31250.1562560≥2.51.251.250.156250.078125Uu⁃c130≥2.5≥2.51.250.156250.1562560≥2.5≥2.50.6250.156250.078125Uu⁃c230≥2.5≥2.51.250.156250.1562560≥2.5≥2.50.6250.0781250.078125
2.3 PACT中光敏剂孵育时间对解脲脲原体活性的影响
本研究采用两个光敏剂孵育时间,以比较孵育时间对PACT作用的影响。由表1可见,总的趋势是随光敏剂孵育时间延长,PACT对解脲脲原体的灭活作用有增强趋势。
2.4 不同解脲脲原体生物群对PACT敏感性的差异
选用两种解脲脲原体生物群各两株菌株(包括标准株及临床分离株),由表1可见,两种生物群之间标准株与临床株对PACT的敏感性相似。
3 讨论
病原微生物耐药的广泛蔓延促进了大量抗微生物感染的研究,但至今缺乏安全、有效的治疗方法。PACT是一种结合光敏剂分子和可见光照射产生活性中间产物,对病原微生物进行灭活的抗微生物方法。近年来,随着光敏剂及激光技术的发展,PACT抗耐药微生物感染的治疗研究得到广泛关注。体外和动物研究表明,PACT已成功用于革兰阳性及革兰阴性菌[7-8]、病毒[9]、真菌[10]、寄生虫[11-12]感染的治疗,至今尚无文献报道微生物对PACT治疗的耐受性。因此,PACT有望成为微生物感染领域中颇有前景的替代治疗方法。
目前尚无PACT对解脲脲原体活性影响的报道,本研究首次尝试在体外探讨甲苯胺蓝介导的PACT对解脲脲原体的灭活作用。甲苯胺蓝是一种常用的PACT光敏剂,较常应用于PACT的研究。甲苯胺蓝在常规剂量下对细菌等无明显灭活作用,但在合适光源存在时能有效抑制革兰阳性及革兰阴性细菌生长[13]。本研究发现,甲苯胺蓝在2.5 mmol/L时对解脲脲原体生长有一定抑制,但无完全灭活作用。在有光照时,PACT对解脲脲原体的灭活作用呈甲苯胺蓝浓度依赖模式。同样,633 nm红光光源在408 J/cm2及以下能量密度时对解脲脲原体生长活性基本无影响,但在甲苯胺蓝存在时对解脲脲原体的灭活作用呈光照能量密度依赖模式。此外,延长解脲脲原体与甲苯胺蓝孵育时间在一定程度上也增强了PACT对解脲脲原体的灭活效果,与PACT对白假丝酵母(又称白念珠菌)的效果类似[14],提示PACT有望成为解脲脲原体感染的有效替代治疗方法。但PACT对耐药解脲脲原体是否也具有灭活作用,或是否能增加耐药解脲脲原体对药物的敏感性,需进一步深入研究。
PACT杀灭解脲脲原体的机制尚不清楚。Rosseti等[14]研究发现,甲苯胺蓝介导的PACT对白念珠菌生物膜的形成有显著抑制作用,且这种作用与真菌细胞在光照后于培养基中的孵育时间有关,时间越长则抑制效果越明显。机制研究发现,这种作用与PACT增加真菌细胞壁通透性及培养基内活性氧(reactive oxygen species,ROS)有关。与此类似,PACT对革兰阳性及革兰阴性细菌的杀灭作用有赖于三线态光子和ROS的产生,通过Ⅰ型机制及Ⅱ型机制杀灭病原体[15]。形态学上,解脲脲原体没有细胞壁,只有一种3层结构的单位膜,更接近革兰阴性细菌。甲苯胺蓝介导的PACT也可能通过类似作用灭活解脲脲原体,但具体机制有待进一步研究证实。
解脲脲原体有两种生物群,两群之间致病性可能存在差异[16-17]。本研究使用解脲脲原体两种生物群的临床株及标准株,探讨它们对PACT反应性的差异。初步结果显示,解脲脲原体两种生物群对PACT的反应性相似,但灭活作用是否存在差异需更大样本研究。
[1] Domingues D,Távora Tavira L,Duarte A,Sanca A,Prieto E,Exposto F.Genital mycoplasmas in women attending a family planning clinic in Guiné-Bissau and their susceptibility to antimicrobial agents [J].Acta Trop,2003,86(1): 19-24.
[2] Messano GA,Cancrini F,Marsella LT.Antibiotic resistance and defensive medicine,a modern challenge for an old problem: the case of Ureaplasma urealyticum [J].Ig Sanita Pubbl,2014,70(3): 295-304.
[3] Redelinghuys MJ,Ehlers MM,Dreyer AW,Lombaard HA,Kock MM.Antimicrobial susceptibility patterns of Ureaplasma species and Mycoplasma hominis in pregnant women [J].BMC Infect Dis,2014,14(14): 171.
[4] Lu C,Ye TL,Zhu GX,Feng PY,Ma H,Lu RB,Lai W.Phenotypic and genetic characteristics of macrolide and lincosamide resistant Ureaplasma urealyticum isolated in Guangzhou,China [J].Curr Microbiol,2010,61(1): 44-49.
[5] 叶庭路,陆春,陈传杰,朱国兴,马寒,卢荣标,赖维.解脲脲原体Pavro和T960生物群msr基因的检测 [J].中华微生物学和免疫学杂志,2010,30(4): 377-381.
[6] Skakni L,Sardet A,Just J,Landman-Parker J,Costil J,Moniot-Ville N,Bricout F,Garbarg-Chenon A.Detection of Mycoplasma pneumoniae in clinical samples from pediatric patients by polymerase chain reaction [J].J Clin Microbiol,1992,30(10): 2638-2643.
[7] Lee CF,Lee CJ,Chen CT,Huang CT.delta-Aminolaevulinic acid mediated photodynamic antimicrobial chemotherapy on Pseudomonas aeruginosa planktonic and biofilm cultures [J].J Photochem Photobiol B,2004,75(1/2): 21-25.
[8] Gois MM,Kurachi C,Santana EJ,Mima EG,Spolidório DM,Pelino JE,Salvador Bagnato V.Susceptibility of Staphylococcus aureus to porphyrin-mediated photodynamic antimicrobial chemotherapy: an in vitro study [J].Lasers Med Sci,2010,25(3): 391-395.
[9] Cassidy CM,Tunney MM,Mccarron PA,Donnelly RF.Drug delivery strategies for photodynamic antimicrobial chemotherapy: from benchtop to clinical practice [J].J Photochem Photobiol B,2009,95(2): 71-80.
[10] Barbério GS,da Costa SV,dos Santos Silva M,de Oliveira TM,Silva TC,de Andrade Moreira Machado MA.Photodynamic inactivation of Candida albicans mediated by a low density of light energy [J].Lasers Med Sci,2014,29(3): 907-910.
[11] Asilian A,Davami M.Comparison between the efficacy of photodynamic therapy and topical paromomycin in the treatment of Old World cutaneous leishmaniasis: a placebo-controlled,randomized clinical trial [J].Clin Exp Dermatol,2006,31(5): 634-637.
[12] Baptista MS,Wainwright M.Photodynamic antimicrobial chemotherapy (PACT) for the treatment of malaria,leishmaniasis and trypanosomiasis [J].Braz J Med Biol Res,2011,44(1): 1-10.
[13] Usacheva MN,Teichert MC,Biel MA.Comparison of the methylene blue and toluidine blue photobactericidal efficacy against Gram-positive and Gram-negative microorganisms [J].Lasers Surg Med,2001,29(2): 165-173.
[14] Rosseti IB,Chagas LR,Costa MS.Photodynamic antimicrobial chemotherapy (PACT) inhibits biofilm formation by Candida albicans,increasing both ROS production and membrane permeability [J].Lasers Med Sci,2014,29(3): 1059-1064.
[15] Huang L,Xuan Y,Koide Y,Zhiyentayev T,Tanaka M,Hamblin MR.Type I and type II mechanisms of antimicrobial photodynamic therapy: an in vitro study on Gram-negative and Gram-positive bacteria [J].Lasers Surg Med,2012,44(6): 490-499.
[16] 陆春,叶庭路,马寒,赖维,朱国兴,陈传杰,陈荣章.女性下生殖道解脲脲原体生物群与临床症状相关性的初步探讨 [J].中国皮肤性病学杂志,2009,23(10): 645-646.
[17] Zhu GX,Lu C,Chen CJ,Feng PY,Ma H,Lu RB,Yuan YL.Pathogenicity of Ureaplasma urealyticum and Ureaplasma parvum in the lower genital tract of female BALB/c mice [J].Can J Microbiol,2011,57(12): 987-992.
