一株减毒百日咳鲍特菌的构建及生物学特性分析
2018-02-28田苗苗张优仪王小莲钟江李瑞
田苗苗,张优仪,王小莲,钟江,李瑞
1.复旦大学生命科学学院微生物学与微生物工程系,上海 200438;2.河西学院医学院,张掖 734000
百日咳是传染性强、感染率高的急性呼吸道传染病,婴幼儿是其易感人群。在小于1岁的婴儿中,肺炎、百日咳脑病和营养不良是百日咳所致死亡的主要原因。百日咳鲍特菌(Bordetellapertussis,B.pertussis)是引起百日咳的最主要病原菌。随着免疫接种等有效措施的推广,百日咳的发病得到有效控制。但近年来,世界卫生组织(World Health Organization,WHO)疾病监测发现,长期疫苗接种所带来的百日咳低发病率形势出现逆转,表现为发达国家百日咳发病率复升和发展中国家屡屡出现百日咳暴发,即所谓“百日咳重现”(pertussis resurgence)[1-3]。造成百日咳重现的原因,除疫情报告的敏感性提高外,还有对该病的重视程度及监测力度不够[4],最重要的是目前广泛使用的百日咳疫苗免疫成功率低导致免疫人群中百日咳抗体水平逐年降低,以及耐药突变菌株的出现[5]。
百日咳鲍特菌通过产生多种毒力因子定植于上呼吸道而进行感染。主要毒力因子包括百日咳毒素(pertussis toxin,PTX)、丝状血凝素(filamentous hemagglutinin,FHA)、百日咳杆菌黏附素(pertactin,PRN)、皮肤坏死毒素(dermonecrotic toxin,DNT)、腺苷酸环化酶毒素(adenylate cyclase toxin,ACT)、气管细胞毒素(tracheal cytotoxin,TCT)等。其中PTX是百日咳感染过程中的重要毒力因子,其全毒素几乎可结合任何含唾液酸的糖蛋白,其异三聚体G蛋白的ADP-核糖基化能影响多种不同类型细胞的信号转导功能[6]。PTX由S1、S2、S3、S4和S5共5种亚基构成,其中 S1 具有酶活性,负责结合靶细胞受体,也是免疫原性最强的抗原成分[7-8]。DNT在百日咳鲍特菌中的作用不确定,但在支气管炎鲍特菌(Bordetellabronchiseptica)中已被鉴定为重要毒素,且在微量注射时显示出致死活性[9]。TCT是革兰阴性菌的细胞壁肽聚糖分解产物[10],在其他物质的协同下诱导宿主产生促炎性细胞因子,破坏宿主气管纤毛细胞[11-13],从而出现咳嗽症状。TCT通常由 ampG转运蛋白重新运到细胞质,在细胞壁生物合成过程中被重新利用。与多数革兰阴性菌如大肠埃希菌(Escherichiacoli,E.coli)相比,百日咳鲍特菌的ampG转运蛋白效率非常低[9]。
已有研究报道成功构建了减毒百日咳活疫苗株。其中Locht团队于2006年成功构建BPZE1[9],目前已完成Ⅰ期临床试验(ClinicalTrials.gov,NCT01188512)。在该菌株中,dnt和tct基因被敲除,并采用编码无酶活性的ptx突变体替换天然ptx基因,即将具有酶活性的S1亚基中参与底物结合和催化的关键残基Arg-9换成Lys,Glu-129换成Gly[9],从而降低其致病性。
本研究将百日咳鲍特菌的重要毒力因子PTX、DNT、TCT全部敲除,以期获得一种安全性更高、致病性更低的新型减毒百日咳鲍特菌BPTM1。结果发现,BPTM1具有极佳的体外生长曲线和体内肺部定植能力,感染小鼠后并未引起明显的肺部病理炎症,且能诱导与野生型菌株同样的免疫反应。
1 材料与方法
1.1 材料
1.1.1菌株和质粒百日咳鲍特菌18323(ATCC#B.pertussisstrain 18323)由中国疾病预防控制中心提供。本实验使用的百日咳鲍特菌是百日咳鲍特菌18323链霉素抗性菌株,命名为BPMM。E.coliDH5α 由本实验室保存,质粒pUC19购于宝生物工程(大连)有限公司,庆大霉素抗性的自杀性质粒pJQ200mp18-rpsl由新加坡国立大学赠送。
1.1.2引物根据百日咳鲍特菌18323基因组序列(http://www.sanger.ac.uk/resources/downloads/bacteria/bordetella.html)进行引物设计,所有引物合成、测序、鉴定均委托铂尚生物技术(上海)有限公司完成,序列见表1。
1.2 方法
1.2.1百日咳鲍特菌培养将百日咳鲍特菌BPMM置于含20%无菌脱纤维羊血(sterile defidrinated sheep blood)和100 μg/mL链霉素的Bordet-Gengou琼脂血平板上,于37 ℃生长4 d[14]。为获得液体培养物和扩大菌量,可将其接种至Stainer-Scholte培养基中,于37 ℃摇床中培养至对数期。
1.2.23个毒力基因(ptx、dnt、ampG)的敲除或置换首先,采用同源重组方法敲除ptx基因。以百日咳鲍特菌BPMM为模板,PCR扩增获得ptx基因N端(基因组位置3870259~3870746)、C端(3873824~3874156)同源臂,分别命名为pPCR1和pPCR2。在pPCR1两端引入酶切位点SalⅠ和BamHⅠ;在pPCR2上游引入酶切位点SalⅠ,下游引入酶切位点HindⅢ和EcoRⅠ。然后,将pPCR1和pPCR2依次克隆至pUC19载体质粒的相应位置,pPCR1、pPCR2相邻插入pUC19载体质粒。应用酶切位点HindⅢ,将pPCR1、pPCR2整体从pUC19中切下并连接至质粒pJQ200mp18-rpsl中,获得质粒pJQ-PCR1/2。将质粒pJQ-PCR1/2电转入BPMM中,用血平板进行筛选。pJQ-PCR1/2转入BPMM后,质粒上携带的片段pPCR1与BPMM中的同源PCR1自发进行第1轮同源重组,此时pJQ插入BPMM,使BPMM携带庆大霉素抗性而失去链霉素抗性,在血平板上表现为菌株在庆大霉素血平板上生长而不能在链霉素平板上生长。在链霉素筛选压力下,BPMM进行第2轮同源重组,即质粒上携带的片段pPCR2与BPMM中的同源pPCR2重组,pJQ200mp18-rpsl脱离BPMM基因组并降解,BPMM失去庆大霉素抗性,获得链霉素抗性,在血平板上表现为菌株在链霉素平板上生长而不能在庆大霉素血平板上生长。
表1PCR引物序列
Tab.1SequencesofPCRprimers

GenePrimerSequence(5′→3′)ptxpPCR1⁃FACGCGTCGACTTCGTCGCCTCGCCCTGGTTpPCR1⁃RCGGGATCCGCGTTTCGGTGGTGCCTATpPCR2⁃FCGGGATCCTTCCAGACCTATGCCCTCACCpPCR2⁃RGGAATTCAAGCTTCGGAACAGCAGCTTGTAGCCPY⁃F1AAGGGAACCGACCCCAAGATAPY⁃R1ACTCGCACCACGTCCAGCACAdntdPCR1⁃FACGCGTCGACCGCACCGTAACCGTTGGTdPCR1⁃RCGGGATCCGCAATGCCGATTCATCTTTATdPCR2⁃FCGGGATCCTGATTTCCAACGACGGACAAGGdPCR2⁃RGGAATTCAAGCTTCCGAGGTGCTGACCAACGAGampG(B.pertussis)aPCR1⁃FACATGCATGCGGCGATTCCGTACAGCGTGACAaPCR1⁃RGCTCTAGACGCGCTGCCCGGGTTATGaPCR2⁃FCGGGATCCCGGCACGTAGCGGTCGATGAaPCR2⁃RGGAATTCAAGCTTTGCTGGTGCTGGGCTTTGCampG(E.coli)AmpG⁃FGCTCTAGAGCCCATGTCCAGTCAATATTTACGAmpG⁃RCGGGATCCCAGATTACGTCAGATGCGTTTTTC
The cutting sites of restriction endonucleases were in italic.
第2个毒力基因dnt的敲除原理和步骤与ptx相同。PCR获得dnt的N端(3985341~3985517)、C端(3989759~3990089)同源臂,分别命名为dPCR1和dPCR2。
第3个基因ampG的置换采用E.coliDH5α的ampG基因替换野生型百日咳鲍特菌的ampG。简言之,构建一个含有E.coliDH5αampG的自杀性质粒,在E.coliDH5αampG5′端插入BPMMampG的上游片段(3509798~3510074),命名为aPCR1;在E.coliDH5αampG3′端插入BPMMampG的下游片段(3511028~3511200),命名为aPCR2。将自杀性质粒电转至百日咳鲍特菌中,通过两次连续同源重组,在相应培养基上获得ampG置换的百日咳鲍特菌。
最后,通过PCR和测序来验证3种基因的敲除。
1.2.3蛋白免疫印迹法检测采用蛋白免疫印迹法检测百日咳鲍特菌主要毒力因子PTX的表达。取对数期生长的百日咳鲍特菌液,5 000g离心 1 min,弃上清液,加入250 μL双蒸水重悬菌体;再加入250 μL 2×十二烷基硫酸钠(sodium dodecyl sulfate,SDS) Loading Buffer,100 ℃ 煮10 min;用1 mL注射器针头吸打数次切断DNA,100 ℃ 再煮15 min,制成SDS-聚丙烯酰胺凝胶电泳(SDS-polyacrylamide gel electrophoresis,SDS-PAGE)样品。一抗为兔多克隆Anti-Bordetellapertussistoxin抗体(Abcam公司),稀释度1∶2 000;二抗为碱性磷酸酶(alkaline phosphatase,AP)标记的羊抗兔IgG(Anti-rabbit IgG)抗体(Sigma公司),稀释度1∶10 000。5-溴-4-氯-3-吲哚磷酸/氯化硝基四氮唑蓝(5-bromo-4-chloro-3-indolyl phosphate/nitrotetrazolium blue chloride,BCIP/NBT)室温下避光显色5~15 min。
1.2.4动物感染和百日咳鲍特菌定植曲线测定实验小鼠为5周龄无特定病原体(specific pathogen free,SPF)级雌性BALB/c小鼠(由上海斯莱克实验动物有限责任公司提供)。动物实验遵守实验动物福利伦理原则。从链霉素抗性血平板上(37 ℃,4 d)刮下百日咳鲍特菌,悬浮于无菌、含5%吐温80的磷酸盐缓冲液(phosphate buffered saline with 5% Tween 80,PBST)中,混合均匀后测OD600值,换算成相应的百日咳鲍特菌密度(1OD=2×108CFU/mL)。麻醉小鼠,用枪头从小鼠两侧鼻腔缓缓滴入5×106CFU 百日咳鲍特菌,感染后 3 h、3 d、7 d、10 d、17 d取小鼠肺,放入装有500 μL PBS和3个小磁珠的1.5 mL离心管中,用高通量组织破碎仪(上海万柏生物科技有限公司)研磨均匀(60 Hz,90 s)。用PBS按10倍梯度法稀释至一定倍数后,取100 μL涂于链霉素抗性血平板上,37 ℃培养5 d后计数。
1.2.5肺部病理实验5周龄实验小鼠每只接种20 μL 含1×106CFU的百日咳鲍特菌BPTM1或BPMM,对照组小鼠给予20 μL PBST。感染7 d后,取肺,浸泡于PBS配制的4%多聚甲醛溶液,固定1~2 d,包埋,切片,苏木精-伊红(haematoxylin-eosin,HE)染色并分析。
1.2.6体液免疫反应的检测收集正常小鼠和百日咳鲍特菌感染小鼠后不同时间点(3 h、3 d、7 d、10 d、17 d)的眼眶血,离心获得抗血清,采用酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)检测百日咳鲍特菌特异性IgG及其亚型IgG1和IgG2a。包被抗原的制备:百日咳鲍特菌液体培养物用PBS洗涤后进行超声破碎(190 W,4 s开,6 s关,39个循环),4 ℃ 14 000g离心30 min,取上清液即得抗原液。用Nanodrop2000分光光度计检测蛋白总浓度。二抗为1∶10 000稀释的辣根过氧化物酶(horseradish peroxidase,HRP)标记的二抗IgG及其亚型IgG1和IgG2a ;底物为四甲基联苯胺(tetramethyl benzidine,TMB)。按抗原包被、洗板、封闭、洗板、加抗血清、洗板、加二抗、加底物、终止反应等步骤进行操作,酶标仪上读取OD450值。当OD值大于规定的阴性对照OD值2倍时,即为阳性。
2 结果
2.1 减毒百日咳鲍特菌BPTM1的构建
本实验利用同源重组方法敲除了百日咳鲍特菌BPMM的重要毒力因子PTX和DNT,同时置换了编码负责TCT重吸收的ampG基因,降低了TCT的释放。将获得的减毒百日咳鲍特菌命名为BPTM1。以BPMM和BPTM1的全基因组DNA为模板,以ptx基因的上下游引物PY-F1、PY-R1进行PCR,如图1A所示,BPMM扩增条带大小为 3 892 bp,BPTM1扩增条带大小为814 bp。以dnt基因的上下游引物dPCR1-F、dPCR2-R进行PCR,琼脂糖凝胶电泳见图1B,BPMM扩增条带大小为4 749 bp,BPTM1扩增条带大小为508 bp。以百日咳鲍特菌ampGN端aPCR1-F为上游引物,E.coliAmpG-R为下游引物,BPMM扩增未获得条带,BPTM1扩增获得条带大小为1 761 bp。目的条带大小均与预期一致,证明BPTM1的ptx和dnt基因被删除,且ampG被替换成E.coliampG。以上结果表明,减毒百日咳鲍特菌BPTM1构建成功。
在百日咳鲍特菌感染过程中,PTX是一个非常重要的毒力因子,其S1亚基毒力最强,相对分子质量为 23 000左右。以BPTM1和BPMM菌体为抗原,以Anti-Bordetellapertussistoxin为一抗,Anti-rabbit IgG为 二抗,采用蛋白免疫印迹法检测S1的表达。结果如图2所示,与对照组相比,BPTM1在相对分子质量23 000左右未检测到明显条带,表明BPTM1的毒素表达显著降低。
2.2 BPTM1体外生长和体内定植能力与野生型相当
PTX、DNT和TCT是百日咳鲍特菌的重要组成部分,敲除相关基因和减少释放可能影响细菌的生长能力。检测BPTM1和BPMM的体外生长曲线,结果如图3A所示,百日咳鲍特菌BPTM1与野生型BPMM的生长能力几乎一致。

图1PCR鉴定减毒百日咳鲍特菌BPTM1
Fig.1IdentificationofattenuatedBordetellapertussisBPTM1byPCR
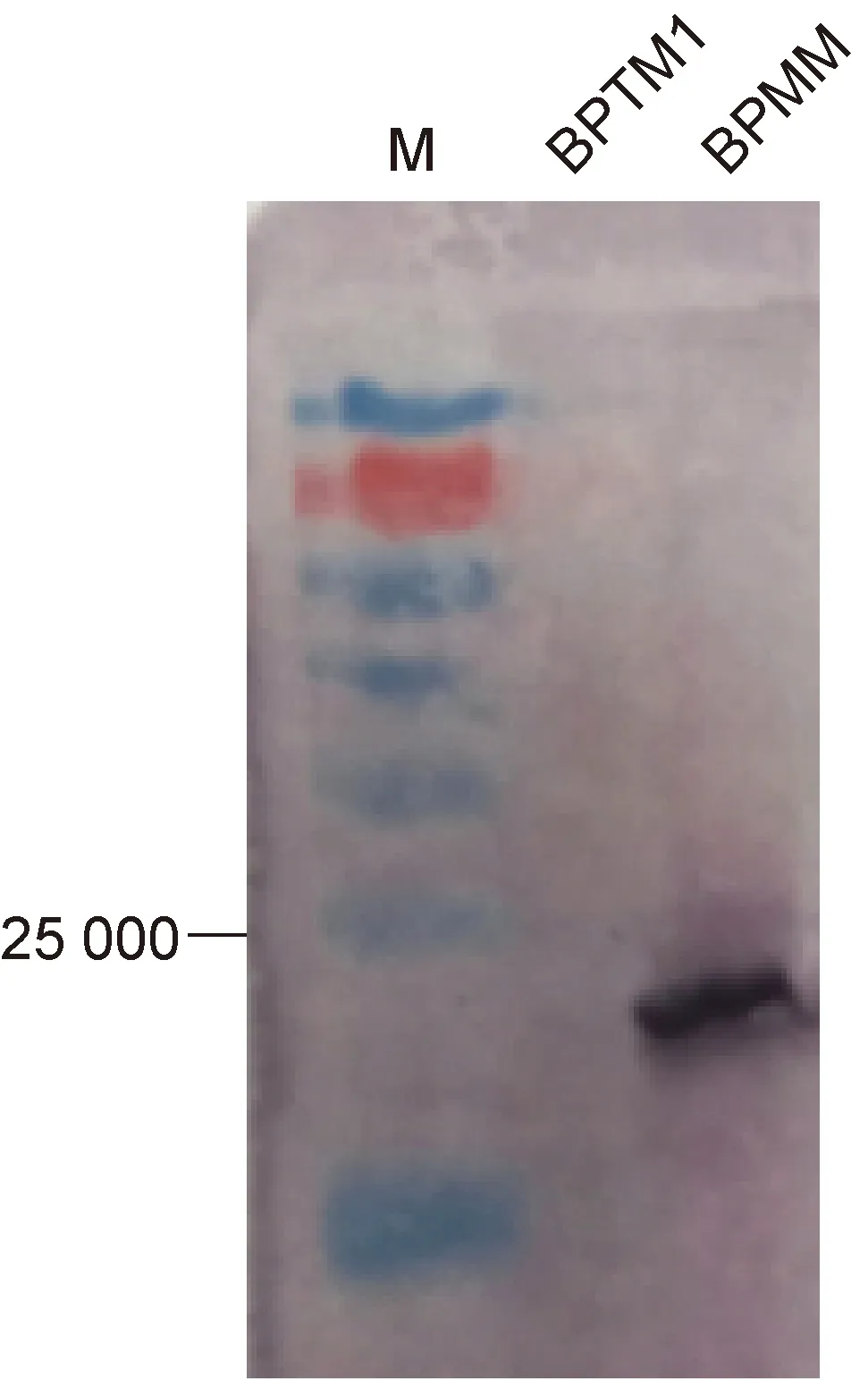
图2蛋白免疫印迹法检测PTX的表达
Fig.2PTXexpressionassayedbyWesternblotting
百日咳鲍特菌在体内的定植效率关系着其体内诱导产生的免疫反应。分别用BPTM1和BPMM感染小鼠,于3 h、3 d、7 d、10 d、17 d后取小鼠肺,研磨稀释后涂于链霉素抗性血平板,37 ℃培养7 d,计数。结果如图3B所示,BPTM1在小鼠肺部的定植率几乎与野生型菌株同样高效。
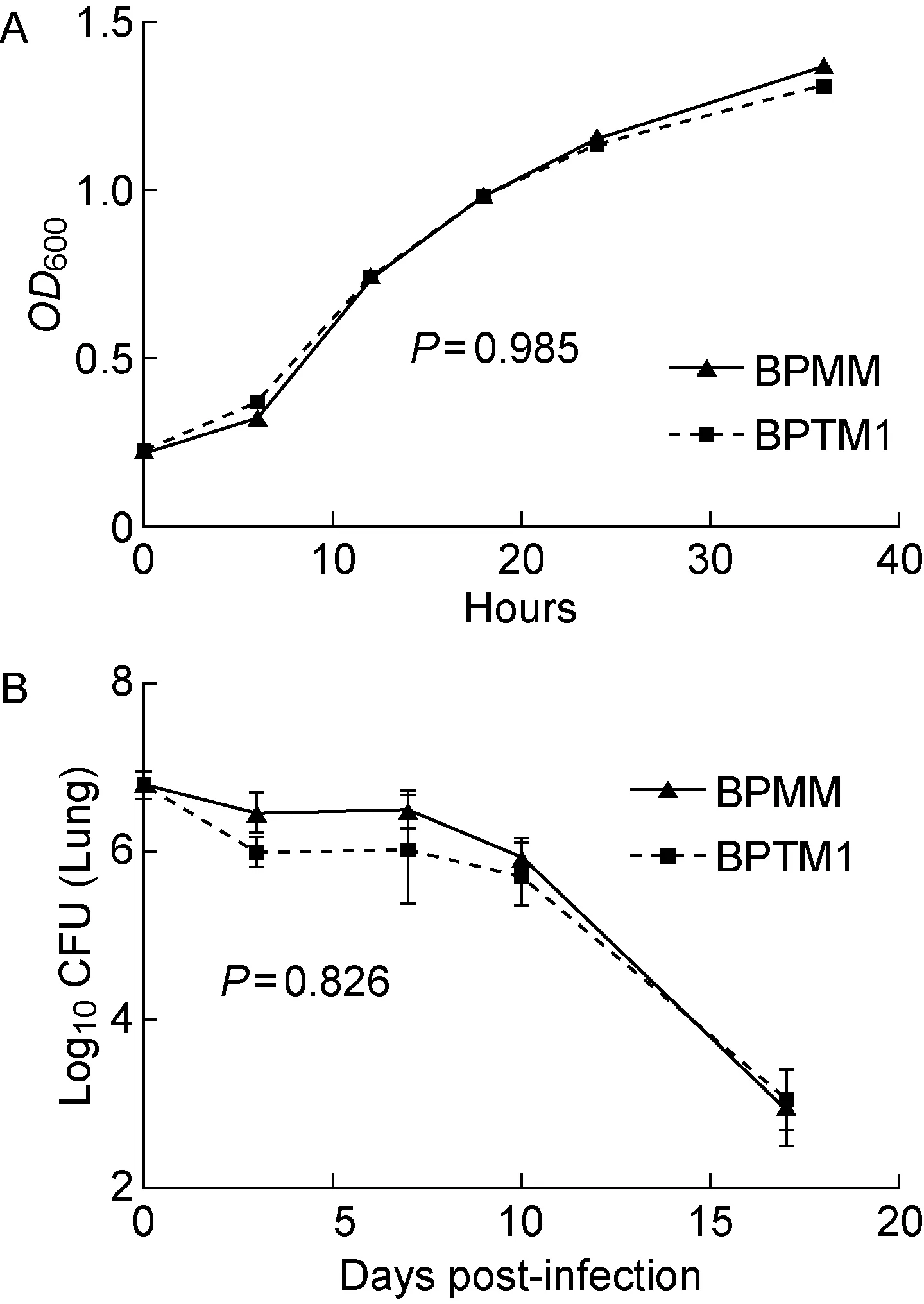
图3减毒百日咳鲍特菌BPTM1的体外和体内生长曲线
Fig.3GrowthcurvesofattenuatedBordetellapertussisBPTM1invitro(A)andinvivo(B)
2.3 BPTM1能明显减轻肺部病理
实验组每只小鼠鼻腔感染 20 μL含1×106CFU BPTM1和BPMM的菌液,对照组小鼠通过鼻腔给予20 μL PBST。感染7 d后,取肺组织进行HE染色分析。如图4所示,野生型BPMM感染小鼠显示出严重的肺损伤,肺血管内皮损伤严重,血管周围水肿明显,肺脏中肺泡广泛遭到破坏,细胞破碎,肺间质存在炎性细胞的强烈浸润。而减毒BPTM1感染小鼠肺脏中肺泡结构正常,腔内无渗出物,肺间质几乎无炎性细胞浸润,与对照组小鼠肺结构非常接近。结果表明,与野生型百日咳鲍特菌BPMM相比,减毒BPTM1感染小鼠的肺部病理明显减轻。
图4BPMM和BPTM1感染7d后小鼠肺组织病理分析
Fig.4HistologicalanalysisoflungsfromBPMM-orBPTM1-infectedmiceat7dpost-infection
2.4 BPTM1诱导的免疫保护作用
检测BPMM与BPTM1感染小鼠7 d、10 d、17 d后血清中抗百日咳鲍特菌IgG、IgG1和IgG2a抗体水平。结果显示,感染7 d、10 d后,减毒株BPTM1诱导的3种抗体水平与野生型组无显著差异(数据未显示)。感染17 d后,BPTM1感染小鼠体内百日咳鲍特菌特异性总IgG和IgG1水平与野生型组也几乎无差异,但百日咳鲍特菌特异性IgG2a水平显著高于野生型组(图5)。

图5BPMM和BPTM1感染17d后小鼠血清中各抗体水平
Fig.5AntibodylevelsinserumofBPMM-orBPTM1-infectedmiceat17dpost-infection
3 讨论
百日咳一直被认为是一种已得到有效控制的传染病,但近年来百日咳疫情相继在许多国家和地区重现,传统的百日咳疫苗和接种方法并不如人们想象得那般完美。全细胞百日咳疫苗(whole cell pertussis vaccine,WPV)是最初使用的百日咳疫苗,但由于其频频出现不良反应,不少国家已停止使用。无细胞百日咳疫苗(acellular pertussis vaccine,APV)是被大多数国家“寄予厚望”的替代疫苗,在有些发达国家已全面使用,中国也在尝试推广中[15-16]。但APV效力低下,费用高,不能有效阻断百日咳传播[17],引入APV的国家产生大量突变株(缺失毒力因子PRN、PTX或FHA等)[18],且出现百日咳重现和大暴发的比例高于使用WPV的国家。由于WPV和APV均存在明显的缺陷,研发新的百日咳疫苗迫在眉睫。自然的百日咳感染能诱导强烈而持久的免疫保护作用[19],因此可推测,预防百日咳感染的最好疫苗应是百日咳减毒活疫苗。
BPZE1是目前较被广泛认可的百日咳减毒株[9]。其能保持高效定植于小鼠肺部的能力和诱导针对百日咳鲍特菌感染的免疫功能,感染动物中肺部炎症显著减少。本研究获得的减毒百日咳鲍特菌BPTM1,无论是在定植能力还是在减轻肺部炎症程度上均可与BPZE1媲美。但遗憾的是,本研究未能获得BPZE1菌株,不能进行直观比较;而研制BPTM1的初衷也包括获得具有自主知识产权的减毒百日咳鲍特菌。
本研究利用同源重组方法敲除了ptx和dnt,并用E.coliDH5αampG基因替换原有的ampG序列,成功构建了一株减毒百日咳鲍特菌BPTM1。在DNA水平上用PCR技术验证了这3种基因的敲除或替换,且蛋白免疫印迹法检测表明百日咳鲍特菌主要毒力因子PTX的S1亚基消失。体外生长曲线和体内定植曲线均表明,减毒百日咳鲍特菌BPTM1的生长和定植能力没有受影响,几乎与野生型菌株同样高效。相比于野生型菌株BPMM,BPTM1能在明显减轻肺部病理的条件下诱导同样高水平的百日咳鲍特菌特异性IgG和IgG1抗体,且BPTM1诱导的IgG2a抗体水平更高。
本研究敲除了整个ptx基因(3 000多bp),结果表明,即使敲除整个ptx序列也未影响BPTM1的体内定植。相比于只将有酶活性的基因进行突变,敲除整个ptx基因将使菌株更安全,如果以后发展为人用疫苗也必然更安全、可控。有研究表明,PTX能提高转化生长因子β(transforming growth factor β,TGF-β)和白细胞介素10(interleukin 10,IL-10)血清水平,促进CD4+CD25+FoxP3+调节 T 细胞(regulatory T cell,Treg)产生[20]。Treg的增加会抑制免疫反应,不利于疫苗发挥作用[21]。本研究观察到,BPTM1诱导的百日咳鲍特菌特异性IgG2a水平显著高于野生型组,这种现象在BPZE1中未见报道[7]。推测这是由于毒力因子PTX被删除,Treg产生减少,从而导致免疫水平提高。
减毒百日咳鲍特菌BPTM1鼻腔接种方式也显示了其明显的优越性,这种无针接种降低了感染的概率。BPTM1可通过培养大量获取,成本低廉且工艺简单。此外,减毒百日咳鲍特菌有超出针对百日咳的其他附加价值和潜在作用——有可能被用作将异源抗原递送至呼吸道的有效活疫苗和载体[22],也可能提供对抗甲型流感病毒致死攻击的交叉保护等[23]。将ptx完全敲除的BPTM1能更安全、更好地发挥其附加价值。
当然,要想成为一株人用疫苗还有待开展更多研究。ptx、dnt敲除势必会影响保护性抗体的产生,故后续实验将检测BPTM1诱导的细胞免疫保护能力,并进行保护实验验证其作为疫苗的潜力,或对BPTM1行进一步基因改造,探索构建新型高效百日咳减毒疫苗的其他方法。目前,我国对减毒百日咳鲍特菌的研究非常少,而减毒微生物疫苗会在未来成为一种趋势。BPTM1的研究为新型百日咳疫苗及其他疫苗的构建提供了思路。
[1] Cherry JD.Epidemic pertussis in 2012—the resurgence of a vaccine-preventable disease [J].N Engl J Med,2012,367(9): 785-787.
[2] Melvin JA,Scheller EV,Miller JF,Cotter PA.Bordetella pertussis pathogenesis: current and future challenges [J].Nat Rev Microbiol,2014,12(4): 274-288.
[3] Clark TA.Changing pertussis epidemiology: everything old is new again [J].J Infect Dis,2014,209(7): 978-981.
[4] 王增国,马超锋,闫永平.全球百日咳重现及中国百日咳相关研究现状 [J].中国疫苗和免疫,2016,22(3):345-349.
[5] Tan T,Dalby T,Forsyth K,Halperin SA,Heininger U,Hozbor D,Plotkin S,Ulloa-Gutierrez R,Wirsing von König CH.Pertussis across the globe: recent epidemiologic trends from 2000 to 2013 [J].Pediatr Infect Dis J,2015,34(9): e222-e232.
[6] Stein PE,Boodhoo A,Armstrong GD,Heerze LD,Cockle SA,Klein MH,Read RJ.Structure of a pertussis toxin-sugar complex as a model for receptor binding [J].Nat Struct Biol,1994,1(9): 591-596.
[7] Tamura M,Nogimori K,Murai S,Yajima M,Ito K,Katada T,Ui M,Ishii S.Subunit structure of islet-activating protein,pertussis toxin,in conformity with the A-B model [J].Biochemistry,1982,21(22): 5516-5522.
[8] Sekura RD,Fish F,Manclark CR,Meade B,Zhang YL.Pertussis toxin.Affinity purification of a new ADP-ribosyltransferase [J].J Biol Chem,1983,258(23): 14647-14651.
[9] Mielcarek N,Debrie AS,Raze D,Bertout J,Rouanet C,Younes AB,Creusy C,Engle J,Goldman WE,Locht C.Live attenuated B.pertussis as a single-dose nasal vaccine against whooping cough [J].PLoS Pathog,2006,2(7): e65.
[10] Cookson BT,Tyler AN,Goldman WE.Primary structure of the peptidoglycan-derived tracheal cytotoxin of Bordetella pertussis [J].Biochemistry,1989,28(4): 1744-1749.
[11] Flak TA,Goldman WE.Signalling and cellular specificity of airway nitric oxide production in pertussis [J].Cell Microbiol,1999,1(1): 51-60.
[12] Heiss LN,Moser SA,Unanue ER,Goldman WE.Interleukin-1 is linked to the respiratory epithelial cytopathology of pertussis [J].Infect Immun,1993,61(8): 3123-3128.
[13] Luker KE,Collier JL,Kolodziej EW,Marshall GR,Goldman WE.Bordetella pertussis tracheal cytotoxin and other muramyl peptides: distinct structure-activity relationships for respiratory epithelial cytopathology [J].Proc Natl Acad Sci USA,1993,90(6): 2365-2369.
[14] Weyrich LS,Feaga HA,Park J,Muse SJ,Safi CY,Rolin OY,Young SE,Harvill ET.Resident microbiota affect Bordetella pertussis infectious dose and host specificity [J].J Infect Dis,2014,209(6): 913-921.
[15] 谢广中,Xie GZ.无细胞百日咳疫苗的发展及应用 [J].上海预防医学,2006,18(1):6-8.
[16] 章金勇,张晓丽,邹全明.百日咳基因工程疫苗的研究进展 [J].中国生物制品学杂志,2008,21(3):248-250,256.
[17] Warfel JM,Zimmerman LI,Merkel TJ.Acellular pertussis vaccines protect against disease but fail to prevent infection and transmission in a nonhuman primate model [J].Proc Natl Acad Sci USA,2014,111(2): 787-792.
[18] Polak M,Lutyńska A.The importance of Bordetella pertussis strains which do not produce virulence factors in the epidemiology of pertussis [J].Postepy Hig Med Dosw (Online),2017,71(1): 367-379.
[19] Mascart F,Verscheure V,Malfroot A,Hainaut M,Piérard D,Temerman S,Peltier A,Debrie AS,Levy J,Del Giudice G,Locht C.Bordetella pertussis infection in 2-month-old infants promotes type 1 T cell responses [J].J Immunol,2003,170(3): 1504-1509.
[20] Weber MS,Benkhoucha M,Lehmann-Horn K,Hertzenberg D,Sellner J,Santiago-Raber ML,Chofflon M,Hemmer B,Zamvil SS,Lalive PH.Repetitive pertussis toxin promotes development of regulatory T cells and prevents central nervous system autoimmune disease [J].PLoS One,2010,5(12): e16009.
[21] 王娜.CD4+CD25+调节性T细胞免疫抑制及其在疫苗免疫保护中作用的研究进展 [J].医学综述,2012,18(22):3740-3742.
[22] Li R,Lim A,Alonso S.Attenuated Bordetella pertussis BPZE1 as a live vehicle for heterologous vaccine antigens delivery through the nasal route [J].Bioeng Bugs,2011,2(6): 315-319.
[23] Li R,Cheng C,Chong SZ,Lim AR,Goh YF,Locht C,Kemeny DM,Angeli V,Wong WS,Alonso S.Attenuated Bordetella pertussis BPZE1 protects against allergic airway inflammation and contact dermatitis in mouse models [J].Allergy,2012,67(10): 1250-1258.
