肝细胞肝癌肿瘤相关成纤维细胞的分离培养及鉴定*
2018-02-28胡书娅郭庆喜刘祖平杨成万
胡书娅,郭庆喜,杨 楠,刘祖平,杨成万,蒲 霞
肿瘤的生长、侵袭和转移不仅源于肿瘤细胞的增殖、凋亡和突变等,还与肿瘤微环境密切相关[1],肿瘤微环境成分复杂,其中活化的成纤维细胞被称为肿瘤相关成纤维细胞(carcinoma-associated fibro⁃blasts,CAFs),它通常来源于静止的成纤维细胞、骨髓间充质干细胞的分化、血管周细胞的分化、上皮-间质转化以及内皮-间质转化[2],具有独特的细胞表型和生物学行为,是肿瘤微环境中最重要的宿主细胞之一[3]。原代培养的肝细胞肝癌CAFs接近和反映体内生长的特性,是进一步研究肝细胞癌CAFs本身的基因表达和生物学特性以及它与肝癌细胞之间的相互作用的理想模型。本实验旨在建立一种有效的原代CAFs的培养方法。
1 材料与方法
1.1 主要试剂
胎牛血清(FBS)购自美国Sciencell公司;DMEM/F12培养基购自美国Hyclone公司;胰蛋白酶消化液和双抗(青链霉素液)购自Biodder公司;磷酸盐缓冲液(PBS)购自北京中杉金桥生物技术有限公司;L-谷氨酰胺购自北京索莱宝科技有限公司;细胞培养使用含20%FBS+1%双抗+1%L-谷氨酰胺的完全培养基;波形蛋白(vimentin)、α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)多克隆抗体购自福州迈新生物技术开发有限公司,成纤维细胞活化蛋白(fibroblast activation protein,FAP)多克隆抗体购自Abcam公司。细胞爬片盖玻片使用24孔板专用细胞爬片。
1.2 标本来源及采集
所取组织来源于西南医科大学附属医院肝胆外科手术切除标本,术后病理诊断为低分化肝细胞性肝癌。标本获取前已取得本人知情同意。标本于手术切除离体后,用无菌手术刀片切取体积大于1 cm3的新鲜组织块,生理盐水冲洗3次后,置于含DMEM/F12+1%双抗的50 ml离心管内,于冰盒中运输至实验室。
1.3 CAFs的培养、分离纯化
超净台内,用含双抗的PBS液反复漂洗组织,剔除多余的血管、脂肪、筋膜及坏死组织等,用无菌眼科剪将组织剪成1 mm3左右的组织块,PBS反复冲洗。将组织块均匀放入预铺血清的培养瓶中,于培养箱中放置1 h后,翻转培养瓶倒置培养12 h,然后加入完全培养基,正置继续培养。
在细胞生长密度达80%~90%时进行细胞传代。去除组织块,PBS清洗细胞3次,常规1∶2传代,再次长满后进行分离纯化传代。根据成纤维细胞与肿瘤细胞生长速度及贴壁能力的差异,应用差速酶消化法联合反复贴壁法纯化细胞。经3次传代后可获得纯化的CAFs。
1.4 CAFs的鉴定
1.4.1 细胞形态观察
倒置相差显微镜下观察细胞的贴壁、生长状况及形态变化并拍照。
1.4.2 免疫细胞化学染色
将无菌圆形盖玻片(直径14 mm)放在24孔板中,细胞消化后制成2×105个/mL的细胞悬液,滴加在盖玻片上,使其不溢出盖玻片,将孔板放入培养箱2 h使细胞贴壁后,每孔补加1 mL完全培养基继续培养。培养至细胞达70%融合时进行免疫细胞化学染色鉴定。除去培养液,PBS漂洗3次(每次5 min),将盖玻片放入丙酮中固定20 min。
免疫化学染色采用S-P法,具体方法如下:细胞爬片PBS洗5 min,3次;加一抗(vimentin、α-SMA、FAP)4 ℃孵育4 h,PBS洗5 min,3次;加二抗工作液,37℃孵育1 h,PBS洗5 min,3次;常规 DAB 显色,苏木素复染、脱水、透明、封片。用PBS代替一抗作阴性对照;细胞浆或细胞膜中的棕黄色颗粒判定为阳性染色。
2 结果
2.1 细胞纯化与培养
培养第4 d可见细胞从组织边缘游出(图1A),最快20 d长满瓶底,此时见成纤维细胞团围绕上皮细胞团分区生长(图1B)。经过纯化,第4代细胞几乎不见上皮样细胞存在(图1C)。CAFs细胞大小不等,多呈梭形或星芒状,有多个突起,核为圆形或卵圆形,部分细胞呈漩涡状排列。
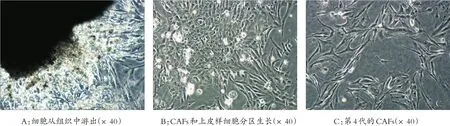
图1 显微镜下CAFs的形态
2.2 免疫细胞化学染色
CAFs表达vimentin、α-SMA、FAP,均为胞浆着色,呈棕黄色颗粒状(图2)。
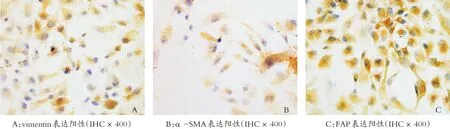
图2 免疫组化结果
3 讨 论
随着1989年Paget提出肿瘤的“种子与土壤”学说以来,代表“土壤”的肿瘤微环境就成为学者们研究的热点,而CAFs是影响肿瘤生长最重要的“土壤”。大量研究表明,CAFs可促进血管生成、免疫抑制、激活信号通路、促使肿瘤细胞发生上皮-间质转化,还可通过细胞-细胞直接接触、分泌细胞因子、修饰细胞外基质成分等多种方式促进肿瘤的发生发展、侵袭和转移,增加肿瘤细胞的恶性表型[4-7]。众所周知,大部分的肝细胞癌发生于肝纤维化或肝硬化,针对CAFs的靶向治疗不仅能抑制纤维化,还能抑制肝癌的进展[8]。随着研究的不断深入,有学者发现CAFs的基因组比肿瘤细胞更稳定,不易耐药,将有望成为肿瘤化疗的新靶点[2,9]。Dourado等[10]还强调CAFs在口腔鳞状细胞癌中可被视为一个有用的预后指标。CAFs在肿瘤微环境中扮演重要角色,成为研究热点,而获得纯化的CAFs为前提。因此CAFs的原代培养、纯化和鉴定是有必要的。
目前国内外对CAFs的原代培养主要采取组织块贴壁法和酶消化法。本实验通过组织块贴壁法获得成功。组织块贴壁法是将小块状组织贴在培养瓶或培养皿壁上进行恒温培养,部分细胞会从组织中游出然后贴壁生长。该方法操作简便,易于掌握,无需特殊试剂或器材,不损伤细胞,可重复率高。缺点是细胞迁出贴壁的周期相对较长。
酶消化法是利用消化酶将组织中的细胞分散,形成单细胞悬液,再进行过滤、离心、接种的方法。胰酶主要用于消化上皮成分多而间质少的组织,可以联合EDTA进行消化;而胶原酶对细胞的间质有很好的消化作用,消化能力较胰酶弱。酶消化法有以下缺点:①酶处理时间和酶浓度难掌控。消化时间过长或酶浓度过高可导致细胞活性下降,贴壁率低,消化时间过短或酶浓度低将造成收集的可用细胞少。有学者通过不同消化时间和不同浓度梯度的预实验,来确定乳腺癌酶消化的最佳消化时间和最佳浓度[11],这无疑增加了实验的复杂性;②酶解离细胞时容易导致细胞破损,使获得的细胞状态欠佳;③步骤繁琐,更易污染。
无论哪一种原代培养方法,最终所得的原代细胞都是多种细胞混杂存在,因此细胞的分离纯化就成了原代培养中关键的一步。原代细胞的分离纯化方法有自然纯化法、机械刮除法、差速酶消化法、反复贴壁法和磁珠分选等。培养初期,肝癌细胞分散或成片生长在CAFs中,可使用差速酶消化法联合反复贴壁法纯化细胞;胰酶消化过程中发现上皮样细胞比成纤维细胞先脱壁,因此可在上皮样细胞脱壁后倒出胰蛋白酶消化液,PBS液洗涤后将原培养瓶继续培养;或者再加入胰酶消化剩下的细胞,将细胞悬液用不同时间梯度贴壁,观察到成纤维细胞贴壁时间更短。需要指出的是,不同肿瘤组织中上皮细胞和成纤维细胞对胰蛋白酶的反应不同,例如,消化喉和口腔肿瘤的混杂细胞时,CAFs就比鳞状细胞癌细胞先脱壁[12]。另外,可利用成纤维细胞的优势生长进行自然纯化[13]。机械刮出法适用于大范围细胞的筛选,对小区域的污染细胞效果不佳。免疫磁珠分选法和流式细胞仪分选法的纯化速度快,但费用相当昂贵,而且分选过程中可能造成细胞活性下降甚至裂解死亡,导致继续培养困难[14]。本实验中,采用差速酶消化法联合反复贴壁法获得了CAFs。
肿瘤相关成纤维细胞即为肿瘤间质中活化的成纤维细胞,其在形态和生物学行为上具有平滑肌细胞和成纤维细胞的双重特性。vimentin是间充质细胞和中胚层来源细胞(如成纤维细胞)中间丝的主要结构蛋白[15],该表达阳性,提示CAFs可能为成纤维细胞来源。另外CAFs还表达自身的特异性蛋白FAP和α-SMA,其表达结果和文献报道一致[16-17],证实我们建立的细胞为纯度高的CAFs。
原代CAFs分离培养还要注意几个关键问题:①所取组织要选取较典型区域,避开出血坏死区,离体后迅速取材,低温运输;②整个实验过程严格无菌操作,用含双抗的PBS液多次漂洗组织,可达到很好的灭菌作用;③原代培养的完全培养基中应加入高浓度的胎牛血清,不应低于20%,另外可加入一些利于细胞生长的因子,如谷氨酰胺;④爬片时滴加的细胞悬液不要溢出盖玻片,否则细胞会生长在孔板上;⑤分离时可联合多种纯化方法,起到最显著的作用;⑥组织块贴壁时,完全培养基以刚好浸润组织为宜,不宜过多。
4 结论
本研究通过组织块贴壁法成功培养、分离纯化出原代肝细胞肝癌CAFs,实验具有可重复性,获得了高活力、高纯度的细胞,为后续研究提供了良好的细胞模型,也为肝细胞肝癌的发生、发展和针对CAFs的靶向治疗提供了手段。
1. Affo S,Yu LX,Schwabe RF.The role of cancer-associ⁃ated fibroblasts and fibrosis in liver cancer[J].Annu Rev Pathol,2017,12:153-186.
2. Luo HJ,Tu G,Liu ZM,et al.Cancer-associated fibro⁃blasts:a multifaceted driver of breast cancer progression[J].Cancer Lett,2015,361(1):155-163.
3. Sukowati CH,Anfuso B,Croce LS,et al.The role of multipotent cancer associated fibroblasts in hepatocarcino⁃genesis[J].BMC Cancer,2015,15:188.
4. Yang J,Lu Y,Lin YY,et al.Vascular mimicry forma⁃tion is promoted by paracrine TGF-and SDF1 of can⁃cer-associated fibroblasts and inhibited by miR-101 in he⁃patocellularcarcinoma[J].CancerLett,2016,383(1):18-27.
5. Deng Y,Cheng J,Fu B,et al.Hepatic carcinoma-asso⁃ciated fibroblasts enhance immune suppression by facilitat⁃ing the generation of myeloid-derived suppressor cells[J].Oncogene,2017,36(8):1 090-1 101.
6. Yamamura Y,Asai N,Enomoto A,et al.Akt-girdin sig⁃naling in cancer-associated fibroblasts contributes to tu⁃mor progression[J].Cancer Res,2015,75(5):813-823.
7. Yu Y,Xiao CH,Tan LD,et al.Cancer-associated fibro⁃blasts induce epithelial-mesenchymal transition of breast cancer cells through paracrine TGF-signalling[J].Br J Cancer,2014,110(3):724-732.
8. Liu J,Chen S,Wang W,et al.Cancer-associated fibro⁃blasts promote hepatocellular carcinoma metastasis through chemokine-activatedhedgehogandTGF-pathways[J].Cancer Lett,2016,379(1):49-59.
9. Takai K,Le A,Weaver VM.Targeting the cancer-asso⁃ciated fibroblasts as a treatment in triple-negative breast cancer[J].Oncotarget,2016,7(50):82 889-82 901.
10. Dourado MR,Guerra ENS,Salo T,et al.Prognostic val⁃ue of the immunohistochemical detection of cancer-asso⁃ciated fibroblasts in oral cancer:a systematic review and meta-analysis[J].JOral Pathol Med,2017,doi:10:1111/jop.12 623.
11. 彭琼乐,孙艳,赵浏阳,等.人乳腺癌相关成纤维细胞的原代培养及其生物学特性[J].中国生物制品学杂志,2012,25(10):1 368-1 372.
12. 周美玲,李传祝,王琼,等.人口腔癌相关成纤维细胞的分离培养及鉴定[J].口腔生物医学,2016,7(2):57-61.
13. 王正彩,翟丽丽,杨迷玲,等.人胃癌肿瘤相关成纤维细胞的原代培养和鉴定[J].临床与实验病理学杂志,2011,27(8):860-862,868.
14. 杨柳晓,高强.肝内胆管细胞癌相关成纤维细胞的分离、纯化及鉴定[J].中国临床医学,2016,23(2):131-135.
15. 周伟,李妙龄,范学慧,等.人心房成纤维细胞的体外培养与鉴定[J].泸州医学院学报,2016,39(06):523-526.
16.Yan Y,Wang RF,Guan WB,et al.Roles of microR⁃NAs in cancer associated fibroblasts of gastric cancer[J].Pathol Res Pract,2017,213(7):730-736.
17. Ji X,Ji J,Shan F,et al.Cancer-associated fibroblasts from NSCLC promote the radioresistance in lung cancer cell lines[J].Int J Clin Exp Med,2015,8(5):7 002-7 008.
