胶质瘤CD133+肿瘤干细胞反应性T细胞株的建立及其杀伤功能的检测*
2018-02-28尹甲伟王丽娟车峰远衡雪源
李 根,尹甲伟,王丽娟,车峰远,4,衡雪源
胶质瘤是发病率最高的原发性颅内肿瘤[1]。胶质瘤的病理分类十分复杂,分为星形细胞瘤、髓母细胞瘤、多形胶母细胞瘤、室管膜瘤、少枝胶母细胞瘤等。WHO分类将胶质瘤分为I~IV四个级别[2]。近年来,尽管手术切除、放疗及化疗等治疗手段取得了一定的效果,胶质瘤的生长依然活跃,治疗效果仍然较差。因手术难以完全根除肿瘤床周边的肿瘤组织,术后肿瘤容易在原肿瘤周围组织复发,且对放疗及化疗也不敏感[3-4]。高级别(III~IV级)胶质瘤预后很差,患者生存期短,死亡率较高[2,5]。所以,迫切需要研究新的治疗方法,提高胶质瘤的治疗疗效,控制肿瘤的生长,延长患者的生存期。研究发现,肿瘤组织内存在一类细胞,这类细胞具有无限增殖、自我更新及多向分化等能力,称为肿瘤干细胞[6]。肿瘤干细胞对常规放疗和化疗不敏感。据报道,胶质瘤内也存在这类肿瘤干细胞[7]。胶质瘤肿瘤干细胞通常表达CD133分子[8]。而且,胶质瘤肿瘤干细胞在胶质瘤发生发展、化疗耐药、侵袭及转移过程中发挥重要作用[9]。因此,消灭胶质瘤肿瘤干细胞是治疗胶质瘤的关键。
近年来,肿瘤免疫治疗已成为研究的热点。人们对于胶质瘤免疫治疗的关注也日益增多。肿瘤免疫治疗结合其他治疗策略可能为胶质瘤患者带来新的希望。目前,已有临床试验研究证实,抗肿瘤特异性抗原的活性疫苗能有效地治疗胶质瘤[10-11]。本研究建立了胶质瘤CD133+肿瘤干细胞反应性T细胞株,并对其杀伤功能进行检测。
1 材料与方法
1.1 实验材料
人胶质瘤细胞株U251及SF295分别购自中国科学院细胞库和凯基生物。DMEM和DMEM/F12培养基购自Hyclone公司(Hyclone,Los Angeles,CA,USA),T细胞培养基、胰酶消化液、L-谷氨酰胺、B27(50×)、青霉素-链霉素双抗及胎牛血清购自Gibco公司(Gibco,Grand Island,NY,USA),胶原酶D购自Roche公司(Roche,Basel,Switzerland),表皮生长因子、成纤维细胞生长因子及白血病抑制因子购自Pe⁃proTech公 司(PeproTech,USA),CD3及 CD133 MACS kit购自Miltenyi Biotec公司(Miltenyi Biotec,Teterow,Germany),IL-2、IL-7及IL-15购自R&D公司(R&D,MA,USA),同型对照(isotype control)、CD133、CD107a、IFN-γ、颗粒酶B及穿孔素流式抗体购自eBioscience公司(eBioscience,San Diego,USA)。
1.2 方法
1.2.1 胶质瘤肿瘤干细胞的诱导及CD133+胶质瘤肿瘤干细胞的获得
取对数生长期胶质瘤细胞株,胰酶消化成单细胞,用无血清培养基(含DMEM/F12、B27 1×、表皮生长因子20 ng/mL、成纤维细胞生长因子20 ng/mL,白血病抑制因子10 ng/mL、L-谷氨酰胺1×)培养。每隔3~4 d更换一次新鲜无血清培养基,约1周后可见细胞成球生长,获得足够数量胶质瘤肿瘤干细胞球,通过磁珠分选方法,分离并获得胶质瘤CD133+肿瘤干细胞。
1.2.2 建立胶质瘤CD133+肿瘤干细胞反应性T细胞株
从健康供者外周血中分离获得单个核细胞,磁珠分选获得CD3+T细胞。辐照过的胶质瘤CD133+肿瘤干细胞诱导并与CD3+T细胞共培养,培养7 d为一个周期。共培养7 d后,收集T细胞,继续加入辐照过的胶质瘤CD133+肿瘤干细胞诱导T细胞,共培养体系中加入IL-2(10 IU/mL)、IL-7(5 ng/mL)和IL-15(5 ng/mL)。反复诱导和共培养T细胞四个周期,建立胶质瘤CD133+肿瘤干细胞反应性T细胞株。
1.2.3 流式细胞学检测
流式细胞学检测细胞表面蛋白的表达:收集细胞,PBS洗涤并重悬细胞,加入流式抗体,避光孵育30 min,洗涤细胞,使用流式细胞仪(FACS Canto;BD Biosciences)检测,使用Flow Jo软件分析结果。检测细胞内蛋白表达时,首先对细胞进行穿膜,其余操作步骤同表面蛋白检测。
2 结 果
2.1 胶质瘤肿瘤干细胞表达CD133
首先,使用人胶质瘤细胞株SF 295诱导生成胶质瘤肿瘤干细胞。其次,通过流式细胞学,检测胶质瘤肿瘤干细胞CD133分子的表达水平。如图1所示,胶质瘤肿瘤干细胞表达CD133。
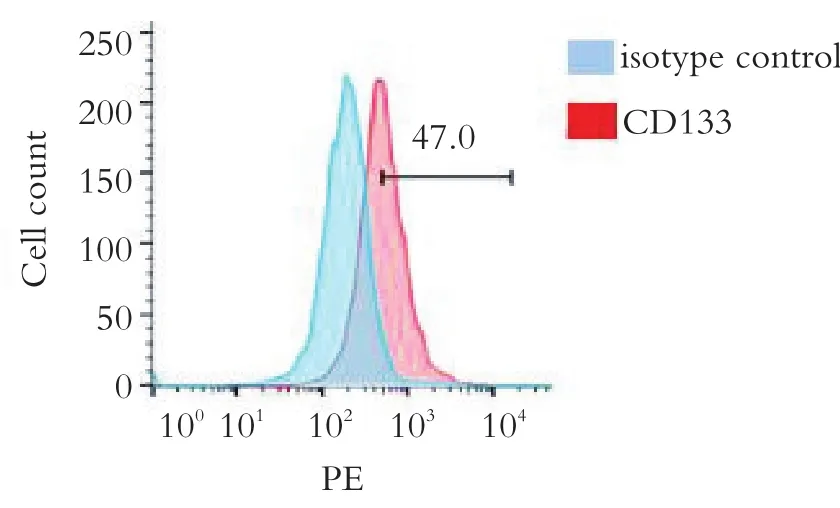
图1 流式细胞学检测胶质瘤肿瘤干细胞CD133的表达
2.2 胶质瘤CD133+肿瘤干细胞反应性T细胞表达IFN-及CD107a
IFN-及CD107a常用作细胞毒性T淋巴细胞发挥杀伤作用的标记。我们使用胶质瘤CD133+肿瘤干细胞作为靶细胞,诱导刺激并建立胶质瘤CD133+肿瘤干细胞反应性T细胞株。使用胶质瘤CD133+肿瘤干细胞重复刺激胶质瘤CD133+肿瘤干细胞反应性T细胞后,流式细胞学检测发现,如图2所示,胶质瘤CD133+肿瘤干细胞反应性T细胞分泌IFN-及CD107a。因此,胶质瘤CD133+肿瘤干细胞反应性T细胞对胶质瘤CD133+肿瘤干细胞具有细胞毒性杀伤作用。
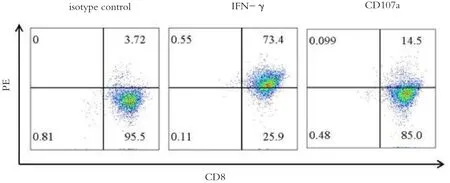
图2 流式细胞学检测胶质瘤CD133+肿瘤干细胞反应性T细胞IFN-及CD107a的表达
2.3 胶质瘤CD133+肿瘤干细胞反应性T细胞表达穿孔素及颗粒酶B
细胞毒性T淋巴细胞发挥杀伤功能的主要机制有:通过释放穿孔素和颗粒酶及通过Fas/FasL通路诱导的凋亡。胶质瘤CD133+肿瘤干细胞反应性T细胞通过流式细胞学检测发现,如图3所示,胶质瘤CD133+肿瘤干细胞反应性T细胞表达穿孔素和颗粒酶B。因此,胶质瘤CD133+肿瘤干细胞反应性T细胞通过穿孔素/颗粒酶通路杀伤胶质瘤CD133+肿瘤干细胞。
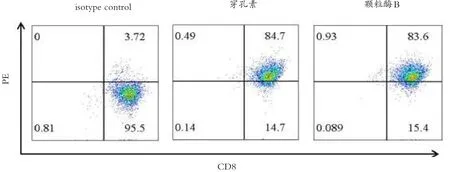
图3 流式细胞学检测胶质瘤CD133+肿瘤干细胞反应性T细胞穿孔素及颗粒酶B的表达
3 讨论
免疫系统的作用是识别危险,维持机体内环境的稳态,保护宿主免受感染及恶性肿瘤等的攻击。肿瘤未经治疗时,处于发展及持续进展状态,这主要是因为缺乏免疫系统的监视。肿瘤免疫疗法的目的是利用免疫系统的固有能力来识别和杀死恶性肿瘤细胞,与传统化疗相比,肿瘤免疫治疗特异性强,毒副反应小[12]。传统观念认为,由于血脑屏障的存在,大脑是一个免疫豁免的区域[13-14]。目前,越来越多的研究认为,大脑内存在免疫应答反应。大脑组织或器官内的一些细胞作为抗原提呈细胞,参与机体的免疫应答反应,这为胶质瘤的免疫治疗提供了基础[15-16]。胶质瘤免疫治疗主要是使用肿瘤细胞或其组成成分合成疫苗和具有合成肽段的疫苗[17]。许多随机、对照临床试验的结果显示疫苗治疗效果较好,但还不能提高患者的生存率[12]。恶性胶质瘤免疫治疗的主要障碍是肿瘤导致的免疫抑制。肿瘤免疫抑制的机制涉及多种因素包括调节性T细胞,肿瘤PD-L1的表达,和CTLA-4信号。目前已有一些免疫调节剂应用于临床治疗恶性肿瘤[12]。第二种免疫治疗策略是T细胞免疫治疗。通过高亲和力的T细胞受体或抗肿瘤抗体,使用患者自身的淋巴细胞诱导生成肿瘤特异性反应T细胞[17]。T细胞免疫治疗的优点主要是修饰细胞增强细胞的活性、体内持久性及对肿瘤免疫抑制环境的抵抗力[17]。胶质瘤免疫治疗的前景可能在于主动免疫接种和免疫检查点抑制相结合。
4 结论
在本研究中,我们首次成功建立了胶质瘤CD133+肿瘤干细胞反应性T细胞株。而且,研究发现,胶质瘤CD133+肿瘤干细胞反应性T细胞对胶质瘤CD133+肿瘤干细胞具有杀伤功能,这种杀伤作用主要通过穿孔素/颗粒酶通路介导。
1. Tresa MG,and Seema Nagpal.History current state of immunotherapy in glioma and brain metastasis[J].Ther Adv Med Oncol,2017,9(5):347-368.
2. Schwartzbaum JA,Fisher JL,Aldape KD,et al.Epidemiology and molecular pathology of glioma[J].Nat Clin Pract Neurol,2006,2:494-503.
3. Teo M,Martin S,Owusu-Agyemang K,et al.A survival analysis of GBM patients in the West of Scotland preand post-introduction of the Stupp regime[J].Br J Neurosurg,2014,28:351-355.
4. Stupp R,Mason WP,van den Bent MJ,et al.Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma[J].N Engl J Med,2005,352:987-996.
5. Van Meir EG,Hadjipanayis CG,Norden AD,et al.Exciting new advances in neuro-oncology:the avenue to a cure for malignant glioma[J].CA Cancer J Clin,2010,60(3):166-193.
6. Pan Z,Shi Z,Wei H,et al.Magnetofection based on superparamagnetic iron oxide nanoparticles weakens glioma stem cell proliferation and invasion by mediating high expression of microRNA-374a[J].J Cancer,2016,7(11):1 487-1 496.
7. Jaraiz-Rodriguez M,Tabernero MD,Gonzalez-Tablas M,et al.A short region of connexin43 reduces human glioma stem cell migration,invasion,and survival through Src,PTEN,and FAK[J].Stem Cell Reports,2017,9(2):451-463.
8. Kim SS,Pirollo KF,Chang EH.Isolation and culturing of glioma cancer stem cells[J].Curr Protoc Cell Biol,2015,67(23):1-10.
9. Dey M,Ulasov IV,Lesniak MS.Virotherapy against malignant glioma stem cells[J].Cancer Lett,2010,289(1):1-10.
10. Oh T,Sayegh ET,Fakurnejad S,et al.Vaccine therapies in malignant glioma[J].Curr Neurol Neurosci Rep,2015,15(1):508.
11. Wu ZB,Qiu C,Zhang AL,et al.Glioma-associated antigen HEATR1 induces functional cytotoxic T lymphocytes in patients with glioma[J].J Immunol Res,2014,2014:131 494.
12. Bloch O.Immunotherapy for malignant glioma[J].Cancer Treat Res,2015,163:143-158.
13. McGranahan T,G Li,S Nagpal.History and current state of immunotherapy in glioma and brain metastasis[J].Ther Adv Med Oncol,2017,9(5):347-368.
14.Williams MA,MJ.Bevan.Effector and memory CTL differentiation[J].Annu Rev Immunol,2007,25:171-192.
15. Dunn GP,H.Okada.Principles of immunology and its nuances in the central nervous system[J].Neuro Oncol,2015,17(7):3-8.
16. Louveau A,I.Smirnov,TJ.Keyes,et al.Structural and functional features of central nervous system lymphatic vessels[J].Nature,2015,523(7560):337-341.
17.Dietrich PY,DutoitV,WalkerPR.Immunotherapy for glioma:from illusion to realistic prospects[J]Am Soc Clin Oncol Educ Book,2014,34(51):51-59.
