长链非编码RNA H19与恶性肿瘤预后及进展相关性的系统评价*
2018-02-28李爱玲
方 泉,李爱玲,杨 凡,汤 艳
癌症是严重威胁人类生命和社会发展的重大疾病,我国三次全国范围内的死因调查数据显示,恶性肿瘤在城市和农村地区,列全死因的第一和第二位[1]。虽然近些年来随着医疗水平的提高,癌症患者的情况得到了一定的缓解,但是其5年生存率仍处于一个较低的水平。研究显示[2-5],恶性肿瘤中,标志物的作用不容小觑,但在临床实践中,应用却很少。若能找到合适的预后及进程标志物,对癌症的诊治,预后疗效,提高总生存率有很大的意义[6]。
LncRNA H19基因全长2.3 kb[7],有学者研究发现,H19在胃癌、膀胱癌、结直肠癌中的高表达能对癌细胞起到一定的增殖作用[8-10]。但Hao等[11]曾推测H19具有肿瘤抑制能力。LncRNA H19的表达与患者术后生存情况密切相关,LncRNA H19的表达水平与肿瘤患者生存情况之间的关系并没有完全明确,而且相关系统性的研究也不足。因此,进行系统评价来分析H19是否可以作为一种新型生物标志物判断肿瘤预后及其进展,具有重要的意义。
1 资料与方法
1.1 文献纳入与排除标准
1.1.1 纳入标准
①原始研究中含LncRNA H19的表达量且表达量分为高低两组;②有关肿瘤患者生存与LncRNA H19表达之间关系,且能直接或间接获取如风险比(hazard ratios,HR),及 95% 可信区间(confidence in⁃terval,CI)的研究;③通过RT-PCR或原位杂交(in situ hybridization,ISH)方法测量LncRNA H19的表达水平。
1.1.2 排除标准
①无LncRNA H19的表达量与肿瘤患者生存关系的研究;②无法直接或间接获取风险比的研究;③重复发表的文献。
1.2 检索策略
检索纳入的文献时间为2017年4月1日前;检索数据库为中国知网,VIP,万方,Cochrane Library,Embase,PubMed;中文检索词为“肿瘤”、“癌症”、“RNA”、“H19”;英文检索词为“RNA”、“tumor”、“H19”、“cancer”、“carcinoma”、“neoplasm”、“phy⁃ma”、“survival”。中文检索式为(RNA and H19)and(肿瘤and癌症);英文检索式为(RNA and H19)and(cancer or carcinoma or neoplasm or phyma or tu⁃mor)。以上检索词分别以逻辑连接词or或and连接。检索遵循Cochrane Handbook,采用主题词与自由词相结合的方式,并追溯纳入研究的参考文献。
1.3 研究资料的提取
提取内容包括第一作者、出版年份、国家、样本量、肿瘤类型、生存指标、分析方法、HR及95%CI。提取方法是由2名研究者分别用统一的数据收集表格独立进行提取,若提取后的资料存在差异,则通过讨论或由第3名研究者评价解决。
1.4 文献质量评价
质量评价采用纽卡斯尔-渥太华量表(Newcas⁃tle-Ottawa scale,NOS)[12]。包括研究对象的选择,设计分析中的可比性,暴露及结局情况。由2名研究者独立进行质量评价,对存在的意见和分歧通过讨论或由第3名研究者评价解决。评分≥7分,则认为质量较高。
1.5 统计学处理
采用STATA 12.0进行Meta分析及Meta回归;用Q检验(I2值)来评估纳入研究的异质性。若P>0.1,当I2≤50%,采用固定效应模型;反之,则采用随机效应模型。用合并HR值来评价H19与肿瘤预后的关系。用合并OR值来评价H19在病例组和对照组之间的差异。亚组分析时,分组参数为肿瘤所在系统。若研究中并无可以直接提取的HR及95%CI则相关数据根据Kaplan-Meier生存曲线提取[13-14]。采用Begg法评价纳入文献的潜在发表偏倚。若P<0.05,则说明差异有统计学意义。
2 结 果
2.1 检索结果
按检索策略,共检出相关文献1 231篇。通过阅读题目,摘要及相关内容后,最终纳入符合条件的文献23篇(图1)。
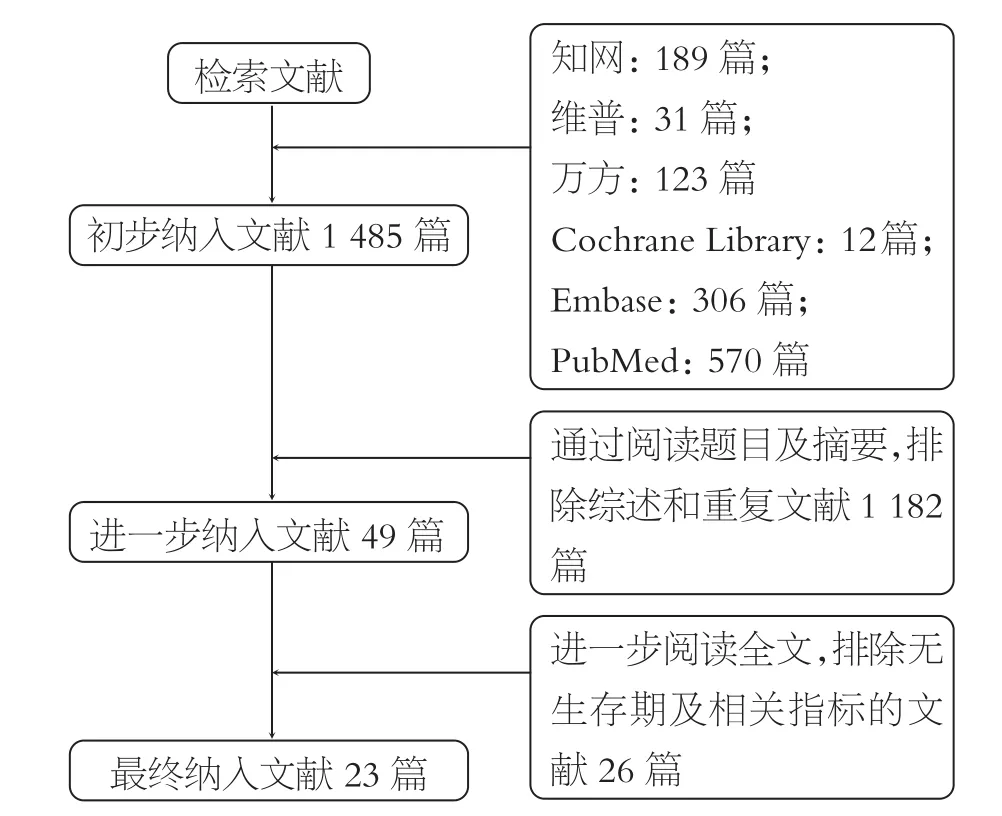
图1 文献检索流程图
2.2 纳入文献的基本情况及质量评价
纳入研究均分为H19高表达组和H19低表达组。
2.2.1 H19与肿瘤预后的相关研究
预后共纳入16项研究,共3 003例患者。其中2项研究来自美国,1项来自韩国,13项来自中国。研究的肿瘤类型中,属于消化系统的有8项[15,18-19,22-24,26,29],呼吸系统 4 项[20-21,25,28],其他系统 4 项[16-17,27,30]。NOS评分≥7分15项,<7分1项。纳入研究的基本特征及质量评价见表1。
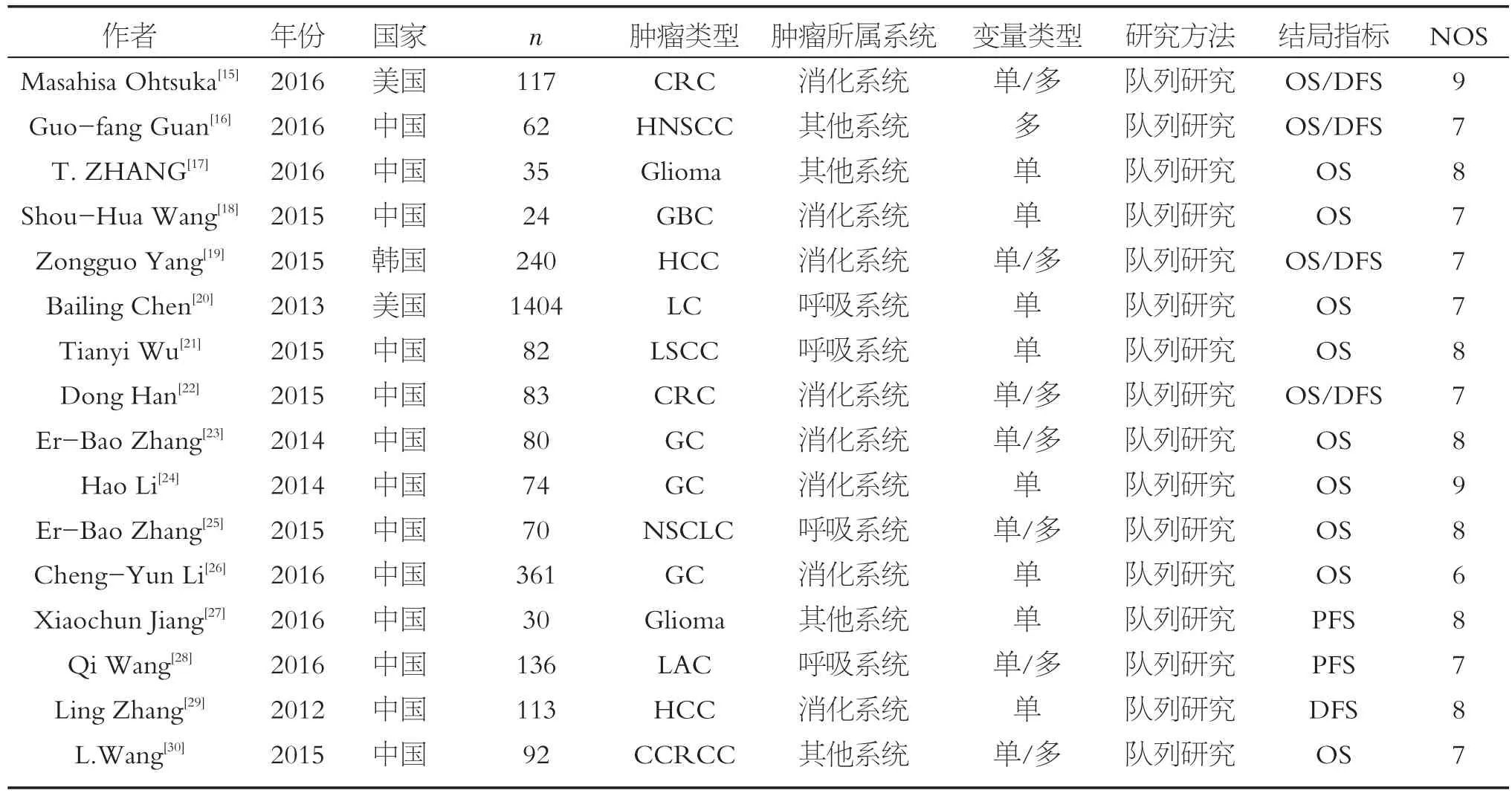
表1 H19表达与肿瘤预后研究的相关文献
2.2.2 H19与肿瘤进展相关性研究
肿瘤相关性纳入研究13项,共779名患者。其中1项来自日本,1项来自巴西,11项来自中国。研究的肿瘤类型中,属于消化系统的有8项[18,22-23,31,33,35-37],呼吸系统,2 项[25,30],其他系统 3 项[17,32,34]。NOS评分≥7分12项,<7分1项。纳入研究的基本特征及质量评价见表2。
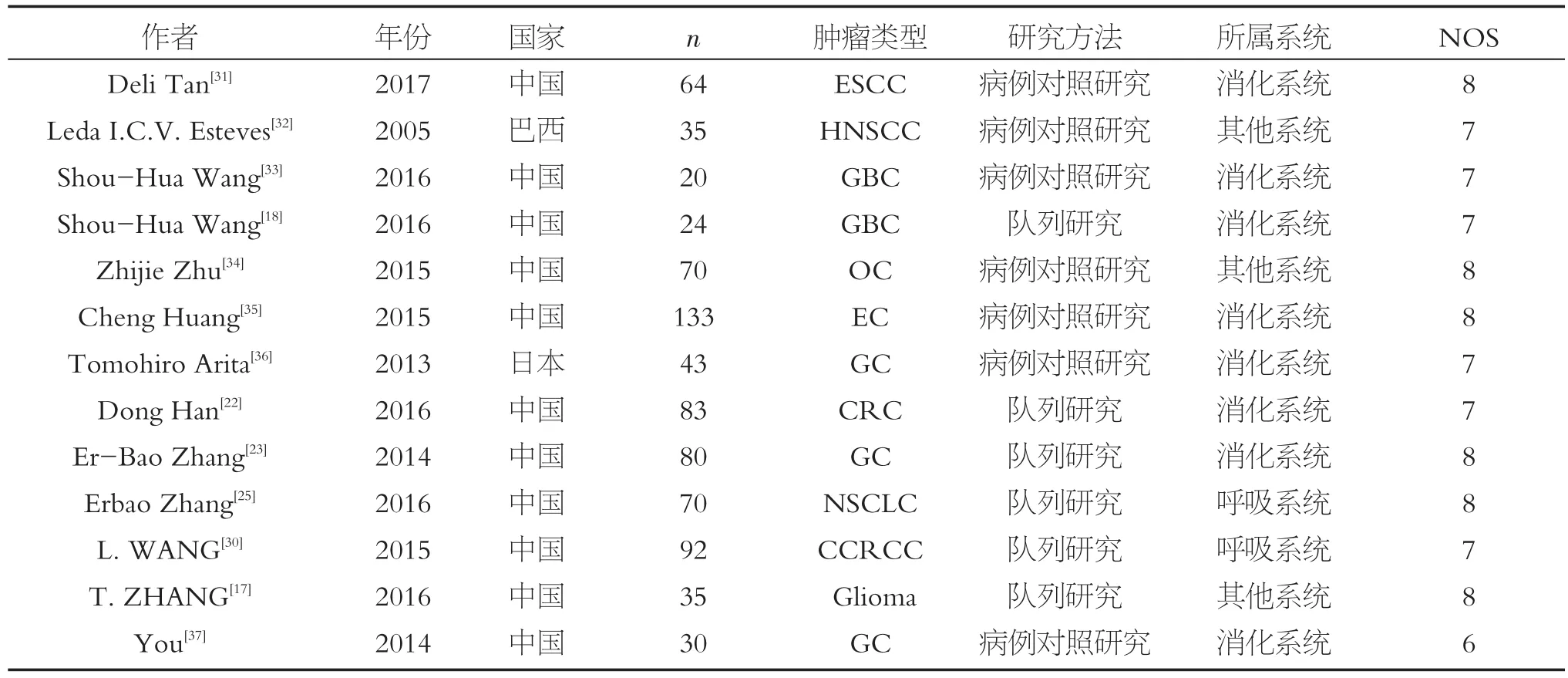
表2 H19表达与肿瘤进展研究的相关文献
2.3 Meta分析结果
2.3.1 H19表达与肿瘤患者总生存时间(OS)分析的结果
13项研究报道了H19表达与肿瘤患者总生存关系(OS)分析的结果。合并统计量为HR,在各个亚组研究中,因为在呼吸和消化系统中P<0.05,I2>50%,故有统计学异质性,采用随机效应模型。与H19低表达患者的OS相比,在消化系统,呼吸系统,其他系统中分别为HR=1.24,95%CI:0.99~1.55,P=0.094;HR=1.17.95%CI:0.97 ~ 1.42,P=0.067;HR=4.54,95%CI:1.80 ~ 11.42,P=0.001。图2结果表明,H19高表达患者总生存时间比低表达患者短。
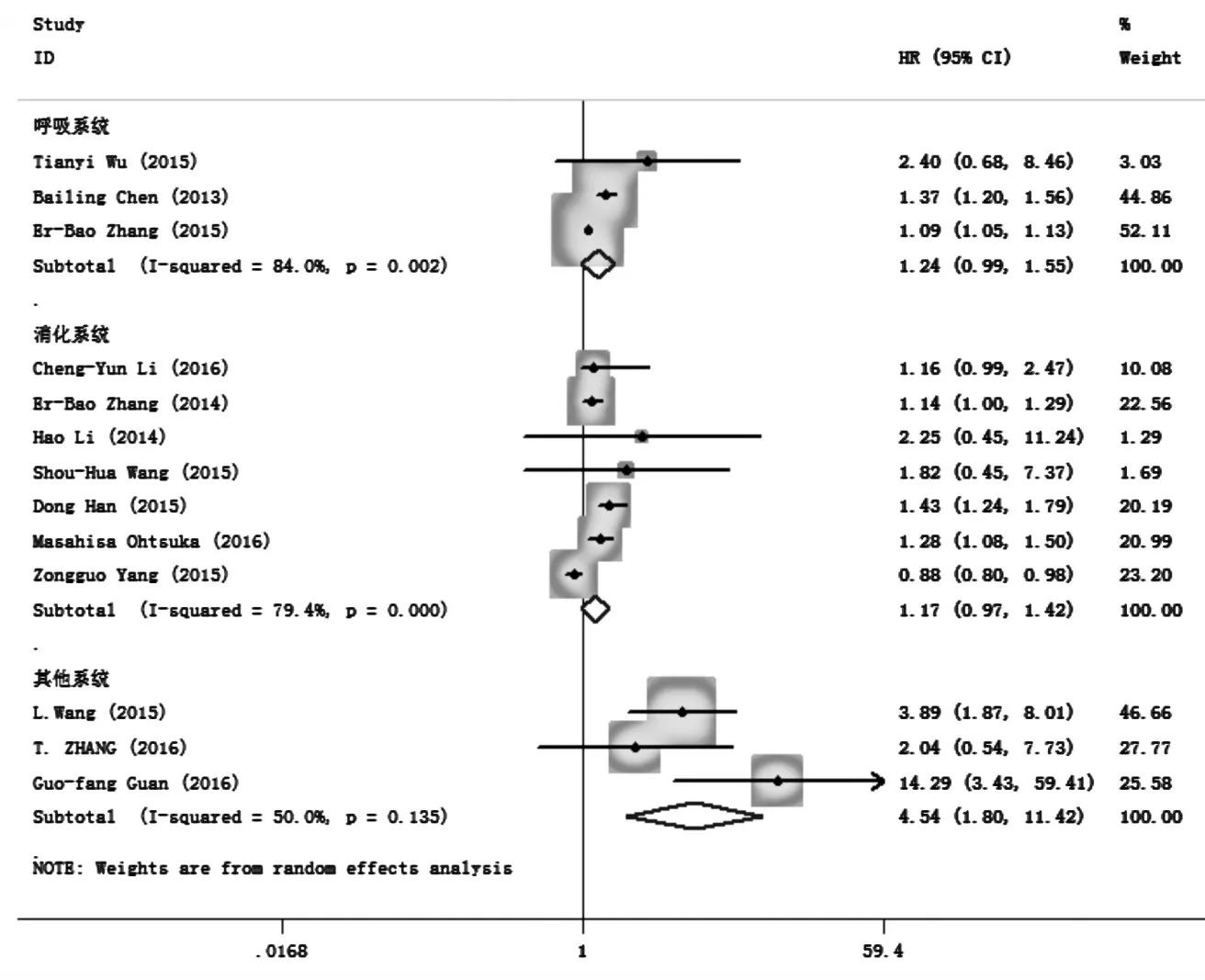
图2 H19表达与肿瘤患者总生存关系(OS)分析的森林图
2.3.2 H19表达与肿瘤患者无病生存期(DFS)分析的结果
4项研究报道了H19表达与肿瘤患者无病生存期(DFS)分析的结果。合并统计量为HR,在各个亚组研究中,因为在消化系统中P<0.05,I2>50%,故有统计学异质性,采用随机效应模型。与H19低表达患者的OS相比,在消化系统中为HR=1.22,95%CI:1.05~1.41,P<0.001。图3研究结果表明,H19高表达患者无病生存期比低表达患者短。
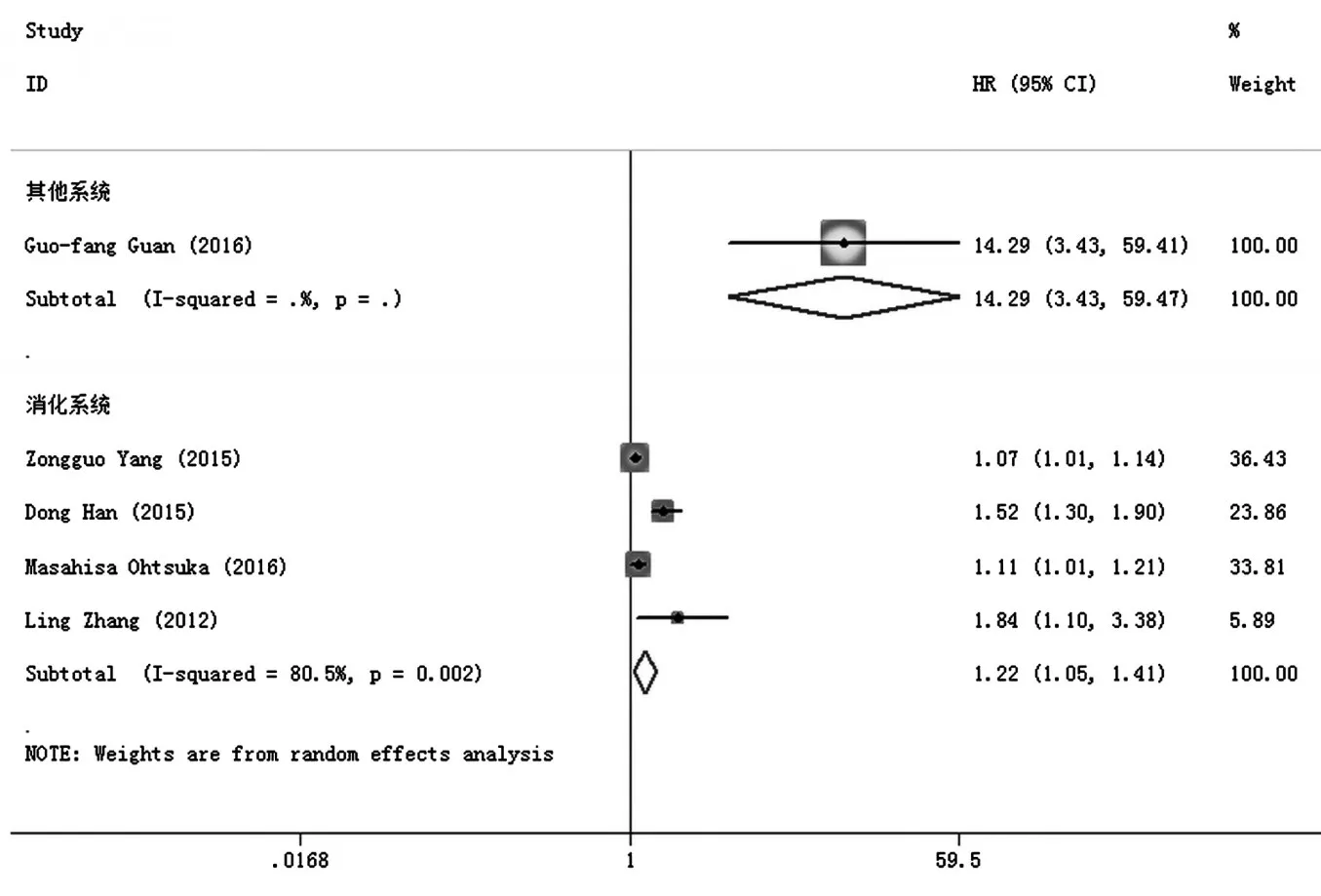
图3 H19表达与肿瘤患者无病生存期(DFS)分析的森林图
2.3.3 H19表达与肿瘤患者无进展生存期(PFS)分析的结果
2项研究报道了H19表达与肿瘤患者无进展生存期(PFS)分析的结果。合并统计量为HR,因为P>0.05,I2=0,故无统计学异质性,采用固定效应模型。与H19低表达患者的OS相比,HR=2.28,95%CI:1.28~4.09,P=0.005。研究结果表明,H19高表达患者无进展生存期比低表达患者短(见图4)。
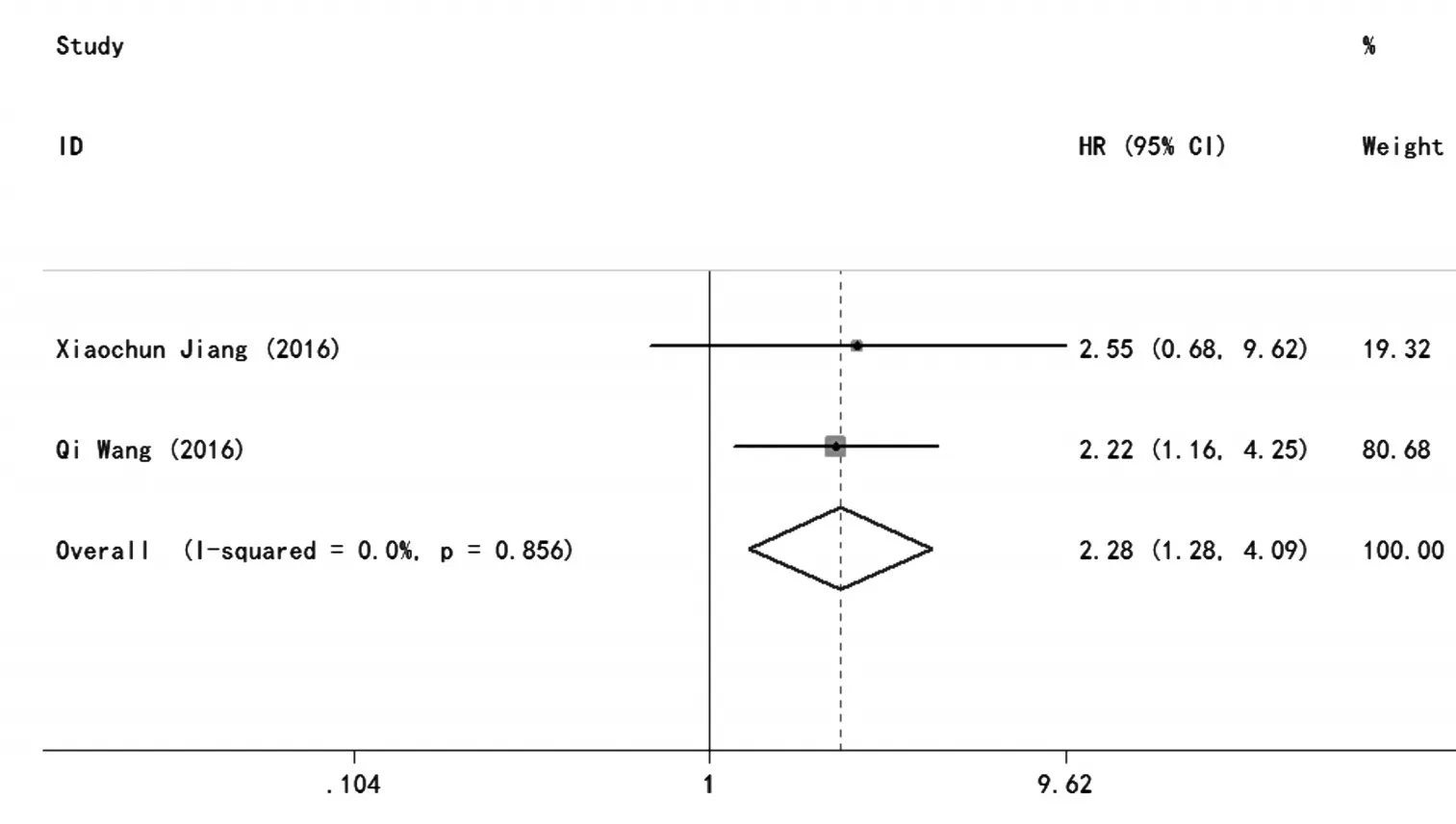
图4 H19表达与肿瘤患者无进展生存期(PFS)分析的森林图
2.3.4 H19表达与肿瘤患者性别分析的结果
12项研究报道了H19表达与肿瘤患者性别分析的结果。合并统计量为OR,在各个亚组研究中,均无统计学异质性(P>0.05,I2<50%),故采用固定效应模型。在消化系统,呼吸系统,其他系统中分别为OR=0.92,95%CI:0.59~1.44,P=0.718;OR=0.60,95%CI:0.22 ~ 1.63,P=0.316;OR=1.32,95%CI:0.60~2.91,P=0.485。研究结果表明,性别与H19表达无相关性(见图5)。
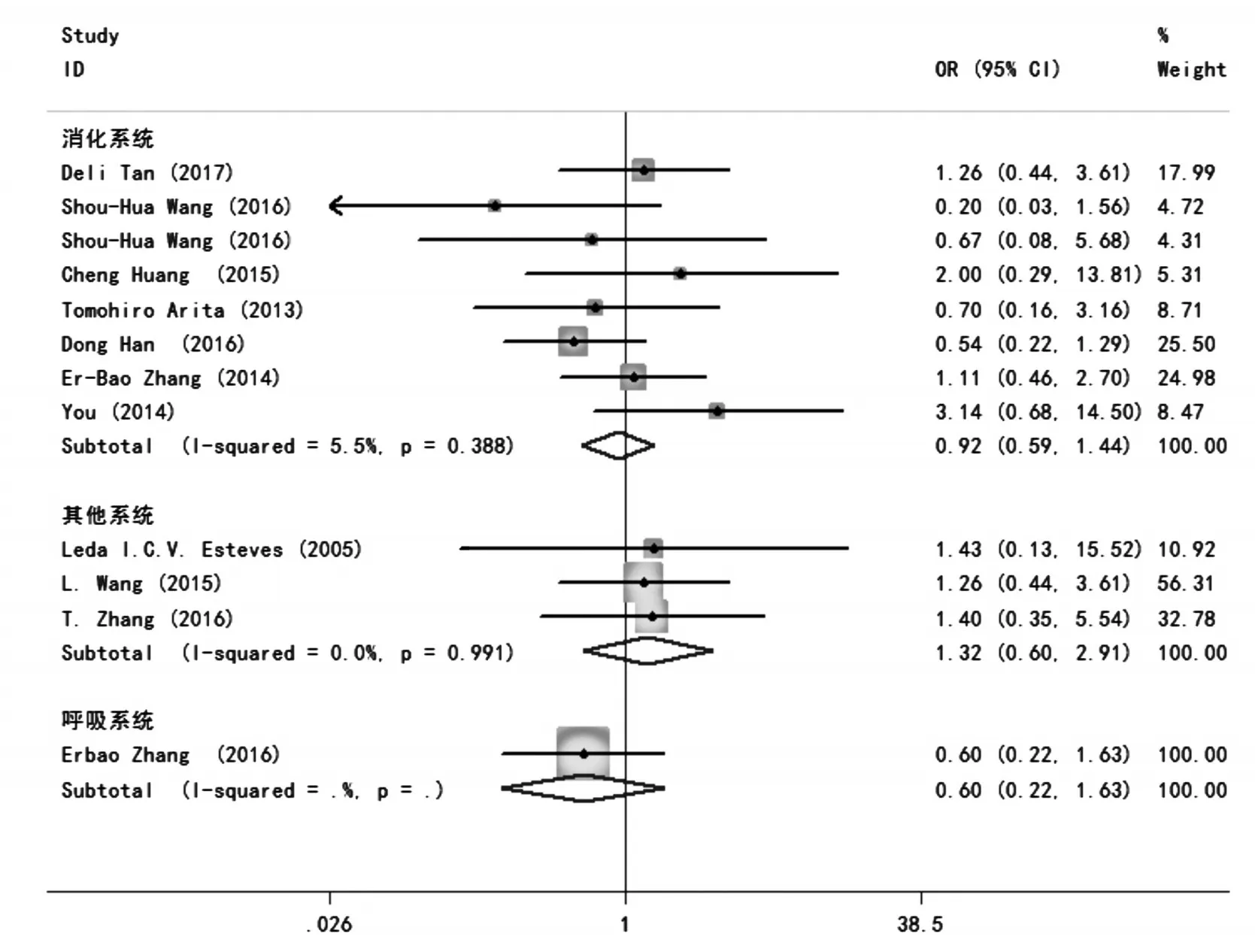
图5 H19表达与肿瘤患者性别分析的森林图
2.3.5 H19表达与肿瘤患者淋巴结转移分析的结果
11项研究报道了H19表达与肿瘤患者淋巴结转移分析的结果。合并统计量为OR,在各个亚组研究中,因为在消化和其他系统中P<0.05,I2>50%,故有统计学异质性,采用随机效应模型。在消化系统,呼吸系统,其他系统中分别为OR=2.45,95%CI:1.04~5.73,P=0.040;OR=1.81,95%CI:0.69~4.74,P=0.227;OR=1.44,95%CI:0.31~ 6.83,P=0.643。图6研究结果表明,在消化系统中,H19的高表达与淋巴结的转移有关,但在呼吸系统和其他系统中则无相关性。
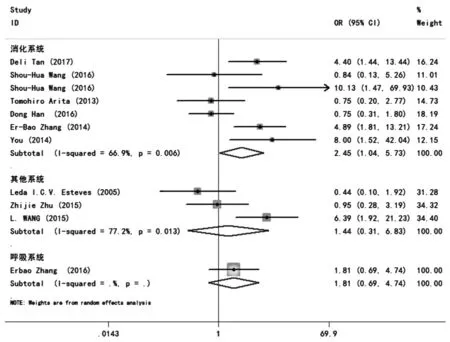
图6 H19表达与肿瘤患者淋巴结转移分析的森林图
2.3.6 H19表达与肿瘤患者淋巴远处转移分析的结果
4 项研究[24,30,36,39]报道了 H19表达与肿瘤患者淋巴远处转移分析的结果。合并统计量为OR,在各个亚组研究中,因为在消化系统中I2>50%,故有统计学异质性,故采用随机效应模型。在消化系统,其他系统中分别为OR=0.92,95%CI:0.59~1.44,P=0.015;OR=1.32,95%CI:1.31 ~ 11.36,P=0.015。图7结果表明,在消化系统中,H19的高表达会抑制淋巴远处的转移,但在其他系统中会促进肿瘤淋巴远处的转移。
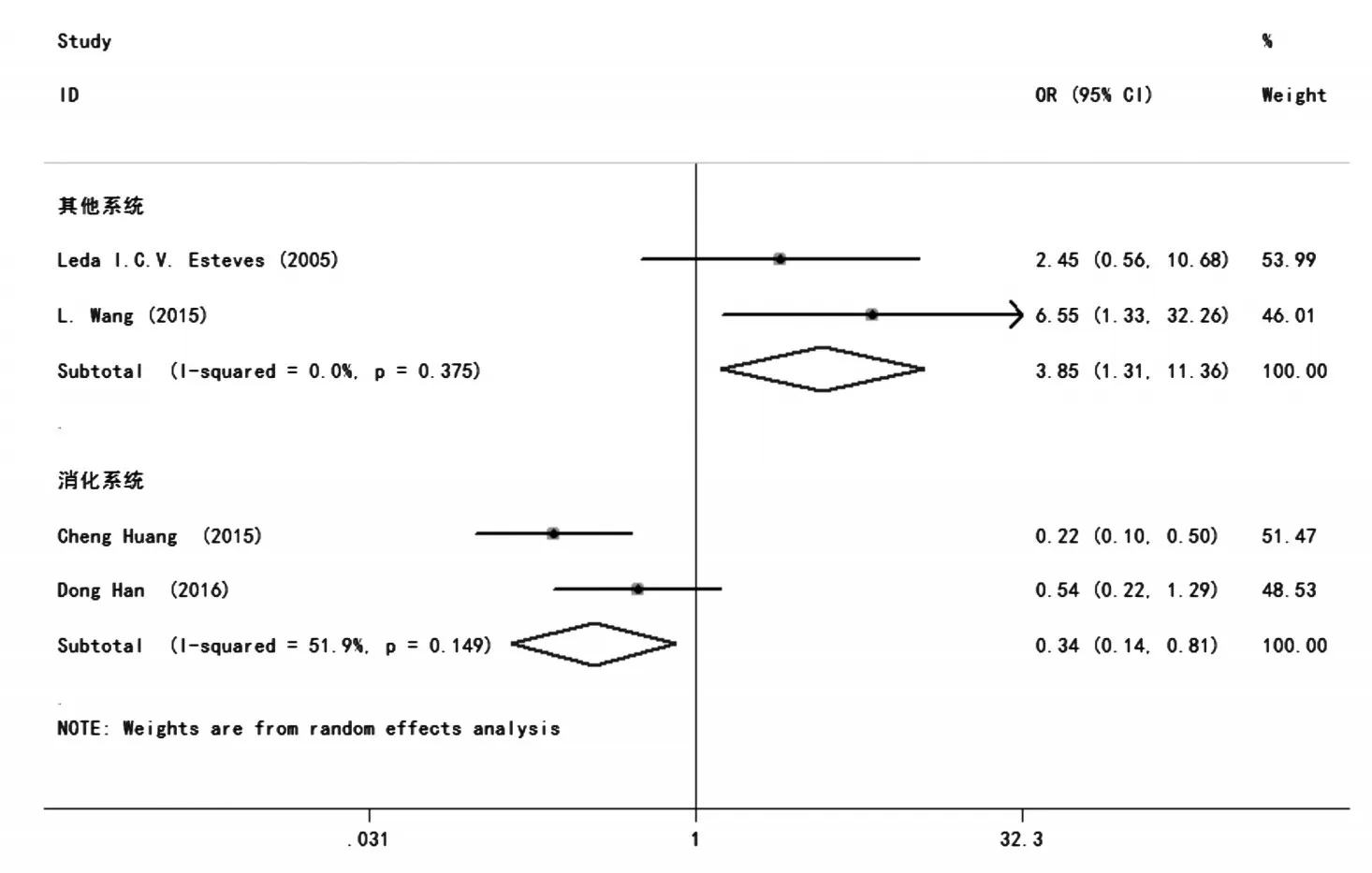
图7 H19表达与肿瘤患者淋巴远处转移分析的森林图
2.3.7 H19表达与肿瘤患者TNM分期分析的结果
4项研究报道了H19表达与肿瘤患者TNM分期分析的结果。在各个亚组研究中,因为P>0.05,I2<50%,故无统计学异质性,采用固定效应模型。在消化系统中分别为OR=0.22,95%CI:0.12~0.40,P<0.001。研究结果表明,在消化系统中,H19的高表达与肿瘤程度成正相关(图8)。
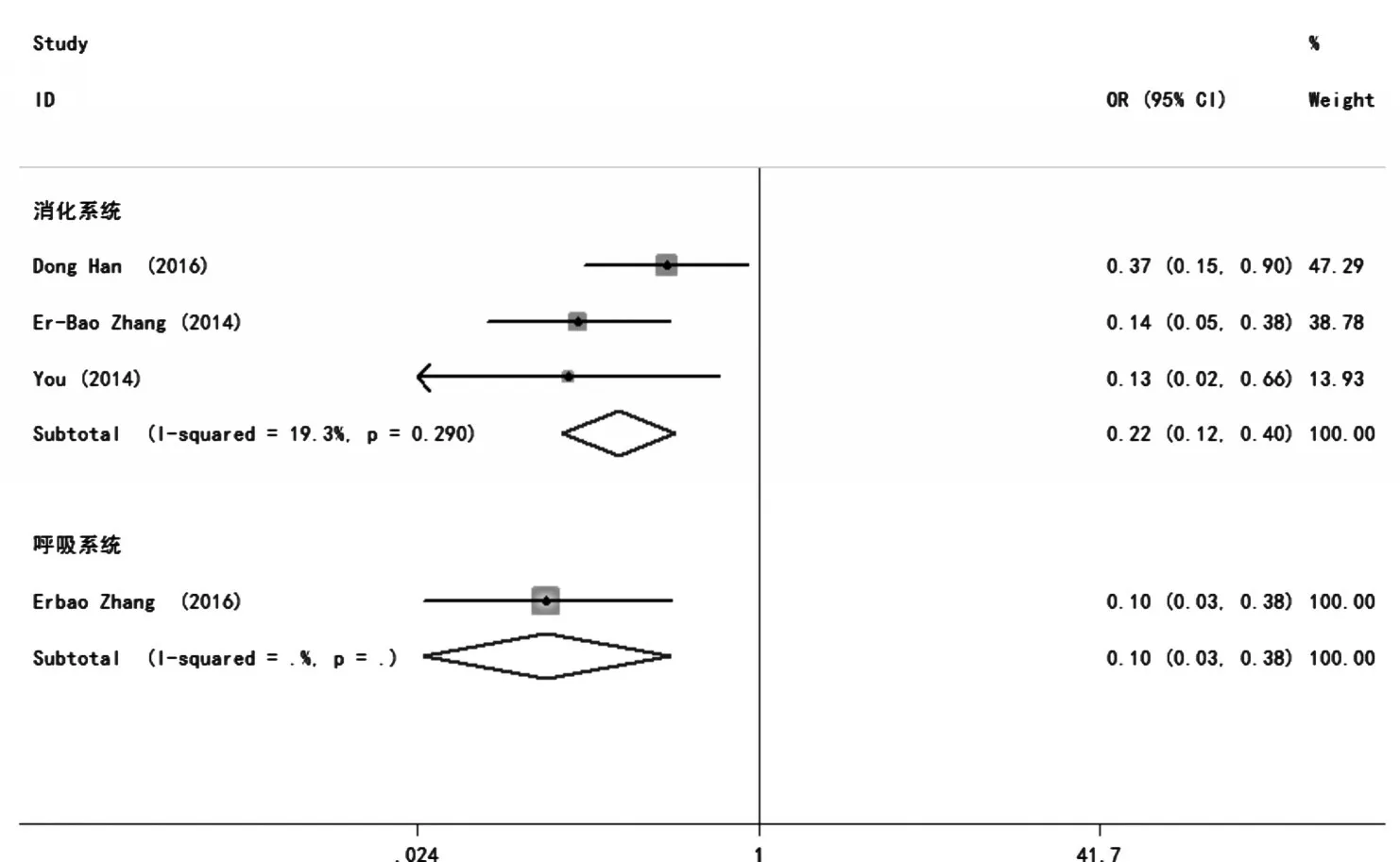
图8 H19表达与肿瘤患者TNM分期分析的森林图
2.4 发表偏倚
用STATA 12.0进行发表偏倚的检测,分别对以上研究分析进行Begg法检测,检测结果如表3,以Pr>|z|是否大于0.05来评价发表偏倚,若大于0.05则发表偏倚过小,则根据检测结果显示,以上研究发表偏倚风险较小。

表3 各项研究发表偏倚检测
3 讨 论
肿瘤严重威胁人类健康和生命安全,寻找与其发生相关的基因及其作用机理是当今医学研究的重大课题之一。近些年来,大量的研究发现lnc RNA与多种疾病的发生发展密切相关,尤其是它与肿瘤的关系,亦是如此[38]。Inc RNA转录本长度超过200 nt,本身不具备蛋白编码功能,但能在转录前后等多种层面上影响基因的表达。因此,它不仅可以为肿瘤治疗的新靶点和抗肿瘤药物的研发提供依据,而且有极大的希望作为潜在的肿瘤诊断和预后新的标志物,在肿瘤的临床早期诊断和治疗中具有广阔的应用前景。
H19是lncRNA的一种,位置位于人染色体11p15,是母体单等位基因表达的印迹基因,正常情况下,其表达随着时间呈下降趋势,在胎儿中呈现高表达,出生后迅速下调,成年人中,只在心脏和骨骼肌中持续表达,某些条件下,其表达会上调,如细胞的强烈分化。研究表明H19能够促进骨骼肌分化和再生[39]较之胎儿,虽然在成人中表达量低,但当组织再生或肿瘤形成时会被重新激活,即在一系列肿瘤中呈现高表达。因此特性,H19可作为潜在的肿瘤预后和进展的新的标志物[40]。本Meta分析首次探索H19表达水平与肿瘤进展及预后的关系。结果显示:H19的表达与肿瘤的生存指标密切相关,且对肿瘤的淋巴结,淋巴远处转移,TNM分期有关,与性别无关。此外,多项研究表明,通过Lnc RNA H19四种主要的致瘤机制来对肿瘤的发生发展起到一定的迪奥空作用,①改变染色体的状态[41];②促进上皮间质转化进程[42];③与C-MYC或p53相互作用调控下游靶标的表达[43];④与miRNAs相互作用调控肿瘤的进程[44]。但这些研究由于由于样本量较小,尚不足以说明问题。
本研究虽为总结了相关研究的系统评价,样本量较单个研究明显增加,但仍存在一定的局限性:①本系统评价总样本量为3 782例,但具体到各系统时的样本仍然较为有限;②不同研究中H19表达高低的阀值未作统一要求,可能会对结果产生影响;③不同的肿瘤之间存在差异,仅根据肿瘤所在系统作亚组分析可靠性较差;④部分研究的数据由生存曲线提取而来,存在误差;⑤相较于国内,纳入的国外研究较少,有一定的偏倚风险。
4 结 论
本系统评价显示,LncRNA H19的高表达与肿瘤患者的不良预后以及肿瘤淋巴结,淋巴远处转移,TNM分期的程度密切相关。因此,lncRNA H19可作为判断肿瘤预后及进展的新型生物标志物。
1. 陈竺.全国第三次死因回顾抽样调查报告[M].北京:中国协和医科大学出版社,2008.11-12.
2. Storm L,Christensen IJ,Jensenius JC,et al.Evaluation of complement proteins as screening markers for colorectal cancer[J].Cancer Immunol Immunother,2015,64(1):41-50.
3. Yin T,Lu L,Xiong ZG,et al.ATPase inhibitory factor 1 is a prognostic marker and contributes to proliferation and invasion of human gastric cancer cells[J].Biomedicine&Pharmacotherapy,2015,70(201570):90-96.
4. Zhai JH,Gu WC,Xu XL,et al.Prognostic value of CD133 expression in cancer patients treated with chemora⁃diotherapy:a meta-analysis[J].Tumour Biol,2015,36(2):701-709.
5. 王明霜,周凡,甘西伦,等.18F-NaF PET-CT与血清肿瘤标志物联合检测对肺癌骨转移早期诊断的价值[J].泸州医学院学报,2015,38(04):375-378.
6. 王淑玉,时黎明,邹明静,等.RASSF1A基因启动子区甲基化状态在食管鳞诊断中的研究[J].西南医科大学学报,2017,40(4):388-391.
7. Yang G,Lu X,Yuan L.LncRNA:a Link between RNA and cancer[J].Biochim Biophys Acta,2014,1839(11):1 097-1 109.
8. Zhou X,Yin C,Dang Y,et al.Identification of the long non-coding RNA H19 in plasma as a novel biomarker for diagnosis of gastric cancer[J].Sci Rep,2015,5(1):11 516.
9. Luo M,Li Z,Wang W,et al.Upregulated H19 contrib⁃utes to bladder cancer cell proliferation by regulating ID2 expression[J].FEBS J,2013,280(7):1 709-1 716.
10.Liang WC,Fu WM,Wong CW,et al.The lncRNA H19 promotes epithelial to mesenchymal transition by function⁃ing as miRNA sponges in colorectal cancer[J].Oncotarget,2015,6(26):22 513-22 525.
11. Hao Y,Crenshaw T,Moulton T,et al.Tumour-suppres⁃sor activity of H19 RNA[J].Nature,1993,365(6448):764-767.
12. Stang A.Critical evaluation of the Newcastle-Ottawa scale for the assessment of the quality of nonrandomized studies in meta-analyses[J].Eur J Epidemiol,2010,25(9):603-605.
13. Parmar MK,Torri V,Stewart L.Extracting summary sta⁃tistics to perform meta-analyses of the published literature for survival endpoints[J].Stat Med,1998,17(24):2 815-2 834.
14. Tierney JF,Stewart LA,Ghersi D,et al.Practical methods for incorporating summary time-to-event data into me⁃ta-analysis[J].Trials,2007,8(1):16.
15. Ohtsuka M,Ling H,Ivan C,et al.H19 noncoding RNA,an Independentprognostic factor,regulatesessential Rb-E2F and CDK8-β-Catenin signaling in colorectal cancer[J].EBioMedicine,2016,13(C):113-124.
16. Guan GF,Zhang DJ,Wen LJ,et al.Overexpression of ln⁃cRNA H19/miR-675 promotes tumorigenesis in head and neck squamous cell carcinoma[J].Int J Med Sci,2016,13(12):914-922.
17. Zhang T,Wang YR,Zeng F,et al.LncRNA H19 is over⁃expressed in glioma tissue,is negatively associated with pa⁃tient survival,and promotes tumor growth through its de⁃rivativemiR-675[J].EurRevMedPharmacolSci,2016,20(23):4 891-4 897.
18.Wang SH,Wu XC,Zhang MD,et al.Long noncoding RNA H19 contributes to gallbladder cancer cell prolifera⁃tion by modulated miR-194-5p targeting AKT2[J].Tumor Biology,2016,37(7):9 721-9 730.
19. Yang Z,Lu Y,Xu Q,et al.HULC and H19 played differ⁃ent roles in overall and disease-free survival from hepato⁃cellular carcinoma after curative hepatectomy:a prelimi⁃nary analysis from gene expression omnibus[J].Dis Mark⁃ers,2015(2015):191 029.
20. Chen B,Yu M,Chang Q,et al.Mdig de-represses H19 large intergenic non-coding RNA (lincRNA) by down-regulating H3K9me3 and heterochromatin[J].On⁃cotarget,2013,4(9):1 427-1 437.
21. Wu T,Qu L,He G,et al.Regulation of laryngeal squa⁃mous cell cancer progression by the lncRNA H19/miR-148a-3p/DNMT1axis[J].Oncotarget,2016,7(10):11 553-11 566.
22.Han D,Gao X,Wang M,et al.Long noncoding RNA H19 indicates a poor prognosis of colorectal cancer and promotes tumor growth by recruiting and binding to eIF4A3[J].Oncotarget,2016,7(16):22 159-22 173.
23. Li CY,Liang GY,Yao WZ,et al.Integrated analysis of long non-coding RNA competing interactions reveals the potential role in progression of human gastric cancer[J].Int J Oncol,2016,48(5):1 965-1 976.
24. Li H,Yu B,Li J,et al.Overexpression of lncRNA H19 enhances carcinogenesis and metastasis of gastric cancer[J].Oncotarget,2014,5(8):2 318-2 329.
25. Zhang EB,Li W,Yin DD,et al.c-Myc-regulated long non-coding RNA H19 indicates a poor prognosis and af⁃fects cell proliferation in non-small-cell lung cancer[J].Tumor Biology,2016,37(3):4 007-4 015.
26. Zhang EB,Han L,Yin DD,et al.c-Myc-induced,long,noncoding H19 affects cell proliferation and predicts a poor prognosis in patients with gastric cancer[J].Med On⁃col,2014,31(5):1-8.
27. Jiang X,Yan Y,Hu M,et al.Increased level of H19 long noncoding RNA promotes invasion,angiogenesis,and stemness of glioblastoma cells[J].J Neurosurg,2016,124(1):129-136.
28. Wang Q,Cheng N,Li X,et al.Correlation of long non-coding RNA H19 expression with cisplatin-resis⁃tance and clinical outcome in lung adenocarcinoma[J].Oncotarget,2017,8(2):2 558-2 567.
29. Zhang L,Yang F,Yuan JH,et al.Epigenetic activation of the MiR-200 family contributes to H19-mediated metas⁃tasissuppressioninhepatocellularcarcinoma[J].Carcinogenesis,2013,34(3):577-586.
30. Wang L,Cai Y,Zhao X,et al.Down-regulated long non-coding RNA H19 inhibits carcinogenesis of renal cell carcinoma[J].Neoplasma,2015,62(3):412-418.
31. Tan D,Wu Y,Hu L,et al.Long noncoding RNA H19 is up-regulated in esophageal squamous cell carcinoma and promotes cell proliferation and metastasis[J].Diseases of the Esophagus,2017,30(1):1-9.
32. Esteves LI,Javaroni AC,Nishimoto IN,et al.DNA meth⁃ylation in the CTCF-binding site I and the expression pat⁃tern of the H19 gene:does positive expression predict poor prognosis in early stage head and neck carcinomas?[J].Mol Carcinog,2005,44(2):102-110.
33.Wang SH,Quan ZW.Long noncoding RNA H19 con⁃tributes to gallbladder cancer cell proliferation by modulat⁃ed miR-194-5p targeting AKT2.Tumor Biology[J],2016,37(7):9721-9730.
34. Zhijie Z,Ling S,Jun H,et al.Ectopic expressed long non-coding RNA H19 contributes to malignant cell be⁃havior of ovarian cancer[J].International Journal of Clini⁃cal&Experimental Pathology,2015,8(9):10 082-10 091.
35. Huang C,Cao L,Qiu L,et al.Upregulation of H19 pro⁃motes invasion and induces epithelial-to-mesenchymal transition in esophageal cancer[J].Oncol Lett,2015,10(1):291-296.
36. Arita T,Ichikawa D,Konishi H,et al.Circulating long non-coding RNAs in plasma of patients with gastric can⁃cer[J].Anticancer Research,2013,33(8):3185.
37. 尤梁惠,刘志军,德伟.长链非编码RNA H19促进人胃癌MGC-803细胞增殖的实验研究[J].临床肿瘤学杂志,2014(9):774-778.
38. Thomas Derrien,Roderic Guigó,Rory Johnson.The Long non-coding RNAs:a new player in the“dark mat⁃ter”[J].Frontiers in Genetics,2012,2(2):107.
39. Dey BK,Pfeifer K,Dutta A.The H19 long noncoding RNA givesrisetomicroRNAsmiR-675-3pand miR-675-5p to promote skeletal muscle differentiation and regeneration[J].Genes Dev,2014,28(5):491-501.
40. Matouk IJ,Degroot N,Mezan S,et al.The H19 non-coding RNA is essential for human tumor growth[J].PLoS One,2007,2(9):845.
41.Luo M,Li Z,Wang W,et al.Long non-coding RNA H19 increases bladder cancer metastasis by associating with EZH2 and inhibiting E-cadherin expression[J].Cancer Letters,2013,333(2):213-221.
42. Matouk IJ,Raveh E,Abu-Lail R,et al.Oncofetal H19 RNA promotes tumor metastasis[J].Biochim Biophys Ac⁃ta,2014,1843(7):1 414-1 426.
43. Barsyte-Lovejoy D,Lau SK,Boutros PC,et al.The c-Myc oncogene directly induces the H19 noncoding RNA by allele-specific binding to potentiate tumorigene⁃sis[J].Cancer Res,2006,66(10):5 330-5 337.
44.Zhu M,Chen Q,Liu X,et al.lncRNA H19/miR675 ax⁃is represses prostate cancer metastasis by targeting TGFBI[J].Febs Journal,2014,281(16):3 766-3775.
