象山港蓝点马鲛繁殖群体的耳石形态分析
2018-02-28杨林林姜亚洲凌建忠刘尊雷李圣法
杨林林,姜亚洲,林 昱,凌建忠,刘尊雷,李圣法
(中国水产科学研究院东海水产研究所,农业部东海与远洋渔业资源开发利用重点实验室,上海 200090)
蓝点马鲛(Scomberomorus niphonius)隶属于鲈形目(Perciformes),鲭科(Scombridae),马鲛属,为大型暖温性中上层鱼类,广泛分布于西北太平洋的日本诸岛、朝鲜半岛南端群山至釜山外海以及中国沿海海域[1]。蓝点马鲛是中国沿海流刺网渔业的主要捕捞对象[2],作业时间一般为每年的春季,此时蓝点马鲛繁殖群体正游向浙闽近海和长江口以北的各个产卵场。象山港是浙江近岸一个狭长形的半封闭式深水港湾,是蓝点马鲛的重要产卵场之一,亦是蓝点马鲛的种质资源保护区[3-4]。每年的3月下旬到6月上旬蓝点马鲛繁殖群体进入象山港内产卵,在清明节前后达到高峰。
耳石是鱼类生长过程中沉淀在内耳中的钙质结构,随着鱼类的生长而生长,一般认为鱼体性成熟后耳石形态趋于稳定[5-6]。耳石形态具有高度的物种特异性和显著的种间差异性;耳石形态分析可以定量解释鱼类种间、群体间的耳石形态差异,可用于鱼类种间、群体间的识别研究[7-8]。当前,常用的耳石形态学分析方法有文字描述法[9]、地标法[10]、可量性状比较法[11]、耳石形态指标法[12]以及椭圆傅里叶分析法[13]。关于中国沿海蓝点马鲛的种群划分问题,历史资料和分节特征、量度测定的形态学研究将其分为黄渤海种群和东海种群[14-16];线粒体DNA和COI序列分析则认为东、黄海群体之间并没有明显的种群遗传分化[17-18];而核基因组多样性数据(AFLP)分析显示东、黄海群体又有着显著的地理种群分化[19]。蓝点马鲛具有长距离的洄游习性,潜在的种群和群系间的索饵、越冬和繁殖行为存在空间和时间上的重叠,如何科学有效地划分蓝点马鲛种群、判定各产卵场繁殖群体的种群归属、实现资源的有效管理,成为当前研究工作的首要任务。耳石形态学分析将成为蓝点马鲛种群鉴定和群体识别工作最为实用的技术手段之一。本研究以2016年4~7月在象山港采集的蓝点马鲛繁殖群体为研究对象,分析了象山港蓝点马鲛繁殖群体耳石形态的个体差异性;探讨了影响蓝点马鲛耳石形态的多方因素;旨在为今后开展中国沿海产卵场蓝点马鲛的种群鉴别及洄游习性研究提供基础资料与方法借鉴,也为蓝点马鲛资源的科学管理提供理论支持。
1 材料与方法
1.1 材料来源
蓝点马鲛样本取自象山港蓝点马鲛繁殖期间的流刺网渔获,收集时间为2016年4~7月。样本经冰鲜保存后进行室内的生物学测定,包括叉长(fork length,FL)(精确到 1 mm)、体质量(body weight,BW)(精确到 1 g)、性别、性腺成熟度等。实验期间共获得性腺成熟度Ⅳ期以上的个体113 ind,叉长范围为440~1 450 mm,体质量范围为692~8 220 g。生物学测定完成后摘取其左、右矢耳石(以下简称耳石),清洗表面后保存于耳石盒中以待进一步分析,共获得完整的蓝点马鲛性成熟个体耳石102对。
1.2 研究方法
1.2.1 耳石形态参数选取
将耳石经超声波清洗后置于50℃烘箱中干燥12 h以上至恒重。干燥后的耳石用精密电子天平称重,单位精确到1 mg。耳石凸面向上、凹面向下,在Zeiss SteREO Discovery V20型体视显微镜下拍摄二维轮廓图形(图1)。利用Image Proplus 6.0软件分析耳石图像,基于面积、周长、耳石长、耳石宽、几何中心最长半径、几何中心最短半径等6个尺寸参数和耳石质量,可计算得出环率、圆度、椭圆率、矩形趋近率、纵横比、形态因子、半径比和面密度等 8个形态指标[10,20-21](表1)。
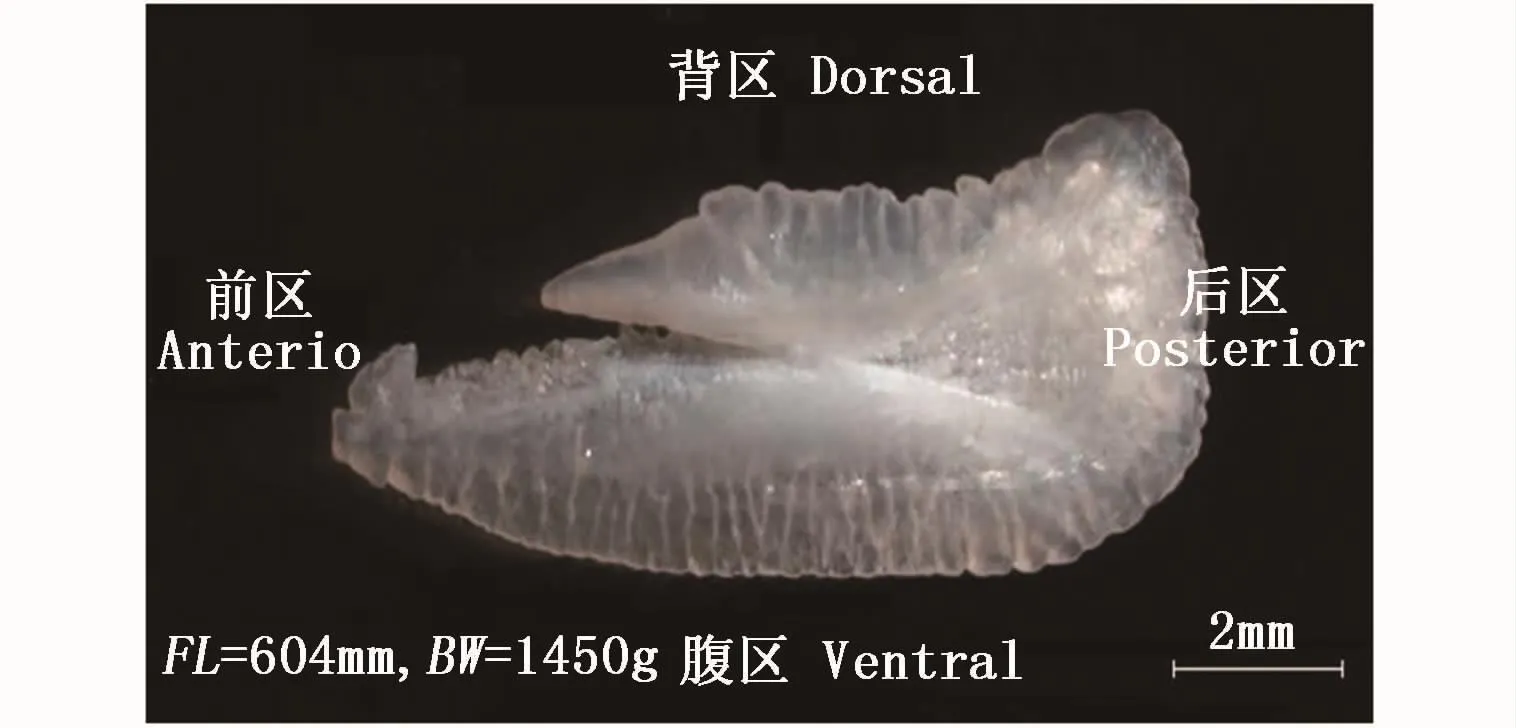
图1 象山港蓝点马鲛矢耳石形态照片Fig.1 Sagittal otolith of Scomberomorus niphonius collected in the Xiangshan Bay
在形态指标中,环率代表耳石与等面积圆之间的近似程度,环率值越小越趋近于圆;圆度代表耳石外轮廓趋于圆的近似程度,圆度值越大越趋近于圆;椭圆率描述外缘点到外切矩形长、宽间的距离是否成比例关系;矩形趋近率表示耳石轮廓与其最小外切矩形的关系;纵横比表征耳石外切矩形长与宽之间的差异程度;形态因子表述耳石轮廓的规则程度,值越大,耳石轮廓越趋于规则;半径比表示经过几何中心最长半径与最短半径之间的差异程度;面密度表示耳石的薄厚程度[22]。耳石形态指标在一定程度上可以消除耳石位置不同、耳石大小不同等因素对图像分析结果的影响。

表1 耳石测量的尺寸参数和形态指标Tab.1 Size parameters and indices of shape variables used in otolith image analysis
1.2.2 耳石年龄鉴定及分组
在完成耳石的二维轮廓拍摄、形态参数与质量指标提取后,将耳石洗净进行磨片,置于Olympus DP72型显微镜下,透射光观察,可见清晰的轮纹,其中一个完整的明带和暗带计为一个年轮。由于蓝点马鲛性成熟年龄雄性早于雌性,1龄雌性个体还未完全性成熟,因此实验选取2龄及以上的性成熟个体。年龄范围在2~7龄的样本总计98 ind。叉长范围为501~1 450 mm,体质量范围为831~8 220 g。由于5~7龄的样本量较少,因此将其归为1个年龄组,共分为4个年龄组,分别为2龄组(Y2)、3龄组(Y3)、4龄组(Y4)和5龄及以上组(Y5+)。左、右耳石的年龄鉴定结果一致。
1.2.3 数据统计及分析
本研究分别对蓝点马鲛左、右耳石各原始测量指标进行独立样本t检验,以检验种内左、右耳石间的差异性。同样使用独立样本t检验,检测雌、雄个体间耳石形态的差异情况。
根据得出的耳石形态指标平方根转化及标准化后计算的Bray-Curtis相似性系数构建矩阵,采用非参数多维标度(NMDS)排序技术分析不同年龄组耳石形态特征。NMDS分析结果以胁强系数(Stress)作为评判标准,当 Stress<0.2时,认为可以用NMDS的二维点图表示,该图形有一定的解释意义;当Stress<0.1时,认为该排序是一个好的排序;而当Stress<0.05时,则认为该排序结果具有很好的代表性[23]。
运用单因子相似性分析(ANOSIM)进行性别和年龄组间耳石形态差异的显著性检验;通过相似性百分比分析(SIMPER)分析造成组内相似性的耳石形态典型指标以及造成组间相异性的耳石形态分歧指标,计算各形态指标对年龄组内相似性和组间相异性的贡献度。统计分析主要在Excel 2010、SPSS 19和 PRIMER 5.0软件上完成。
2 结果与分析
2.1 左右耳石形态的差异性
对左右耳石的6个测量指标和耳石质量分别进行t检验,结果显示,象山港蓝点马鲛繁殖群体左右耳石的形态指标均不存在显著的形态差异(N=102,P>0.05)(表2)。
基于此分析,本研究中的耳石形态分析统一使用左耳石。

表2 蓝点马鲛左右耳石差异性比较Tab.2 T-test for the left and right otolith of S.niphonius
2.2 样本组成及耳石形态指标
样本中雌性57 ind,平均叉长为(796.7±156.2)mm,平均体质量为(3 677.0±1 734.5)g;雄性45 ind,平均叉长为(635.1±125.8)mm,平均体质量为(2 044.2.0±1 311.6)g。Y2、Y3、Y4和Y5+的样本量分别为31 ind、29 ind、28 ind和10 ind,平均叉长分别为(589.7±51.1)mm、(736.9±52.1)mm、(867.1±25.3)mm和(1 065.7±176.5)mm;平均体质量分别为(1 478.3±341.2)g、(2 910.8±743.6)g、(4 706.2±737.2)g和(6 367.9±1 255.3)g。
雌、雄个体及各个年龄组耳石形态指标的均值如表3所示。除了环率、矩形趋近率和形态因子,其它参数雌性均值大于雄性,其中半径比的差值最大。这与雌性个体的平均叉长较大有关。各年龄组就形态指标的均值而言,环率、椭圆率随着年龄的增加而减小;圆度、半径比和面密度随着年龄的增加而增大。

表3 不同性别及年龄组耳石形态参数值Tab.3 Shape indices of different sex and age groups
2.3 不同性别及年龄组耳石形态的差异性
雌雄个体间耳石形态指标进行比较,ANOSIM分析结果显示,蓝点马鲛雌性个体的耳石形态与雄性不存在显著性差异(R=0.018,P=0.367)。4个年龄组间耳石形态存在着显著性差异(R=0.483,P=0.001)。对各年龄组进行两两比较后发现,年龄组两两之间耳石形态的差异均达到极显著水平(P<0.01)(表4)。
汇总象山港蓝点马鲛各个年龄组耳石形态数据进行 NMDS排序,结果显示,胁强系数为0.14,这说明NMDS图能较好的反映各年龄组间耳石形态的相似关系(图2)。
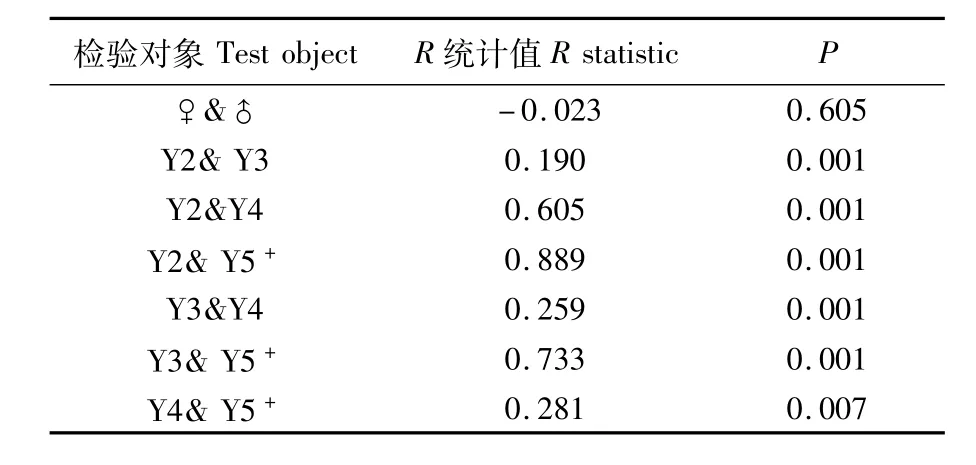
表4 不同性别及年龄组间耳石形态的相似性分析Tab.4 Analysis of sim ilarities test for the otolith shape of different sex and age groups
2.4 不同年龄组耳石形态的相似性百分比
对各年龄组组内相似性贡献较大的耳石形态典型指标如表5所示。Y2、Y3、Y4和Y5+组内的平均相似性分别为 97.99%、98.18%、97.62%和96.71%。对 Y2和 Y3组相似性贡献较大的耳石形态典型指标为半径比、纵横比、面密度、矩形趋近率、形态因子和椭圆率,累积相似性贡献率为90.75%和90.45%;对Y4组相似性贡献率较大的耳石形态典型指标为半径比、纵横比、面密度、矩形趋近率、圆度和椭圆率,累积相似性贡献率分别为90.31%;对Y5+组相似性贡献率较大的耳石形态典型指标为半径比、纵横比、面密度、矩形趋近率、圆度和形态因子,累积相似性贡献率分别为90.47%。半径比、纵横比和面密度是对各组内相似性贡献度较高的耳石形态典型指标。
对各年龄组组间相异性贡献百分比较大的耳石形态分歧指标如表 6所示。Y2&Y3、Y2&Y4、Y2&Y5+、Y3&Y4、Y3&Y5+、Y4&Y5+组间的平均相异性分别为 2.18%、3.50%、4.49%、2.64%、3.58%和 3.01%。各个组间相异性贡献最大的耳石形态分歧指标均为圆度。对比分析各组间相异性贡献百分比,结果显示,圆度、面密度和半径比是对各组间相异性贡献度较高的耳石形态分歧指标,这在一定程度上反映了蓝点马鲛耳石形态随年龄增长的变化趋势。

图2 基于Bray-Curtis相似性系数的各年龄组耳石形态的NMDS排序Fig.2 NMDS results for otolith shape ofdifferent age groups based on Bray-Curtis sim ilarity
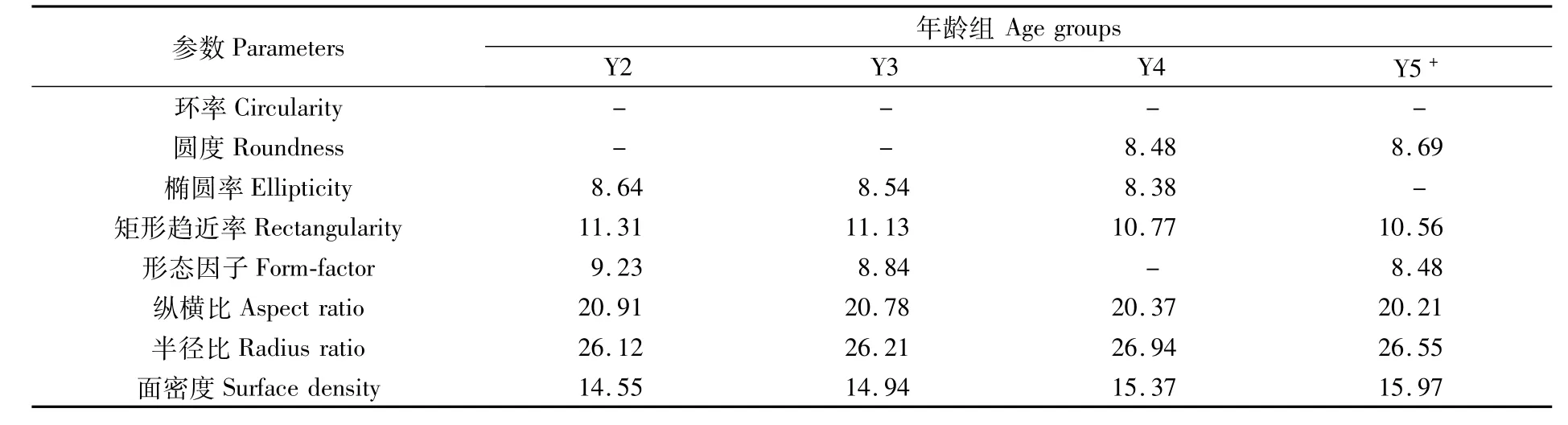
表5 各年龄组组内相似性累积贡献率大于90%的耳石形态典型指标Tab.5 Typical shape indices w ith their cum ulative contributionsmore than 90%to w ithin-group sim ilarity
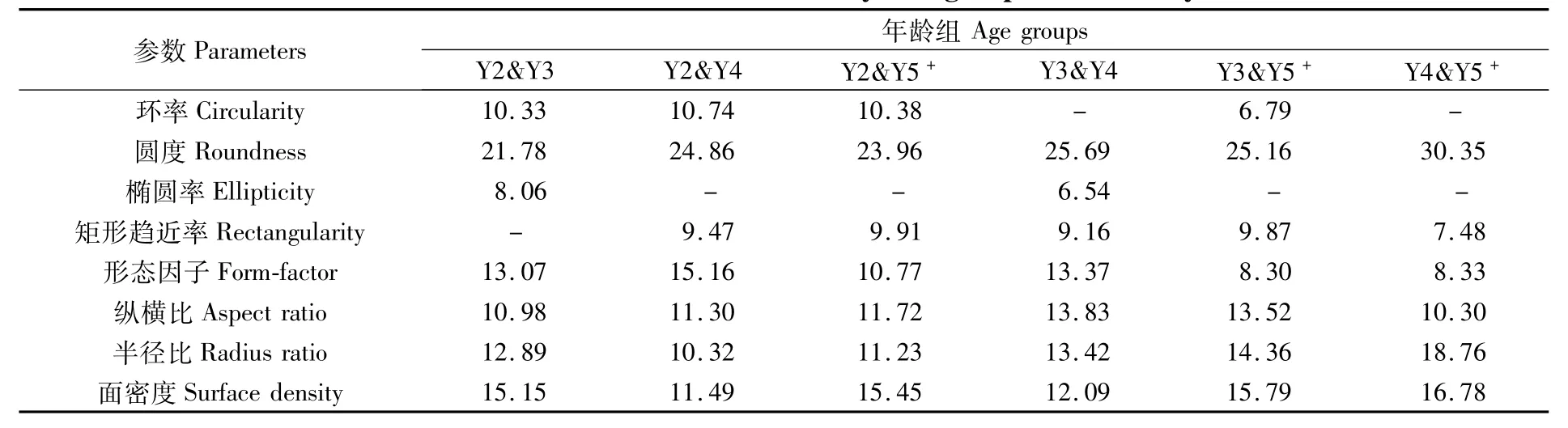
表6 年龄组间相异性累积贡献率大于90%的耳石形态分歧指标Tab.6 Discrim ination shape indices w ith their cumulative contributionsmore than 90%to every two groups dissim ilarity
3 讨论
3.1 蓝点马鲛耳石形态的个体差异
耳石形态特征主要受遗传因素的控制,多重环境-生物因素亦会对耳石的形态特征产生一定影响[24]。同一个体的左右耳石受相同遗传因素的控制,面临的环境及生物因素也相同,因此在耳石形态上没有显著区别。象山港蓝点马鲛的左右耳石不存在显著性差异,这与其它鱼类的研究结果一致[8]。但也有例外的种类,如拉式南美南极鱼(Patagonotothen ramsay)[25],其左右耳石存在不对称性,这是由鱼类自身的特性决定的。统计分析表明,象山港蓝点马鲛雌雄个体之间耳石形态的差异未达到雌雄二型水平,这与渤海、黄海蓝点马鲛群体的分析结果一致[26],相同的结果也出现在沙丁鱼(Sardina pilchardus)[27]、秋刀鱼(Cololabis saira)[28]等种类上。而狭鳞庸鲽(Hippoglossus stenolepis)[29]、阿根廷滑柔鱼(Illex argentinus)[30]耳石形态存在显著的雌雄差异,则与雌雄个体明显不同的生长速度有关,生长速度的差异可能会影响到耳石生长的同步性。
象山港蓝点马鲛不同年龄组的耳石形态存在显著差异,即随着蓝点马鲛的生长,其耳石形态会发生显著变化。环率、椭圆率随着年龄的增加而减小;圆度、半径比和面密度随着年龄的增加而增大。半径比、纵横比和面密度在组内的相似性贡献度较高,而圆度、面密度和半径比则是造成组间相异性的主要分歧指标。这些形态指标既有大小变量,又有轮廓变量。这意味着随着个体的生长和年龄的增加,蓝点马鲛的耳石外轮廓越趋于圆,半径变大,耳石变厚。有研究表明,耳石形态在鱼体达到性成熟后趋于稳定[31]。本研究选取2龄及以上性成熟样本,原则上排除了幼鱼耳石形态不稳定对实验结果的影响。造成耳石形态年龄组间差异的原因,有两种可能性。一种情况是,象山港蓝点马鲛的繁殖个体来自同一种群或地理群系,耳石形态不存在群体间的干扰,那么研究结果表明蓝点马鲛的耳石形态会随着个体的生长、年龄的增加而出现明显变异,蓝点马鲛的耳石在其多年的生命周期中并不均匀生长。刀鲚(Coilia nasus)的耳石形态也出现过类似情形[32]。CAMPANA等[33]发现年龄是影响大西洋鳕(Gadusmorhua)的耳石形态特质及其在群体判别效果的一个关键因素。因此,在今后以耳石形态判别蓝点马鲛种群的研究中,应当首先考虑样本的年龄因素,以同一年龄为宜。另一种可能的情况是,蓝点马鲛的耳石形态保持稳定,随着年龄均匀生长,并不呈现年龄间的差异,象山港是多个蓝点马鲛种群或地理群系共同的产卵场,研究样本来源于不同群体,年龄间耳石形态的差异其实受到了群体差异的影响,显示出了多样性特征。这种耳石形态的多样性在大西洋鲱(Clupea harengus)[34]、拉式南美南极鱼[25]的研究过程中也有发现。
3.2 蓝点马鲛耳石形态特征的应用
耳石形态具有种类和群系特异性,耳石形态学分析可以解释群体间的差异,在鱼类群体识别和系统分类方面有着良好应用。耳石形态特征不但与遗传相关,而且受鱼类生理活动和环境变化的影响。不同种类的耳石形态主要取决于遗传因素,但生存环境的异质性也可以导致同一种类的不同群体之间产生耳石的个体形态差异,如水温等环境因子以及摄食活动或营养状况会通过作用于耳石沉积而影响耳石形态[35-36]。蓝点马鲛在中国沿海的分布广泛,不同群体经历的生活史和环境史履历可能存在较大差异。已有研究显示[26,37],从长江口南越冬场进入黄渤海蓝点马鲛为同一种群,但渤海与黄海在海流、水温、饵料等生物环境因素方面的较大差异,导致了蓝点马鲛渤海群系和黄海群系的耳石形态存在一定的特异性,识别度较高。这印证了物理-化学环境及生物环境在空间上的差异能够作用于鱼类个体和耳石的生长,进而造成不同群体耳石形态的特异性。不同年龄的鱼类个体所经历的环境条件在时间上序列上存在差别,年龄越大,个体的环境履历越丰富。物理-化学环境及生物环境在时间上的差异也可能会导致象山港不同年龄的蓝点马鲛耳石形态产生差异。
蓝点马鲛具有长距离的洄游习性,产卵场众多,种群结构复杂。历史资料认为[14-16],黄渤海蓝点马鲛为一个种群;东海北部、中部和南部的蓝点马鲛同属一个种群;各个种群内又分化为不同的地理种群。而标记放流的结果显示[2],黄海北部与东海南部的蓝点马鲛群体存在着长距离的联系。因此,以耳石形态学方法研究中国沿海蓝点马鲛的种群问题需要全面采集不同产卵场同一年龄的繁殖群体。黄渤海蓝点马鲛的研究结果证明[26],耳石形态学分析是一种简单而高效的群体区分方法,但也存在着一定的局限性,即识别成功率和正确率受环境因素的影响较大。在这方面,耳石元素指纹分析可以推断鱼类过去生存水域的环境状况,这为蓝点马鲛的种群鉴定提供了有效辅助手段。
本研究以象山港蓝点马鲛繁殖群体为研究对象,确定了耳石形态在不同性别及年龄组之间的差异,为今后蓝点马鲛的耳石形态研究提供了方法借鉴。象山港蓝点马鲛耳石形态差异的原因及种群结构是否单一还需要结合耳石元素指纹分析技术进一步确认。耳石核区元素指纹主要与个体出生地的水化学组成密切相关,各群体的耳石核区元素指纹的特性比较稳定,具备较高的群体识别能力。因此,利用耳石形态学与元素指纹分析技术探讨中国沿海各个产卵场蓝点马鲛繁殖群体的种群或群系来源、各群体对产卵场的选择以及蓝点马鲛产卵是否回溯将成为接下来的重点研究方向。
[1] 唐启升.中国区域海洋学-渔业海洋学 [M].北京:海洋出版社,2012:67-69.TANG Q S.Regional Oceanography of China Seas-Fisheries Oceanography[M].Beijing:China Ocean Press,2012:67-69.
[2] 郑元甲,李建生,张其永,等.中国重要海洋中上层经济鱼类生物学研究进展 [J].水产学报,2014,38(1):159-172.ZHENG Y J,LIJS,ZHANG Q Y,et al.Research progress of resource biology of important marine pelagic food fishes in China[J].Journal of Fisheries of China,2014,38(1):159-172.
[3] 宋 超,王宇坛,刘尊雷,等.象山港蓝点马鲛鱼卵、仔稚鱼的时空分布特征及其与环境因子关系 [J].中国水产科学,2016,23(5):1197-1204.SONG C,WANG Y T,LIU Z L,etal.Relationship between environmental factors and distribution of Scomberomorusniphonius eggs,larvae,and juveniles in Xiangshan Bay[J].Journal of Fishery Sciences of China,2016,23(5):1197-1204.
[4] 王宇坛,李圣法,杨林林,等.象山港春、夏季仔稚鱼种类组成结构特征 [J].海洋渔业,2017,39(3):286-296.WANG Y T,LI S F,YANG L L,et al.Species composition of larval and juvenile fish in the Xiangshan Bay in Spring and summer[J].Marine Fisheries,2017,39(3):286-296.
[5] CAMPANA S E.Photographic atlas fish otoliths of the Northwest Atlantic Ocean[M].Ottawa:NRC Research Press,2004.
[6] 张凤侠,张秀梅,覃乐政,等.基于矢耳石形态的平鲉属(Sebastes)鱼类鉴别及研究方法比较[J].海洋学报,2015,37(4):28-39.ZHANG F X,ZHANG X M,QIN L Z,et al.Sagittaemorphology used in the discrimination of the fish of Sebastes and the parison of sagittal research method[J].Acta Oceanologica Sinica,2015,37(4):28-39.
[7] MAISEY JG.Notes on the structure and phylogeny of vertebrate otoliths[J].Copeia,1987(2):495-499.
[8] 叶振江.中国海洋鱼类耳石形态学分析及应用研究 [D].青岛:中国海洋大学,2010.YE Z J.Study on otolith shape,taxonomy and application for fishes in China sea[D].Qingdao:Ocean University of China,2010.
[9] 秦 岩,潘晓哲,高天翔.鲬鱼耳石形态多样性研究 [J].水生生物学报,2013,37(4):759-765.QIN Y, PAN X Z, GAO T X. Study on morphological diversity of sagittae of Platycephalus indicus[J].Aquatic Biology,2013,37(4):759-765.
[10] 潘晓哲,高天翔.基于耳石形态的鱚属鱼类鉴别[J].动物分类学报,2010,35(4):799-805.PAN X Z,GAO T X.Sagittal otolith shape used in the discrimination of fishes of the Genus Sillago in China[J].Acta Zootaxonomica Sinica,2010,35(4):799-805.
[11] 郭弘艺,魏 凯,唐文乔,等.基于矢耳石形态特征的中国鲚属鱼类种类识别 [J].动物分类学报,2010,35(1):127-134.GUO H Y,WEI K,TANG W Q,et al.Sibling species discrimination for Chinese genus of Coilia fishes based on sagittal otolithmorphology[J].Acta Zootaxonomica Sinica,2010,35(1):127-134.
[12] AGÜERA A,BROPHY D.Use of saggital otolith shape analysis to discriminate Northeast Atlantic and Western Mediterranean stocks of Atlantic saury,Scomberesox saurus(Walbaum) [J].Fisheries Research,2011,110(3):465-471.
[13] LORD C,MORAT F,LECOMTE-FINIGER R,et al.Otolith shape analysis for three Sicyopterus(Teleostei:Gobioidei: Sicydiinae) species from New Caledonia and Vanuatu[J].Environmental Biology of Fishes,2012,93(2):209-222.
[14] 韦 晟,周彬彬.渤、黄海蓝点马鲛种群鉴别的研究 [J].动物学报,1988,34(1):71-81.WEI C, ZHOU B B. The identifications of populations of the Spanish mackerel,Scomberomorus niphonius(Cuvier Valenciennes)in the Bohai Sea and the Yellow Sea[J].Acta Zoologica Sinica,1988,34(1):71-81.
[15] 黄克勤,熊国强.东海蓝点马鲛种群鉴别研究[J].水产科技情报,1997,24(6):270-275.HUANG KQ,XIONGGQ.Population identification of Spanish mackerel,Scomberomorus niphonius(Cuvier Valenciennes)in the East China Sea[J].Fisheries Science&Technology Information,1997,24(6):270-275.
[16] 水柏年,孙希福,韩志强,等.黄海、东海蓝点马鲛群体的形态特征分析.水产学报,2009,33(3):445-451.SHUI B N, SUN X F, HAN Z Q, et al.Morphological variation analysis among populations of Japanese Spanish mackeral Scomberomorus niphonius in the Yellow Sea and East China Sea[J].Journal of Fisheries of China,2009,33(3):445-451.
[17] SHUIBN,HAN ZQ,GAO TX,etal.Mitoehondrial DNA variation in the East China Sea and Yellow Sea populations of Japanese Spanish mackerel Scomberomorus niphonius[J].Fisheries Science,2009,75(3):593-600.
[18] 曹 艳,章 群,宫亚运,等.基于线粒体COI序列的中国沿海蓝点马鲛遗传多样性[J].海洋渔业,2015,37(6):485-493.CAO Y,ZHANG Q,GONG Y Y,et al.Genetic variation of Scomberomorus niphonius in the coastal waters of China based on mtDNA COI sequences[J].Marine Fisheries,2015,37(6):485-493.
[19] SHUI B N,HAN Z Q,GAO T X,et al.Genetic structure of Japanese Spanish mackerel(Scomberomorus niphonius)in the East China Sea and Yellow Sea inferred from AFLP data[J].African Journal of Biotechnology,2008,21(7):3860-3865.
[20] TUSET V M,LOMBARTE A,GONZALEZ JA,et al.Comparativemorphology of the sagittal otolith in Serranus spp.[J].Journal of Fish Biology,2003,63(6):1491-1504.
[21] CAЙÁS L,STRANSKY C,SCHLICKEISEN J,et al.Use of the otolith shape analysis in stock identification of anglerfish(Lophius piscatorius)in the Northeast Atlantic[J].ICES Journal of Marine Science:Journal du Conseil,2012,69(2):250-256.
[22] 徐胜勇,张 辉,潘晓哲,等.许氏平鲉群体耳石形态学比较 [J].中国海洋大学学报,2012,42(11):54-61.XU S Y, ZHANG H, PAN X Z, et al.Morphological comparison of the otolith of Sebastes schlegelii populations[J].Periodical of Ocean University of China,2012,42(11):54-61.
[23] CLARKE K R,WARWICK R M.Change in marine communities:An approach to statistical analysis and interpretation[M].Plymouth:PRIMER-E Limited,2001:1-12.
[24] 于 鑫,曹 亮,南 鸥,等.基于矢耳石形态分析的凤鲚 (Coiliamystus)群体识别研究 [J].海洋与湖沼,2013,44(3):768-774.YU X,CAO L,NAN O,et al.Stock identification of Coilia mystus using otolith shape analysis[J].Oceanologia Et Limnologia Sinica,2013,44(3):768-774.
[25] 张凤侠,刘 岩,张秀梅.西南大西洋拉氏南美南极鱼耳石形态的多样性 [J].中国水产科学,2014,21(3):581-592.ZHANG F X,LIU Y,ZHANG X M.Morphological diversity of sagittae of Patagonotothen ramsayi in the southwestern Atlantic Ocean[J].Journal of Fishery Sciences of China,2014,21(3):581-592.
[26] 张 弛.鱼类耳石形态在蓝点马鲛群体识别和皮氏叫姑鱼年龄估算上的应用实例[D].青岛:中国海洋大学,2012.ZHANG C.Application ofotolithmorphology in stock separation of Scomberomorus niphonius and age estimation of Johnius belengerii[D].Qingdao:Ocean University of China,2012.
[27] 胡贯宇,叶旭昌,方 舟,等.摩洛哥南部沿岸沙丁鱼耳石与生长的关系[J].海洋渔业,2014,36(2):123-130.HU G Y,YE X C,FANG Z,et al.Relationship between otolith growth and shape of Sardina pilchardus in south coastal waters of Morocco[J].Marine Fisheries,2014,36(2):123-130.
[28] 朱清澄,杨明树,高玉珍,等.西北太平洋秋刀鱼耳石生长与性成熟度、个体大小的关系 [J].上海海洋大学学报,2017,26(2):263-270.ZHU Q C,YANG M S,GAO Y Z,et al.The relationship between statolith growth,sexualmaturity and body size of Cololabis saira in the Northwest Pacific Ocean[J].Journal of Shanghai Ocean University,2017,26(2):263-270.
[29] FORSBERG J E,NEAL P R.Estimating sex of Pacific halibut(Hippoglossus stenolepis): using Fourier shape analysis of otoliths.Technical Reports(IPHC),1993(110):75-83.
[30] 陆化杰,陈新军,刘必林.个体差异对西南大西洋阿根廷滑柔鱼耳石形态的影响[J].水产学报,2011,35(2):247-254.LU H J,CHEN X J,LIU B L.Effects of individual difference on statolith morphology of Illex argentinus in the southwest Atlantic Ocean[J].Journal of Fisheries of China,2011,35(2):247-254.
[31] CAMPANA SE.Photographic atlas of fish otoliths of the Northwest Atlantic Ocean[M].Ottawa:NRC Research Press,2004.
[32] 窦硕增,于 鑫,曹 亮.鱼类矢耳石形态分析及其在群体识别中的应用实例研究 [J].海洋与湖沼,2012,43(4):702-712.DOU SZ,YU X,CAO L.Otolith shape analysis and its application in fish stock discrimination:A case study[J].Oceanologia Et Limnologia Sinica,2012,43(4):702-712.
[33] CAMPANA SE,CASSELMAN JM.Stock discrimination using otolith shape analysis[J].Canadian Journal of Fisheries and Aquatic Sciences,1993,50:1062-1083.
[34] MESSIEH SN.Use of otoliths in identifying herring stocks in the southern Gulf of St.Lawrence and adjacent waters[J]. Journal of the Fisheries Research Board of Canada,1972,29(8):1113-1118.
[35] CARDINALE M,DOERING-ARJESP,KASTOWSKY M,et al.Effects of sex,stock,and environment on the shape of known-age Atlantic cod(Gadus morhua)otoliths[J].Canadian Journal of Fisheries and Aquatic Sciences,2004(61):158-167.
[36] GAGLIANO M,MCCORMICK M I.Feeding history influences otolith shape in tropical fish[J].Marine Ecology Progress Series,2004(278):291-296.
[37] ZHANG C,YE Z,PANHWAR S K,et al.Stock discrimination of the Japanese Spanish mackerel(Scomberomorus niphonius) based on the otolith shape analysis in the Yellow Sea and Bohai Sea[J].Journal of Applied Ichthyology,2013(29):368-373.
