基于EwE模型的三疣梭子蟹、凡纳滨对虾和梭鱼混养系统的能流分析❋
2018-02-28田相利董双林何瑞鹏张东旭海水养殖教育部重点实验室中国海洋大学山东青岛266003
奉 杰, 田相利, 董双林, 何瑞鹏, 张东旭, 王 润 (海水养殖教育部重点实验室(中国海洋大学),山东 青岛 266003)
近些年来,中国水产养殖业快速发展,养殖产量和规模不断扩大。然而,在我国大部分地区,水产养殖的主要运营方式依然以小规模个体养殖为主,这为养殖模式的有效推广和养殖管理的协调统一带来挑战,养殖污染和病害在一些地方难于得到有效控制,导致养殖产品质量难于匹配市场要求[1]。2006年,联合作粮农组织提出从生态系统水平来发展水产养殖的理念(Ecosystem approach to aquaculture,EAA),其核心在于通过多学科、多部门之间的协调合作实现水产养殖与社会、经济、环境各方面相协调的可持续发展[2]。基于EAA从生态系统水平视角下发展水产养殖的理念[3],作者所在团队建立了多种以多元混养模式为主的三疣梭子蟹(Portunustrituberculatus)高效清洁综合养殖模式[4-5]。其中,三疣梭子蟹与凡纳滨对虾(Litopenaeusvannamei)和梭鱼(Lizahaematocheli)的搭配养殖模式是其中优化出的一种多营养级综合养殖模式[5]。
关于三疣梭子蟹综合养殖池塘生态特征的研究,已有多项研究从各方面对其进行了探讨,包括三疣梭子蟹多元养殖系统的结构优化[4-6],能量收支[7]、有机碳收支[8-9]、能值分析[10]、氮磷收支[11-13]、有机碳储量[8,14],以及浮游植物[15-16]、浮游动物[16-17]、浮游细菌群落结构特征[18-19]、微生物功能多样性[20]等方面的研究。但是从生态系统层面对该养殖模式能量流动和营养结构特征等方面的研究则未见相关报道。Ecopath with ecosim (EwE)模型将多个领域的知识[21-24](包括热力学、信息理论、营养级描述和网络分析等)利用到对生态系统的研究中,是从生态系统层面对水域生态系统的能量流动和结构功能进行量化研究的有效工具[25]。本文利用该模型对三疣梭子蟹-凡纳滨对虾-梭鱼三元混养生态系统中的能量资源的利用情况、能量流动特征和相关的系统功能特征等方面进行了探究,以期为进一步优化和完善三疣梭子蟹综合养殖技术提供相关的科学依据。
1 材料和方法
1.1 研究对象
本实验采用陆基围隔实验法[26],于2014年7—10月在江苏省连云港市赣榆区佳信水产开发有限公司海水池塘养殖基地进行。实验选取4个大小相同、处理完全一致的三疣梭子蟹-凡纳滨对虾-梭鱼三元混合养殖生态系统为研究对象。实验围隔建于面积2.66 hm2,水深1.6~1.7 m 的海水池塘中,每个面积为25 m2(5 m×5 m)。为防止和减少梭子蟹因交配和争夺饵料而互相残杀,在每个围隔内池底设置瓦片等隐蔽物。围隔木桩上挂置蟹笼和饵料盘用于检查生长和观察摄食。时间为一个完整的养殖周期(从2014年7月13日—10月13日,90 d)。实验期间,气温变化在8.0~36.0 ℃之间,降水量为616.1 mm;平均风速为2.03 m/s(气温、降水量及风速由江苏省气象局提供)。池塘水温变化在19.0~33.5 ℃之间,最高和最低水温分别出现在7和10月;水温溶解氧变化范围在3.25~10.72 mg/L之间;盐度变化范围是26.5~31.0;在整个养殖期间,盐度仅在雨季有所下降,随后又快速上升,整体变化幅度不大。养殖期间pH在7.55~8.38之间。
实验用三疣梭子蟹购自连云港市赣榆区佳信水产开发有限公司,凡纳滨对虾购于青岛市胶州宝荣水产有限公司,梭鱼苗为海捕鱼苗。放养时三疣梭子蟹、凡纳滨对虾和梭鱼个体平均体重分别为(0.48±0.17)、(0.05±0.01)和(0.67±0.09)g。放养密度分别为6、45和4.5 ind·m-2。相关的实验管理参见文献[13]。
1.2 模型构建
1.2.1基本方程 组模型根据能量守恒和物质平衡原理,模型通过建立一组联立线性方程组对生态系统内各功能组的能量流动或物质流动进行描述,然后建立食物网并使生态系统达到平衡,从而得到目标生态系统在特定时间的静态平衡模型。用于平衡每一个功能组的基本方程为[27-28]:
(1)
式中:对功能组(i)而言,Pi是其生产量;Bi为其生物量(可用湿重、干重、能量、营养元素含量如C、N等表示);EEi为其生态营养学效率(Ecotrophic Efficiency);Qj是被捕食者捕食部分;BAi则为功能组(i)的生物量积累率;DC是一个n×m的食物组成矩阵(其中:n为捕食者数目,m为被捕食者数目),用于描述各功能组之间的捕食和被捕食关系;DCji指被捕食者(i)在捕食者(j)的食物组成中所占的比例;Yi为捕捞量或者收获量;Ei为净迁移率(迁出减去迁入)。由于各功能组间复杂的营养物质传递关系,该公式还可以多种形式表达[29]。
1.2.2 功能组设置 根据EwE模型的功能组定义和设置原则,本研究将三疣梭子蟹-凡纳滨对虾-梭鱼三元混合养殖生态系统划分为17个生态功能组,即:三疣梭子蟹、凡纳滨对虾、梭鱼、大型底栖动物(直径大于500 μm,主要为多毛类)、小型底栖动物(直径小于500 μm,主要为多毛类与线虫类)、大型浮游动物(直径大于149 μm,主要为桡足类与浮游软体动物)、小型浮游动物(直径小于149 μm,主要为桡足幼体与轮虫类)、底栖细菌、浮游细菌、小型浮游植物(粒径大于38 μm)、微型浮游植物(粒径在10~38 μm之间)、微微型浮游植物(粒径小于10 μm)、附壁植物、人工饵料-蓝蛤(Aloidislaevis)、对虾饲料、底泥碎屑和水体碎屑功能组。其中,由于细菌和碎屑在水体和底泥中的能量利用存在一定差别,因此本文分别将其划分为浮游细菌和底泥细菌,以及水体碎屑和底泥碎屑功能组。人工投喂饵料蓝蛤和对虾饲料由于仅为系统提供能量来源,因此二者均作为碎屑功能组处理。在该模型中,设定碎屑功能组人工投喂饵料蓝蛤、对虾饲料和水体碎屑中未被利用完全的生物量最终均流向底泥碎屑功能组。
1.2.3 数据来源 对每一功能组,要求必须输入的参数包括生物量(B)、P/B系数、Q/B系数以及食物组成矩阵等。文中所有数据均采用平均值,各数据的获取方式如下所示:
生物量(B) 本研究生物量采用kJ· m-2为计算单位,文中所有功能组的生物量均通过现场实验测定并计算获得。
P/B系数 三疣梭子蟹和凡纳滨对虾和梭鱼的P/B系数通过其放养量、收获量数据和整个养殖期间采获样品平均重量计算获得。所有浮游植物生物功能组的P/B系数通过黑白瓶法[30]进行现场实验测定,浮游细菌的P/B系数通过挂瓶测定其生产力并采样测定其生物量计算得来[31],浮游动物及底栖细菌的P/B系数通过测定其呼吸量进而根据p/q系数值转换得来,其中大、小型浮游动物及底栖细菌的p/q系数均取0.30[32-35]。另外大、小底栖动物的P/B系数参考文献[36]得来。
Q/B系数 三疣梭子蟹和凡纳滨对虾的Q/B值根据其每天的摄食量计算得来[37-38]。大、小型浮游动物[39]及浮游细菌[31]的Q/B值通过现场挂瓶实验测定呼吸后,再计算得来。底栖细菌的Q/B系数通过测定底泥呼吸量[40],取底栖细菌呼吸量为底泥呼吸量的0.64进而计算得来[41]。大型和小型底栖动物、梭鱼的Q/B数据参考文献[36 ,42]得来。
食性组成:利用稳定性碳同位素技术并参考相关文献对三疣梭子蟹、凡纳滨对虾、梭鱼[43-44]、大型底栖动物[45-46]、小型底栖动物[47-48]、大型浮游动物[49]、小型浮游动物[49]的食物来源进行了分析,底栖细菌和浮游细菌的食物来源参考文献[50],具体的食物组成矩阵见表1。
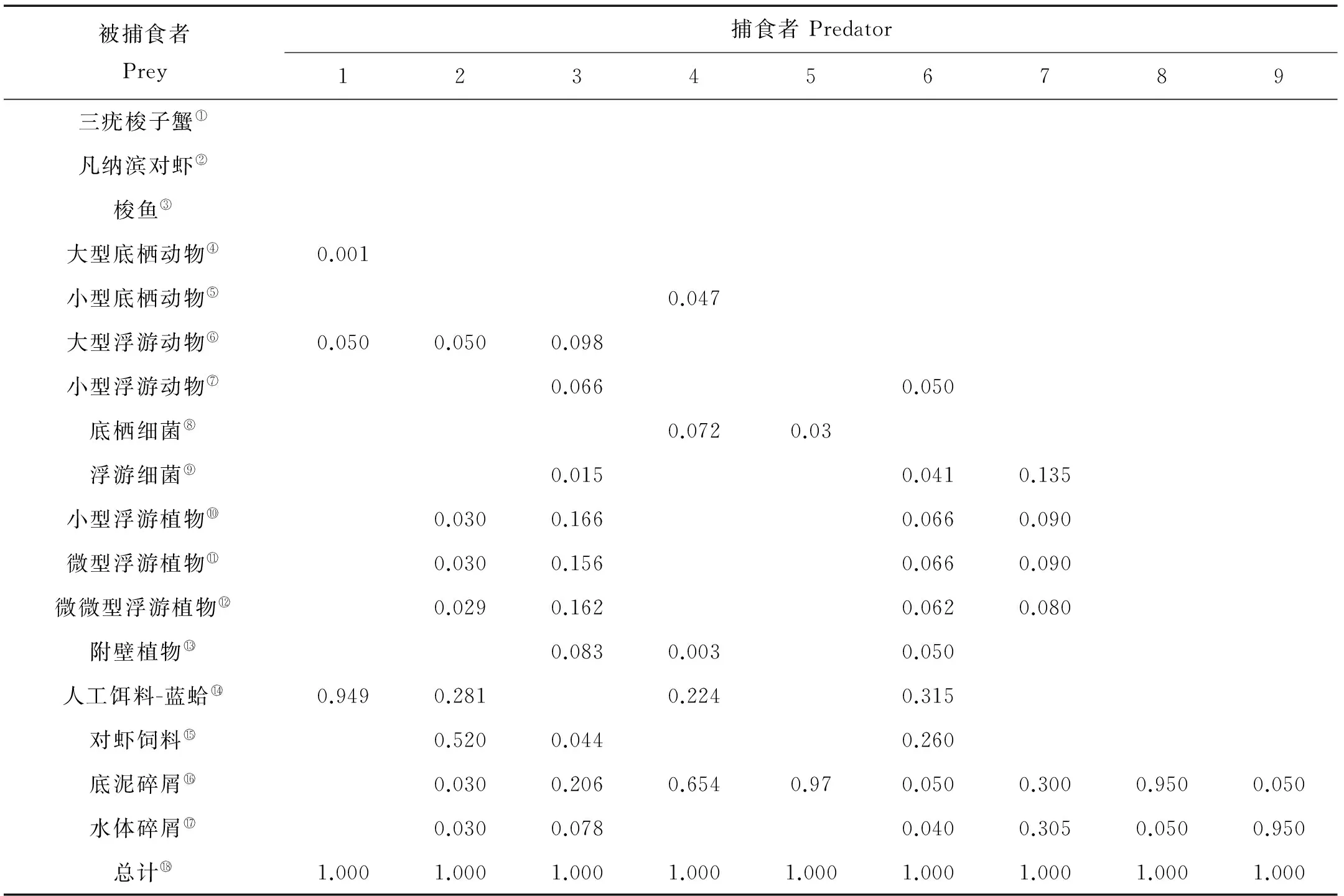
表1 虾蟹鱼混养生态系统各消费者食物组成矩阵
注:表中数值代表被捕食者生物功能组在捕食者生物功能组的食物组成中所占的比例大小。
Note: Values entered in the columns represent the proportion of each prey group in the predator’s diet.
*:PPL为Portunustrituberculatus-Litopenaeusvannamei-Lizahaematocheli的缩写,下文图、表同。PPL is the abbreviation forPortunustrituberculatus-Litopenaeusvannamei-Lizahaematocheli,the same as in following figures and tables.
①Portunustrituberculatus; ②Litopenaeusvannamei; ③Lizahaematocheli; ④Macrobenthos; ⑤Microbenthos; ⑥Macrozooplankton; ⑦Microzooplankton; ⑧Benthic bacteria; ⑨Bacterioplankton; ⑩Micro-phytoplankton;Nano- phytoplankton;Pico- phytoplankton;Periphyte;Aloidislaevis;Shrimp feeds;Detritus in sediment;Detritus in water;Total value.
未同化吸收食物比例:梭鱼、大型底栖动物、小型底栖动物、大型浮游动物和小型浮游动物的未同化吸收食物比例分别取值0.3、0.4、0.3、0.4和0.4,其余各消费者生物未同化吸收食物比例值取值0.2[51-52]。
1.3 模型平衡
在模型平衡调试过程中,首先将EE<1作为其基本限制条件。如果某一功能组的EE>1,则逐步调整其食物组成(±5%每次),直到所有功能组的EE<1。然后检查所有的功能组的呼吸值(R)是否为负值,如果存在这种情况,则按照活动能力越强,R/B值越高的原则,通过调整其P/B或Q/B值,使模型达到平衡并进行一致性检验。最后采用Pedigree指数对模型质量(可信度)进行评价,Pedigree指数值越高,表明模型可信度越大,越接近于系统的真实状况,评价标准详见Christensen[29]等的描述。
2 结果
2.1 生态营养学效率(EE)
虾蟹鱼混养生态系统中各功能组EE值如表2所示。在该系统中,养殖生物三疣梭子蟹、凡纳滨对虾和梭鱼一部分在养殖过程中死亡,剩余部分在养殖结束时被全部收获。三者均表现出很高的EE值,其值分别为0.95、0.96和0.92。除此以外,底泥碎屑、小型浮游动物和对虾饲料功能组也表现出了很高的EE值,其值分别为0.95、0.95、和0.96。另外,大型浮游动物和人工饵料蓝蛤的EE值也较高,两者大小均为0.87。该系统中EE值最低的2个生物功能组是底栖细菌和小型底栖动物生物功能组,其EE值分别为0.001和0.02。其次,微微型浮游植物也表现出很低的EE值,其值为0.11。另外,浮游细菌、微型浮游植物和水体碎屑功能组的EE值较低,其EE值分别为0.31、0.32和0.33。整体来看,本养殖生态系统中人工输入的饵料蓝蛤和对虾饲料均得到了较充分的利用。在本模型设定中,未被利用完全的各碎屑功能组生物量最终流向底泥碎屑功能组,底泥碎屑功能组的高EE值表明本实验中绝大部分的碎屑生物经过循环再利用重新进入了养殖生态系统食物网。养殖生态系统中微微型浮游植物和微型浮游植物的利用率较低,表明系统对来源于初级生产者的生物能量利用率略显不足。各生物功能组中未被完全利用的生物能量流入水体碎屑或者底泥碎屑功能组,被重新摄食利用或者以碎屑能积累的形式停留在养殖系统中。

表2 虾蟹鱼混养生态系统EwE模型的基本输入数据和测定值
注:*Portunustrituberculatus-Litopenaeusvannamei-Lizahaematocheli.
①Portunustrituberculatus; ②Litopenaeusvannamei; ③Lizahaematocheli; ④Macrobenthos; ⑤Microbenthos; ⑥Macrozooplankton; ⑦Microzooplankton; ⑧Benthic bacteria; ⑨Bacterioplankton; ⑩Micro-phytoplankton;Nano- phytoplankton;Pico- phytoplankton;Periphyte;Aloidislaevis;Shrimp feeds;Detritus in sediment;Detritus in water.
2.2 混合营养级效应分析
图1为虾蟹鱼混合养殖态系统的混合营养级效应(Mixed trophic impact,MTI)分析结果。从图1上可以看出,在各消费者生物功能组中,除大、小型浮游动物外,其它消费者功能组都表现出对自身较强的负面影响,反映出各功能组内部较强的密度制约效应。除却各功能组对自身的负面影响,凡纳滨对虾对对虾饲料和大型浮游动物表现出较强的负面影响。主要原因应该是对虾对二者的摄食作用所致。梭鱼对系统中初级生产者,包括小、微、微微型浮游植物和附壁植物具有较强的负面影响,对大、小型浮游动物也具有一定的负面影响,体现出梭鱼较为广的摄食范围。大型浮游动物除了对小型浮游动物具有较强的负面影响外,对小、微、微微型浮游植物和附壁植物功能组也具有一定的负面影响,表现出对系统较大的影响力。养殖生物三疣梭子蟹、凡纳滨对虾和梭鱼彼此之间也表现出一定的负面效应,这可能是由于三者在食性上存在一定的重叠之处[11,43,53]。碎屑功能组人工饵料蓝蛤、对虾饲料、水体碎屑和底泥碎屑对系统中大部分消费者生物功能组都表现出很强的正面影响,显示出碎屑能量来源在该养殖系统食物来源中重要的地位,上行效应显著。小、微、微微型浮游植物功能组对梭鱼具有一定的正面效应,而对养殖系统中其它生物功能组的影响则无明显表现。

(图中圈大小代表功能组之间影响力的大小。The size of the circle is proportional to the influence between two groups.)
2.3 营养级结构
划分营养级是为了简化和归并生态系统内复杂的食物网关系[54],对描述和揭示系统的结构功能特征具有重要意义。如表3所示,系统中各生物功能组生物量分布在1~5个营养级之间,但系统各生物功能组分布在营养级Ⅲ、Ⅳ、V的生物量非常低,各生物功能组生物量主要分布在第I或第II营养级。生态系统中各功能组之间的能量流动如图2所示。有效营养级是根据各功能组在各整数营养级间的能量流比例与所在营养级相乘,最后各营养级加和而得到的数值。相比于整合营养级,有效营养级可以更有效的反映各生物功能组能量流在各营养级之间的分布[55]。模型计算的该养殖生态系统各功能组的有效营养级如表3 所示。从表上可以看出,有效营养级最高的为梭鱼功能组,其值为2.197。
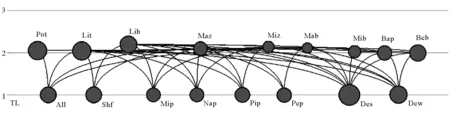
(All: 人工饵料蓝蛤Aloidislaevis;Shf: 对虾饲料 Shrimp feeds;Mip 小型浮游植物 Micro-phytoplankton;Nap:微型浮游植物Nano-phytoplankton;Pip: 微微型浮游植物 Pico-phytoplankton;Pep:附壁植物 Periphyte;Pot:三疣梭子蟹Portunustrituberculatus;Lit:凡纳滨对虾Litopenaeusvannamei;Lih:梭鱼Lizahaematocheli;Mab:大型底栖动物Macrobenthos;Mib:小型底栖动物 Microbenthos;Maz:大型浮游动物 Macrozooplankton;Miz;小型浮游动物 Microzooplankton;Beb:底栖细菌Benthic bacteria;BaP:水体细菌Bacterioplankton; Des: 底泥碎屑 Detritus in sediment; Dew:水体碎屑 Detritus in water;TL: 营养级 Trophic level)
图2 虾蟹鱼混养生态系统各功能组的营养级与能量流动
Fig.2 Trophic level and energy flow of the groups in PLL polyculture ecosystem

表3 虾蟹鱼混养生态系统各功能组生物量在不同整合营养级的分布
Note:①Portunustrituberculatus; ②Litopenaeusvannamei; ③Lizahaematocheli; ④Macrobenthos; ⑤Microbenthos; ⑥Macrozooplankton; ⑦Microzooplankton; ⑧Benthic bacteria; ⑨Bacterioplankton; ⑩Micro-phytoplankton;Nano-phytoplankton;Pico-phytoplankton;Periphyte;Aloidislaevis;Shrimp feeds;Detritus in sediment;Detritus in water.
2.4 营养级间的物质流动
虾蟹鱼混养生态系统各营养级间的能量流动模型计算结果见图3。该系统中营养级Ⅰ的能量流通量最大,占系统总能量流通量(Total system throughput, TST)的63.47%,营养级Ⅱ、Ⅲ、Ⅳ、Ⅴ的总能量流通量随着营养级的增加而递减,分别为35.39%、1.05%、0.09%和0.004%。从图3中可以看出,初级生产者的生物量为72.35 kJ·m-2,其能量流占系统TST的11.48%。其中,9 087.73 kJ·m-2·90 d-1流向了碎屑组,2 784.02 kJ·m-290·d-1被营养级Ⅱ所摄食,流向营养级Ⅱ的生物能量占初级生产总能量的比例为23.45%。碎屑总能量流通量占系统TST的比例为52.00%。除第一营养级外,其它各营养级流向碎屑组的量总计15 220.36 kJ·m-2·90 d-1。在所有流入碎屑功能组的总生物能量中,有33 543.05 kJ·m-2·90 d-1在系统中被重新利用进入养殖系统食物链,占总进入碎屑功能组能量比例为97.15%。在该系统中,营养级Ⅱ的传输效率(Transfer efficiency,TE)为8%,低于10%的Lindeman平均能量传输效率[54],传输效率偏低。
2.5 碎屑组能流比例和流向碎屑组能量流量
如表4所示:首先,各功能组来自碎屑组的能流比例最高的是底栖细菌、水体细菌和小型底栖动物,其比例为1,表明其食物完全来源于碎屑功能组。其次,三疣梭子蟹和大型底栖动物生物功能组也表现出很高的来自碎屑组能流比例,其比例分别为0.987和0.997,这显然和三疣梭子蟹大型底栖动物的食物来源分别来自于碎屑功能组人工饵料蓝蛤和底泥碎屑有关。凡纳滨对虾也表现出了较高的来自碎屑组能流比例,其值为0.899。各生物功能组中来自碎屑能流比例最低的是梭鱼生物功能组,其值为0.391,说明梭鱼更多的食物来源来自于初级生产者,对碎屑组能量的依赖度较低。在养殖期间各功能组流向碎屑组的能量流中,流向碎屑组能量最多的是底栖细菌,其流量为9 958.60 kJ·m-2·90d-1,这也说明底栖细菌有大量的生物能量未被更高一级的相关捕食者所摄食。其次是微微型浮游植物,为6 096.85 kJ·m-2·90 d-1。微微型浮游植物相比于小型和微型浮游植物,在本实验中具有更高的生物周转率,生产力更高,相关捕食者的缺乏可能使得其大量的生产力未被利用而流向了碎屑功能组。另外,微型浮游植物、凡纳滨对虾、浮游细菌、大型浮游动物、水体细菌和的流向碎屑能量均超过1 000 kJ·m-2·90 d-1。在本养殖系统中,经水体碎屑流向底泥碎屑的能量流量为8 476.08 kJ·m-2·90 d-1,底泥能量的沉积量为984.00 kJ·m-2·90 d-1,占底泥碎屑生物量的23.10%。

(P: 生产者 Primary producers; D:碎屑Detritus)

功能组Functionalgroups来源于碎屑流比例Flowfromdetritus流向碎屑流能量Flowtodetritus/kJ·m-2·90d-1三疣梭子蟹①0.987538.32凡纳滨对虾②0.8991378.36梭鱼③0.391665.74大型底栖动物④0.9976.64小型底栖动物⑤1.00054.14大型浮游动物⑥0.7441071.06小型浮游动物⑦0.740373.07底栖细菌⑧1.0009958.60浮游细菌⑨1.0001117.87小型浮游植物⑩0.000678.98微型浮游植物0.0001668.31微微型浮游植物0.0006096.85附壁植物0.000643.59人工饵料-蓝蛤0.000744.62对虾饲料0.000195.86底泥碎屑0.0008476.08水体碎屑0.000984.00
Note:①Portunustrituberculatus; ②Litopenaeusvannamei; ③Lizahaematocheli; ④Macrobenthos; ⑤Microbenthos; ⑥Macrozooplankton; ⑦Microzooplankton; ⑧Benthic bacteria; ⑨Bacterioplankton; ⑩Micro-phytoplankton;Nano-phytoplankton;Pico-phytoplankton;Periphyte;Aloidislaevis;Shrimp feeds;Detritus in sediment;Detritus in water
2.6 系统的总体特征
该养殖生态系统的系统总体特征如表5所示。系统TST为102 276.89 kJ·m-2·90 d-1,其中系统总摄食为37 353.36 kJ·m-2·90 d-1,占TST的36.55%;总呼吸消耗为19 037.33 kJ· m-2· 90 d-1,占TST的18.63%;总流向碎屑量为43 887.05 kJ·m-2·90 d-1,占TST的42.94%;总输出为1 944.48 kJ·m-2·90 d-1,占TST的1.45%。可见,碎屑总生成量为TST的最大组成部分。系统净生产力是一个负值,为7 301.48 kJ·m-2·90 d-1,这可能是由于系统中输入大量人工饵料的关系,表明系统总初级生产力小于系统总呼吸消耗。系统总能量流中来源于碎屑功能组能量所占比例为74.58%,来源于初级生产者能量所占比例为25.42%。系统信息总量为464 796.00 flowbits·m-2·90 d-1,其组成部分聚合度(Ascendancy, A)和冗余度(Overhead, O)大小分别为207 381.50、257 573.90 flowbits·m-2·90 d-1。相对聚合度(Ascendency/total development capacity, A/C)和相对冗余度(Overhead/total development capacity, O/C)分别为0.45和0.55。Finn’s循环指数(Finn’s cycling index, FCI)为21.24%,系统连接指数(Connectance index, CI)和系统杂食指数(System omnivory index, SOI)分别为0.28和0.06。表征模型可靠性的参数Pedigree 指数值为0.81。
Note:①Total system throughput; ②Sum of all consumption; ③Sum of all respiratory flows; ④Sum of all flows into detritus; ⑤Sum of all exports; ⑥Net system production; ⑦Total development capacity; ⑧Ascendency; ⑨Overhead; ⑩Total primary production/total respiration;Connectance index;System omnivory index;Finn’s cycling index;Ascendency/total development capacity;Overhead/total development capacity;Pedigree index;Proportion of total flow originating from detritus;Proportion of total flow originating from primary producers
3 讨论
Ecopath模型在进行功能组设定时,可以设定多个碎屑功能组[29]。在本实验中设定了包括水体碎屑、底泥碎屑、人工饵料蓝蛤和对虾饲料4个碎屑功能组。各初级生产者和消费者生物功能组以及蓝蛤和对虾饲料功能组中未被系统充分利用的生物量(1-EEi)最终以一定的比例流向水体碎屑和底泥碎屑功能组。由于在本实验结束时,水体碎屑生物量几乎没有发生变化。因而在本模型中设定,水体碎屑功能组中未被系统循环再利用进入系统食物网的生物量最终流向底泥碎屑功能组。而底泥碎屑功能组中未被相关食碎屑生物摄食而进入系统能量再循环的生物量则设定以底泥能量积累的形式存留在系统中。经模型运行结果显示底泥碎屑出现一定的生物量积累,该运行结果也与底泥能量增加量现场试验测定结果相符(未发表数据),进而说明了本设定的合理性。
该模型的置信度Pedigree指数为0.81,其值高于Morissette[56]统计的393个Ecopath模型中0.164~0.676的Pedigree指数值范围,说明该模型具有较高的可靠性。
3.1 养殖系统能量流动的结构特点
养殖系统能流结构的一个重要特征是系统大部分的能量流通量分布在第Ⅰ、Ⅱ营养级之间。系统中第Ⅰ、Ⅱ营养级之间的能量传输效率为78.28%,该值远高于自然生态系统10%的平均能量传输效率[54]。然而该系统从第Ⅱ到第Ⅲ营养级的能量传输效率迅速下降到10%以下,其值为8%。在放养有养殖生物的湖泊-千岛湖[57],也被发现有相似的营养结构。而本系统中78.28%的能量传输效率高于千岛湖生态系统中第Ⅰ、Ⅱ营养级之间50.98%的能量传输效率。
系统大部分消费者生物营养级处于第二营养级左右,缺乏更高营养级的相关捕食者,这是养殖生态系统能流结构的另一个重要特征。高营养级捕食者通过对相关被捕食者的摄食可以耦合来自系统不同能量来源的能流传递路径上的能量,是维持一个生态系统稳定性的重要因素[58]。在本系统中,更高营养级捕食者的缺乏使得系统的能流结构多呈现“线状”而非“网状”[59],这可能也是系统CI值较低的主要原因。另外,本系统因为缺乏高营养级的捕食者,大部分的低营养级消费者其食物来源只是单一的来自于碎屑或者初级生产者中的一种或两种食物[58],从而系统SOI值较低。
系统能量来源中大量人工饵料能量的输入是系统能流结构的又一个重要特征。在本系统代表能量流动的食物链中,源自初级生产者的能流量和源自碎屑功能组的能流通量占系统总能量流的比例分别为25.42%和74.58%。其中,碎屑功能组中的人工投喂饵料能量输入量占系统总能量来源的比例为22.31%。可以看到,由于大量人工饵料能量的输入,来源于初级生产者能量在系统总能量流中的比例变得很低。这大大降低了系统对来源于初级生产者能量的依赖[60]。在本系统中,人工饵料生物量贡献了24.84%的系统能量总消费量,其中,分别提供了三疣梭子蟹94.90%、凡纳滨对虾80.10%、大型浮游动物57.50%和大型底栖动物22.40%的能量消费量。正是由于人工饵料的投入,支撑了养殖系统中养殖生物三疣梭子蟹和凡纳滨对虾生物量的产出。
3.2 养殖生态系统结构稳定性的探讨与分析
据Ulanowicz[61],组织化程度越高的系统,A/C值越高。A/C值的代表着一个生态系统内部能量流动稳定性的高低。信息总量与聚合度之间的差值冗余度,反映了一个系统中能量流动的无组织、随机的一面,其代表着一个系统在受到外界干扰时保持系统稳定性的能力[62]。本系统中A/C值与O/C值的大小分别为0.45和0.55,二者均在0.50左右,说明系统在维持一定的内部能流稳定的同时也保持着较好的抵抗外界干扰的能力。然而两者相比较而言,系统抵抗外界干扰而保持稳定的能力强于系统保持内部能流稳定的能力。究其原因,一部分可能是系统具有较高的FCI值,FCI表示系统流向碎屑功能组能量再循环进入养殖系统的能流量与系统总能量流通量之间的比例[63]。据Vasconcellos[64],对碎屑生物量具有较高再循环利用能力的系统往往具有很强的抵抗外界干扰的能力。另外一个原因则可能是系统中具有生态互利作用的养殖生物的搭配养殖,使系统中人工饵料和初级生产者能量在向高一级营养级生物流动时有多条平行能流路径可供其通过,多条平行能流通道的存在也是提高系统冗余度的一个重要原因[61]。考虑到养殖生态系统经常需要面对外界环境变化或者疾病传播等因素带来的干扰,维持一个较高强度的抵抗外界干扰的能力有利于养殖活动的进行。因而,从虾蟹鱼三元搭配养殖生态系统本身结构稳定性的角度来看,该养殖系统是一个较为合理的生态系统,也在一定程度上说明系统在养殖生物搭配、投饲等管理环节上均具有较好的合理性。
3.3 养殖系统的进一步优化
从模型的分析结果显示,尽管系统具有较高的FCI值,然而系统底泥碎屑生物量依然表现出了一定的生物量沉积(23.10%)。微微型、微型浮游植物均有大量的生物能量未经系统利用而直接流向了碎屑功能组,这表明系统浮游植物生物量利用率有进一步提高的潜力。据MTI分析显示,浮游植物对梭鱼具有较强的正面作用,而梭鱼则对浮游植物具有较强的负面作用。提高梭鱼在养殖系统中的放养密度,不仅可以提高养殖系统对浮游植物的利用率,同时也可以提高梭鱼产出并降低底泥生物能积累。另外,滤食性生物可以有效滤食浮游植物[65],引入相关的滤食性生物进行搭配养殖,也可以起到提高系统浮游植物生物量的利用率、提高系统总产出并降低系统底泥碎屑沉积量的作用,进而避免过量的底泥碎屑沉积可能带来的对养殖环境的危害[66]。由此看来,在该虾蟹鱼三元养殖混养的基础上提高梭鱼的放养密度或者再搭配一定密度的滤食性生物如菲律宾蛤仔[67]的养殖可以使该养殖生态系统得到进一步的优化。
4 结语
该研究表明,利用Ecopath模型可以有效描述三疣梭子蟹混养池塘生态系统的能量流动和营养结构状况。建立的Ecopath模型输出的相关系统特征参数表明:该池塘养殖生态系统是一个食物链短,营养结构简单和主要依赖于碎屑能量流的生态系统;系统在维持内部能流的稳定性和抗外界干扰能力之间保持着较好的平衡;系统中初级生产者能量利用效率有待进一步提高,而提高梭鱼的放养密度或者引入相关滤食性生物进行搭配养殖,可以进一步提高该养殖系统的能量利用效率,进而使该养殖系统的结构和功能得到进一步优化。
[1] Li X, Li J, Wang Y, et al. Aquaculture industry in China: current state, challenges, and outlook[J]. Reviews in Fisheries Science, 2011, 19: 187-200.
[2] FAO. Aquaculture development. 4. Ecosystem approach to aquaculture[R]. Rome: FAO Technical Guidelines for Responsible Fisheries, 2010: 53.
[3] 董双林. 系统功能视角下的水产养殖业可持续发展[J]. 中国水产科学, 2009, 16(5): 98-805. Dong S L. On sustainable development of aquaculture: A functional perspective[J]. Journal of Fishery Sciences of China, 2009, 16(5): 98-805.
[4] 董佳. 三疣梭子蟹(Portunustrituberculatus)池塘混养系统结构优化和氮磷收支的实验研究[D]. 青岛: 中国海洋大学, 2013. Dong J. Studies on the Optimization and Nitrogen and Phosphorus Budgets of Polyculture System ofPortunustrituberculatusPonds [D]. Qingdao: Ocean University of China, 2013.
[5] 班文波, 田相利, 董双林, 等. 三疣梭子蟹、凡纳滨对虾、菲律宾蛤仔和江蓠混养结构优化的实验研究[J]. 河北渔业, 2015(8): 12-18. Ban W B, Tian X L, Dong S L, et al. An experimental study on structure optimization for polyculture ofPortunustrituberculatus,Litopenaeusvannamei,Ruditapesphilippinarum, andGracilarialichevoides[J]. Hebei Fisheries, 2015(8): 12-18.
[6] 周演根, 马甡, 苏跃朋, 等. 三疣梭子蟹与凡纳滨对虾混养实验研究[J]. 中国海洋大学学报(自然科学版), 2010, 40(3): 11-16. Zhou Y G, Ma S, Su Y P, et al. Studies on the effects of polyculture ofLitopenaeusvannameiwithPortunustrituberculatus[J]. Periodical of Ocean University of China, 2010, 40(3): 11-16.
[7] 奉杰, 田相利, 董双林, 等. 不同三疣梭子蟹混养系统能量收支的研究[J]. 中国海洋大学学报(自然科学版), 2015, 45(3): 39-47. Feng, J, Tian, X L, Dong, S L, et al. Studies on the energy budget of different polyculture systems of swimming crab[J]. Periodical of Ocean University of China, 2015, 45(3): 9-47.
[8] 奉杰. 不同三疣梭子蟹混养系统能量收支和有机碳收支的实验研究[D]. 青岛: 中国海洋大学, 2014. Feng J. Studies on the Energy Budgets and Organic Carbon Budgets of Polyculture System ofPortunustrituberculatusPonds [D]. Qingdao: Ocean University of China, 2014.
[9] Zhang K, Tian X L, Dong S L, et al. An experimental study on the budget of organic carbon in polyculture ecosystems of swimming crab with white shrimp and short-necked clam[J]. Aquaculture, 2016. 451, 58-64.
[10] 班文波, 田相利, 董双林, 等. 四种三疣梭子蟹养殖系统的能值评价[J]. 中国海洋大学学报(自然科学版), 2016, 46(3): 31-40. Ban W B, Tian X L, Dong S L, et al. Emergy evaluation of fourPortunustrituberculatusaquaculture systems[J]. Periodical of Ocean University of China, 2016, 46(3): 31-40.
[11] 董佳, 田相利, 董双林, 等. 三疣梭子蟹和凡纳滨对虾混养系统的氮磷收支的研究[J]. 中国海洋大学学报(自然科学版), 2013, 43(12): 16-24. Dong J, Tian X L, Dong S L, et al. Study on nitrogen and phosphorus budget in polyculture system ofLitopenaeusvannameiwithPortunustrituberculatus[J]. Periodical of Ocean University of China, 2013, 43(12): 16-24.
[12] 张凯, 田相利, 董双林, 等. 三疣梭子蟹、凡纳滨对虾和菲律宾蛤仔混养系统氮磷收支的研究[J]. 中国海洋大学学报(自然科学版), 2015, 45(2): 44-53. Zhang K, Tian X L, Dong S L, et al. Nitrogen and phosphorus budgets of polyculture system ofPortunustrituberculatus,LitopenaeusvannameiandRuditapesphilippinarum[J]. Periodical of Ocean University of China, 2015, 45(2): 44-53.
[13] 班文波. 三疣梭子蟹不同池塘混养系统的结构优化、氮磷收支和能值分析[D]. 青岛: 中国海洋大学, 2016. Ban W B. Optimization, Nitrogen and Phosphorus Budgets and Emergy Analysis of DifferentPortunustrituberculatusPolyculture Systems [D]. Qingdao: Ocean University of China, 2016.
[14] 张凯. 三疣梭子蟹(Portunustrituberculatus)混养系统有机碳收支以及细菌生产力与代谢功能的研究[D]. 青岛: 中国海洋大学, 2014. Zhang K. Study on Total Organic Carbon Budgets and Bacterial Productivity and Metabolism of Polyculture System ofPortunustrituberculatus,LitopenaeusvannameiandRuditapesphilippinarum[D]. Qingdao: Ocean University of China, 2014.
[15] 傅彩萍, 郑忠明, 金忠文, 等. “底充式增氧”技术对梭子蟹养殖池塘水质环境及浮游植物群落结构的影响[J]. 海洋学研究, 2012, 30: 74-81. Fu C P, Zheng Z M, Jin Z W, et al. Effects of “submerged aeration system” on water quality and phytoplankton community structure inPortunustrituberculatusculture ponds[J]. Journal of Marine Sciences, 2012, 30: 74-81.
[16] 金中文, 郑忠明, 傅彩萍, 等. 梭子蟹养殖池塘浮游生物群落结构的初步分析[C]. 厦门: 2011年中国水产学会学术年会, 2011. Jin Z W, Zheng Z M, Fu C P, et al. Analysis of the plankton community structure of thePortunustrituberculatusfarming ponds [C]. Xiamen: 2011 Annual Academic Conference of China Society of Fisheries, 2011.
[17] 毛欣欣, 蒋霞敏, 王春琳, 等. 三疣梭子蟹两种养殖模式浮游动物调查[J]. 生物学杂志, 2014, 31(4): 38-41. Mao X X, Jiang X M, Wang C L, et al. Investigation of zooplankton in two polyculture modes as dominant stocking species of the swimming crabPortunustrituberculatus[J]. Journal of Biology, 2014, 31(4): 38-41.
[18] 张恒庆, 初航, 温丹, 等. 三疣梭子蟹养殖池塘水体中异养细菌菌群特征的研究[J]. 辽宁师范大学学报(自然科学版), 2008, 31: 221-224. Zhang H Q, Chu H, Wen D, et al. Investigation of morphological diversity of heterotrophic bacteria from water column ofPortunustrituperculatusrearing pond[J]. Journal of Liaoning Normal University(Natural Science Edition), 2008, 31: 221-224.
[19] 孙苏燕. 培养与免培养结合研究三疣梭子蟹养殖池塘细菌多样性[D]. 宁波: 宁波大学, 2011. Sun S Y. Investigation on Bacterial Diversity inPortunustrituberculatusRearing Pond by Cultivation-Dependent and Independent Approaches [D]. Ningbo: Ningbo University, 2011.
[20] Zhang K, Tian X L, Dong S L, et al. Variation of functional diversity of microbial communities in water of polyculture ofPortunustrituberculatus,LitopenaeusvannameiandRuditapesphilippinarum[J]. The Israeli Journal of Aquaculture Bamidgeh, 2015, 67.
[21] Colléter M, Valls A, Guitton J, et al. Global overview of the applications of the Ecopath with Ecosim modeling approach using the EcoBase models repository[J]. Ecological Modelling, 2015, 302: 42-53.
[22] Polovina J J. Model of a coral reef ecosystems I. The ECOPATH model and its application to French Frigate Shoals[J]. Coral Reefs, 1984a, 3(1): 1-11.
[23] Polovina J J. An overview of the ECOPATH model[J]. Fishbyte, 1984b, 2(2): 5-7.
[24] Ulanowicz R E. Growth and Development: Ecosystem Phenomenology [M]. New York: Springer Verlag, 1986: 203.
[25] 仝龄. Ecopath—一种生态系统能量平衡评估模式[J]. 海洋水产研究, 1999, 20(2): 102-107. Tong L. Ecopath model—a mass-balance modeling for ecosystem estimation[J]. Marine Fisheries Research, 1999, 20(2): 102-107.
[26] 李德尚, 杨红生, 王吉桥, 等. 一种池塘陆基实验围隔[J]. 青岛海洋大学学报, 1998, 28(2): 199-204. Li D S, Yang H S, Wang J Q, et al. A device of land-based experimental enclosure used in ponds[J]. Journal of Ocean University of Qingdao, 1998, 28(2): 199-204.
[27] Christensen V, Pauly D. A guide to the Ecopath II Software Systems(version 2. 1), ICLARM Software 6 [R]. Manila: International Center for Living Aquatic Resources Management (ICLARM), 1992: 72.
[28] Christensen V, Pauly D. Ecopath II: a software for balancing steady-state ecosystem models and calculating network characteristics[J]. Ecological Modelling, 1992b, 61(3-4): 169-186.
[29] Christensen V, Walters C J, Pauly D. Ecopath with Ecosim: A User’s Guide (Version 5. 1) [R]. Canada: Fisheries Centre, University of British Columbia, Vancouver, 2005: 154.
[30] 王骥. 浮游植物的初级生产力与黑白瓶测氧法[J]. 淡水渔业, 1980, 3: 24-28. Wang J. Primary productivity of phytoplankton and measurement of oxygen in black and white bottles[J]. Freshwater Fisheries, 1980, 3: 24-28.
[31] 刘国才, 李德尚, 董双林, 等. 对虾养殖围隔生态系中的细菌碳代谢[J]. 水产学报, 1999, 23(4): 357-362. Liu G C, Li D S, Dong S L, et al. Metabolism of bacterial carbon in shrimp cultural enclosure ecosystems[J]. Journal of Fisheries of China, 1999, 23(4): 357-362.
[32] Moriarty D J. Bacterial productivity in ponds used for culture of Penaeid Prawns[J]. Microbial Ecology, 1986, 12(3): 259-269.
[33] Richman S, Dodson S I. The effect of food quality on feeding and respiration by daphnia and diaptomus[J]. Limnology and Oceanography, 1983, 28(5): 948-956.
[34] Straile D. Gross growth efficiencies of protozoan and metazoan zooplankton and their dependence on food concentration, predator-prey weight ratio and taxonomic group[J]. Limnology and Oceanography, 1997, 42: 1375-1385.
[35] Winberg G G. Some Interim Results of Soviet IBP Investigations on Lakes [M]. IBP-UNESCO symposium on productivity problems of freshwaters, Kazimierz, Poland, Polish Scientific Publisher, 1972: 363-381.
[36] 林群. 黄渤海典型水域生态系统能量传递与功能研究[D]. 青岛: 中国海洋大学, 2012. Lin Q. Studies on the Ecosystem Energy Transfer and Function in the Typical Waters of Yellow and Bohai Sea [D]. Qingdao: Ocean University of China, 2012.
[37] 齐明, 申玉春, 朱春华, 等. 凡纳滨对虾不同阶段摄食人工饲料生长效率的初步研究[J]. 渔业现代化, 2010, 37(2): 34-37. Qi M, Shen Y H, Zhu C H, et al. A primary study on conversion efficiency ofLitopenaeusvannameifeed on artificial diets[J]. Fishery Modernization, 2010, 37(2): 34-37.
[38] 杨辉, 马甡, 苏跃朋. 投喂新鲜、冷冻、烘干菲律宾蛤肉对三疣梭子蟹摄食、代谢及生长的影响[J]. 中国海洋大学学报(自然科学版), 2010, 40: 65-70. Yang H, Ma S, Su Y P. Differences of food consumption, metabolism and growth of the crab (Portunustrituberculatus) fed fresh, frozen and oven-dried clam (Ruditapesphilippinarum) meat[J]. Periodical of Ocean University of China, 2010, 40: 65-70.
[39] 李德尚, 卢敬让, 徐宁, 等. 一种适于现场测定的池塘底泥呼吸器[J]. 青岛海洋大学学报, 1998, 28(2): 205-209. Li D S, Lu J R, Xu N, et al. A device of in situ sediment-respiration-determing apparatus used in pond[J]. Journal of Ocean University of Qindao, 1998, 28(2): 205-209.
[40] 张天文. 对虾高位池精养模式和生态养殖模式中碳流通特征的解析一Ecopath with Ecosim在养殖生态系统中应用的初步研究[D]. 青岛: 中国海洋大学, 2011. Zhang T W. The model of Carbon flux in intensive Penaeid shrimp culture and ecological cultivation [D]. Qingdao: Ocean University of China, 2011.
[41] Hagrave B T. Aerobic decomposition of sediment and detritus as a function of particle surface area and organic content[J]. Limnology and Oceanography, 1972, 17(4): 583-586.
[42] 李军, 杨纪明. 梭鱼幼鱼的生态生长效率研究[J]. 海洋科学, 1995, 42(1): 68-69. Li J, Yang J M. Experiments on energy flow of a simple food chain[J]. Marine Sciences, 1995, 42(1): 68-69.
[43] 李明德. 中国梭鱼42年来的研究概况[J]. 海洋通报, 1993(6): 81-86. Li M D. Researches on Chinese MulletLizahaematocheiladuring past forty-two years [J]. Mering Science Bulletin, 1993(6): 81-86.
[44] 刘国才, 李德尚. 对虾池悬浮颗粒附着细菌的研究[J]. 海洋学报, 1999, 21(1): 97-102. Liu G C, Li D S. A study on bacteria attached to suspended particles in shrimp ponds[J]. Acta Oceanologica Sinica, 1999, 21(1): 97-102.
[45] 王诗红, 张志南. 日本刺沙蚕摄食沉积物的实验研究[J]. 青岛海洋大学学报, 1998, 28(4): 587-592. Wang S H, Zhang Z N. Study ofNeanthesjaponicafeeding on natural sediment[J]. Journal of Ocean University of Qindao, 1998, 28(4): 587-592.
[46] Tsuchiya M, Kurihara Y. The feeding habits and food sources of the deposit-feeding polychaete, Neanthes japonica, (Izuka) [J]. Journal of Experimental Marine Biology & Ecology, 1979, 36(1): 79-89.
[47] Bayle-Sempere J T, Arreguín-Sánchez F, Sanchez-Jerez P, et al. Trophic structure and energy fluxes around a Mediterranean fish farm [J]. Ecological Modelling, 2013, 248(1751): 135-147.
[48] Vassallo P, Fabiano M, Vezzulli L, et al. Assessing the health of coastal marine ecosystems: A holistic approach based on sediment micro and meio-benthic measures[J]. Ecological Indicators, 2006, 6(3): 525-542.
[49] 李纯厚, 林婉莲. 武汉东湖浮游动物对浮游细菌牧食力研究[J]. 生态学报, 1995, 15(2): 142-147. Li C H, Lin W L. Grazing rate of zooplankton on bacterioplankton in Donghu Wuhan[J]. Ecol Sinica, 1995, 15(2): 142-147.
[50] 周波. 基于EwE模型的草鱼综合养殖池塘生态系统研究[D]. 青岛: 中国海洋大学, 2015. Zhou B. Research on Grass carp (Ctenopharyngodonidella) integrated aquaculture pond ecosystem: Based on EwE model [D]. Qingdao: Ocean University of China, 2015.
[51] Bradford-Grieve J M, Probert P K, Nodder S D, et al. Pilot trophic model for subantarctic water over the Southern Plateau, New Zealand: a low biomass, high transfer efficiency system [J]. Journal of Experimental Marine Biology & Ecology, 2003, 289(2): 223-262.
[52] Winberg G G. Rate of metabolism and food requirements of fishes [J]. Fish Res Bd Can Trans Ser, 1956(2): 475.
[53] 李由明, 黄翔鹄, 王平, 等. 利用碳稳定同位素技术对凡纳滨对虾食性变化的分析[J]. 广东农业科学, 2013, 40(20): 125-128. Li Y M, Huang H X, Wang P, et al. Analysis on diet ofLitopenaeusvannameiusing tracer technology of carbon stable isotope[J]. Guangdong Agricultural Sciences, 2013, 40(20): 125-128.
[54] Lindeman R L. The trophic-dynamic aspect of ecology[J]. Ecology, 1942, 23: 399-418.
[55] Ulanowicz R E. Ecosystem Trophic Foundations: Lindeman Exonerata [M]//Complex Ecology: The Part-Whole Relation in Ecosystems. Englewood Cliffs: Prentice Hall, 1995.
[56] Morissette L. Complexity, Cost and Quality of Ecosystem Models and Their Impact on Resilience: A Comparative Analysis, with Emphasis on Marine Mammals and the Gulf of St [D]. Lawrence. Vancouver: University of British Columbia, 2007: 260.
[57] Liu Q G, Chen Y, Li J L, et al. The food web structure and ecosystem properties of a filter-feeding carps dominated deep reservoir ecosystem[J]. Ecological Modelling, 2007, 203: 279-289.
[58] Rooney N, McCann K, Gellner G, et al. Structural asymmetry and the stability of diverse food webs[J]. Nature, 2006, 442: 265-269.
[59] Hossain M M, Matsuishi T, Arhonditsis G. Elucidation of ecosystem attributes of an oligotrophic lake in Hokkaido, Japan, using Ecopath with Ecosim (EwE)[J]. Ecological Modelling, 2010, 221: 1717-1730.
[60] Lassalle G, Lobry J, Le L F, et al. Ecosystem status and functioning: searching for rules of thumb using an intersite comparison of food-web models of Northeast Atlantic continental shelves[J]. ICES Journal of Marine Science, 2012, 70: 135-149.
[61] Ulanowicz R E. Quantitative methods for ecological network analysis[J]. Computational Biology and Chemistry, 2004, 28: 312-339.
[62] Ulanowicz R E. Growth and Development: Ecosystem Phenomenology [M]. New York: Springer Verlag, 1986: 203.
[63] Finn J T. Measures of ecosystem structure and function derived from analysis of flows[J]. Journal of Theoretical Biology, 1976, 56: 363-380.
[64] Vasconcellos M, Mackinson S, Sloman K, et al. The stability of trophic mass-balance models of marine ecosystems: a comparative analysis[J]. Ecological Modelling, 1997, 100(1): 125-134.
[65] Chopin T. Aquaculture, Aquaculture, Integrated Multi-Trophic (IMTA), Aquaculture, Integrated Multi-Trophic (IMTA) [M]. New York: Sustainable Food Production Springer, 2013: 184-205.
[66] 叶振国. 浅谈底泥对池塘养殖影响[J]. 水产养殖, 2010, 31(3): 31-32. Ye Z G. Effects of sediment on pond aquaculture[J]. Journal of Aquaculture, 2010, 31(3): 31-32.
[67] Sorokin Y I, Giovanaradi O. Trophic characteristics of the Manila clam (Tapesphilippinarumadams and Reeve)[J]. Ices Journal of Marine Science, 1995, 52: 853-862.
