二氧化钛纳米颗粒对序批式反应器中活性污泥胞外聚合物产量及其组分的影响❋
2018-02-28王雪礁李姗姗李志伟徐巧燕董俊伟万一平高孟春
王雪礁, 王 森, 李姗姗,, 李志伟, 徐巧燕, 郑 栋, 董俊伟, 万一平, 高孟春❋❋
(1. 中国海洋大学海洋环境与生态教育部重点实验室,山东 青岛 266100; 2. 青岛大学环境科学与工程学院,山东 青岛 266071;3. 中国海洋大学环境科学与工程学院,山东 青岛266100)
TiO2纳米颗粒(TiO2Nanoparticles,简称TiO2NPs)因其具有独特的结构以及优良的力学、电学和化学性能,被广泛地应用于化学工业、电子工业、生物医疗等领域[1-2]。TiO2NPs的广泛应用不可避免地会在生产、运输和使用过程中释放到环境中去,从而大大地增加了人、动物和植物与TiO2NPs的接触机会,其潜在的环境效应和生态风险已经引起了人们的广泛关注。大量关于TiO2NPs毒理学的研究结果表明[3-9],TiO2NPs具有纳米尺度,能穿过细胞壁和细胞膜进入生命体的任何部位,引发细胞炎症和生物肺部肿瘤,对人体器官、微生物和动物等产生明显的毒性效应。进入环境中的TiO2NPs可通过在土壤、水和空气等环境介质中迁移而进入水环境,最终出现在废水生物处理系统。
鉴于TiO2NPs具有较强的生物毒性,可能通过抑制微生物活性而改变废水生物处理系统中活性污泥(或生物膜)的生化特性,引起微生物群落结构变化,从而影响活性污泥(或生物膜)对废水中有机物、氮和磷等污染物的去除效果。Zheng等[10]发现,在长期暴露条件下50 mg/L TiO2NPs抑制了序批式生物反应器(Sequencing Batch Reactor,简称SBR)的生物脱氮性能并导致SBR中微生物群落结构发生了变化。Yang等[11]报道,在长期暴露条件下,0.5~2.0 mg/L TiO2NPs 能明显地影响厌氧-好氧-SBR中活性污泥絮体的物理化学稳定性。Li等[12]发现,短期暴露条件下 2~50 mg/L TiO2NPs 对SBR的脱氮性能没有影响, 然而当TiO2NPs浓度从100 mg/L增加到200 mg/L时,总氮去除效率从36.5%降低到 20.3%。众所周知,在活性污泥法处理废水过程中,微生物分泌胞外聚合物(Extracellular Polymeric Substances, 简称EPS)能够影响生物反应器内微生物聚集体的特性、活性污泥的絮凝、沉降和脱水性[13-15]。EPS主要由蛋白质(Protein,简称PN)、糖类(Polysaccharide,简称PS)、核酸、脂类、腐殖酸以及一些无机组分组成,其中,PN和PS是EPS的主要组成部分,约占EPS总量的70%~80%[16]。已有文献报道,废水中有毒物质的存在能够影响微生物分泌的EPS产量和组分[17-19],从而抵御有毒物质对微生物的毒害作用。TiO2NPs作为一种潜在生物毒性的物质在活性污泥法处理废水过程中可能影响微生物分泌的EPS产量和组分,从而可能改变活性污泥的絮凝、沉降和脱水性,进一步影响活性污泥的性能。因此,评价TiO2NPs浓度变化对活性污泥胞外聚合物产量及其组分的影响是非常有意义的工作。然而,目前尚未发现有关TiO2NPs对SBR的活性污泥中胞外聚合物特性影响的相关研究。本文研究了长期暴露条件下TiO2NPs浓度变化对SBR的活性污泥中紧密附着EPS(TB-EPS)和松散附着EPS(TB-EPS)中PN和PS含量的影响,通过三维荧光光谱(3D-EEM)和傅里叶红外光谱(FTIR)分析LB-EPS和TB-EPS化学组成的变化。
1 材料与方法
1.1 实验装置及运行条件
本试验采用SBR反应器是由有机玻璃管制成,有效高度和内径分别为50和14 cm,有效容积7.7 L,容积交换率为50%。进水通过蠕动泵进入SBR,通过电磁阀控制排水。空气压缩机通过砂芯曝气头从反应器底部通入空气,缺氧阶段通过磁力搅拌器使进水与活性污泥混合。在好氧阶段结束前,排出一定量的污泥,保证系统的除磷效果,使污泥龄保持在20 d左右。反应器运行参数如下:缺氧阶段2.5 h,好氧阶段4 h,搅拌阶段1 h,沉淀阶段0.3 h,排水阶段0.2 h。进水、曝气、搅拌、沉淀和排水通过时间继电器实现自动控制。SBR每个周期为8 h,1 d运行3个周期。在SBR运行过程中,缺氧阶段的DO低于0.5 mg/L,好氧阶段的DO高于2 mg/L。本研究是在夏季有空调和冬季有暖气的情况下进行,室内温度25℃左右。
1.2 接种污泥和进水水质
1.3 TiO2 NPs储备液配制
本论文所用TiO2NPs购于北京德科岛金科技有限公司,粒径35 nm,纯度99.9%,白色疏松粉末。根据Keller 等[20]报道的纳米颗粒配制储备液的方法如下:称取0.5 g TiO2NPs,干燥灭菌后在超净台中冷却,然后加入1 L经0.22 μm滤膜灭菌的Milli-Q水(pH=7.0),用磁力搅拌器混合搅拌30 min后,再在25 ℃,250 W,40 kHz条件下超声1 h,随后在25 ℃,150 r/min的条件下放置1夜。储备液在稀释到模拟废水前,为了打碎TiO2NPs聚集体,应在25 ℃,250 W,40 kHz条件下再超声1 h。
1.4 分析方法
1.5 胞外聚合物提取和分析方法
1.5.1 胞外聚合物提取和测定 依据Li和Yang[22]的方法适当修改后提取LB-EPS和TB-EPS,具体步骤如下:在SBR搅拌阶段每次取活性污泥样品40 mL,将其在6 000 r/min下离心5 min,弃去上清液,得到浓缩的活性污泥样品;用预热到70 ℃的NaCl溶液(盐度为3%)稀释至40 mL,盖紧盖子并快速振荡1 min;将提取后的混合液于6 000 r/min离心10 min;收集上清液,即为LB-EPS。用盐度为3%NaCl溶液稀释至40 mL,60 ℃水浴30 min后6 000 r/min离心15 min,收集上清液,即为TB-EPS。每次做三次平行样。上清液经过0.45 μm醋酸纤维素膜过滤后分析LB-EPS和TB-EPS中PN和PS含量。PN含量采用Folin酚法测定[17],PS含量采用蒽酮比色法测定[18]。
1.5.2 三维荧光光谱分析 LB-EPS和TB-EPS三维荧光光谱(3D-EEM)采用荧光分光光度计(F-4600,Hitachi,日本)测定。激发波长(Ex)范围200~400 nm,扫描间隔5 nm;发射波长(Em)范围200~500 nm,扫描间隔5 nm;激发光和发射光的狭缝均为10 nm,扫描速度为1 200 nm/min。采用Origin 8.1软件绘制光谱图。
1.5.3 傅里叶变换红外光谱分析 LB-EPS和TB-EPS红外光谱(FTIR)采用傅里叶变换红外光谱仪(Tensor 27,Bruker Optics,德国)测定。LB-EPS和TB-EPS提取液经过冷冻干燥处理后与光谱纯KBr按照1:100研磨混合,并于一定压力下保持若干分钟制成半透明薄片,在400~4 000 cm-1波数范围内扫描,检测器分辨率为4 cm-1。
2. 结果与讨论
2.1 TiO2 NPs浓度变化对SBR性能的影响
表1为在长期暴露条件下TiO2NPs浓度变化对SBR性能影响情况。


表1 长期暴露条件下TiO2 NPs浓度变化对SBR性能的影响
Note:①Influent TiO2NPs concentration;②Operational time;③Influent concentration;④Effluent concentration;⑤Removal efficiency
2.2 TiO2 NPs浓度变化对活性污泥中LB-EPS和TB-EPS的PN和PS含量影响
在进水TiO2NPs浓度分别为0、5、10、30和60 mg/L时,考察了活性污泥中LB-EPS和TB-EPS产量及其主要组分的变化。由图1可知,LB-EPS和TB-EPS产量随着进水TiO2NPs浓度的增加而逐渐地增加。进水TiO2NPs浓度的增大导致其对SBR中微生物的毒性增强,活性污泥中微生物就通过分泌更多的EPS聚集在细胞表面或细胞外抵御TiO2的毒性。图2表示TiO2NPs浓度变化对活性污泥中LB-EPS和TB-EPS中PN和PS含量的影响。当进水TiO2NPs浓度从0 mg/L逐渐地增加到60 mg/L时,LB-EPS和TB-EPS中PN含量分别从4.03 和18.53 mg/(g MLVSS)增加到了33.73和87.16 mg/(g MLVSS)。与进水TiO2NPs浓度为0 mg/L相比,PN含量在进水TiO2NPs浓度为60 mg/L时分别增加了7.37和3.70倍,表明TiO2NPs的出现使LB-EPS中PN增加速率明显地高于TB-EPS中PN增加量。活性污泥中LB-EPS的PS含量从0 mg/L TiO2NPs时的1.06 mg/(g MLVSS)逐渐增加到10 mg/L TiO2NPs时的6.68 mg/(g MLVSS),在10和60 mg/L TiO2NPs时又分别降低为4.28和1.80 mg/(g MLVSS)。杨晓南[23]报道了TiO2NPs在废水生物处理系统的长期暴露使微生物表面由于吸附、卷扫及静电力等作用使其在表面吸附了TiO2NPs,使微生物细胞膜表面被大量的TiO2NPs所覆盖,阻碍了营养物质的运输,导致活性污泥微生物细菌活性降低,胞外聚合物中多糖含量减少。

图1 不同TiO2 NPs浓度对活性污泥中LB-EPS和TB-EPS含量的影响Fig.1 Effect of different TiO2 NPs concentrations on the LB-EPS and TB-EPS contents of activated sludge
然而,活性污泥中TB-EPS的PS含量随着进水中TiO2NPs浓度增加而逐渐增加,这说明TiO2NPs的出现对LB-EPS和TB-EPS中PS含量的影响是不同的。在整个实验过程中LB-EPS和TB-EPS中的PN含量始终高于PS 含量。EPS中的蛋白质PN能够通过扩散限制或/以及化学反应,减缓或阻止有害物质进入微生物,是保护细胞免受损伤的主要成分,这说明EPS中高PN含量有利于使活性污泥中微生物的细胞免受TiO2NPs的损伤。
2.3 TiO2 NPs浓度变化对活性污泥中LB-EPS和TB-EPS主要化学组分的影响
为了评价TiO2NPs浓度变化对SBR中活性污泥的LB-EPS和TB-EPS化学组成的影响,考察了进水浓度TiO2NPs为0、5、10和60 mg/L时LB-EPS和TB-EPS的3D-EEM光谱图(见图3)。在EPS的3D-EEM光谱中X轴和Y轴分别代表着发射光谱,等高线代表荧光强度。每一个荧光峰代表着某一类化学物质,其位置以Em/Ex来表示。由图3可知,在所取的4个污泥样品中LB-EPS和TB-EPS共发现了5个特征荧光峰,其位置如下:
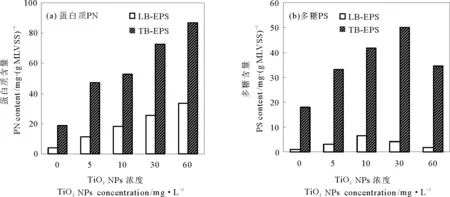
图2 不同TiO2 NPs浓度对LB-EPS和TB-EPS中蛋白质和多糖含量的影响Fig. 2 Effect of different TiO2 NPs concentrations on the PN and PS contents of LB-EPS and TB-EPS
关于荧光峰A(220-225/340-345 nm)、荧光峰B(275-280/335-345 nm)、荧光峰C(220-225/310-320 nm)、荧光峰D(355-375/445-460 nm)和荧光峰E(270-275/445-460 nm),根据以往文献报道[24-26],荧光峰A、荧光峰B和荧光峰C分别与芳环蛋白类物质、色氨酸蛋白类物质以及简单芳环蛋白类物质有关;荧光峰D和荧光峰E分别与胡敏酸类物质和富里酸类物质有关。在进水TiO2NPs为0 mg/L时,LB-EPS的3D-EEM荧光光谱中出现了荧光峰A和荧光峰B,TB-EPS的3D-EEM荧光光谱中出现了荧光峰A、荧光峰B和荧光峰C。与0 mg/L TiO2NPs时相比,在TiO2NPs浓度为5、10和60 mg/L时LB-EPS的3D-EEM荧光光谱中分别增加了荧光峰D、荧光峰E和荧光峰E。TB-EPS的3D-EEM荧光光谱在TiO2NPs浓度为5和60 mg/L时分别增加了荧光峰D、荧光峰D和荧光峰E,但是未发现荧光峰C。荧光峰D和荧光峰E随着进水TiO2NPs浓度增加而逐渐在LB-EPS和TB-EPS中出现,说明在TiO2NPs刺激下EPS中产生了胡敏酸类物质和富里酸类物质。
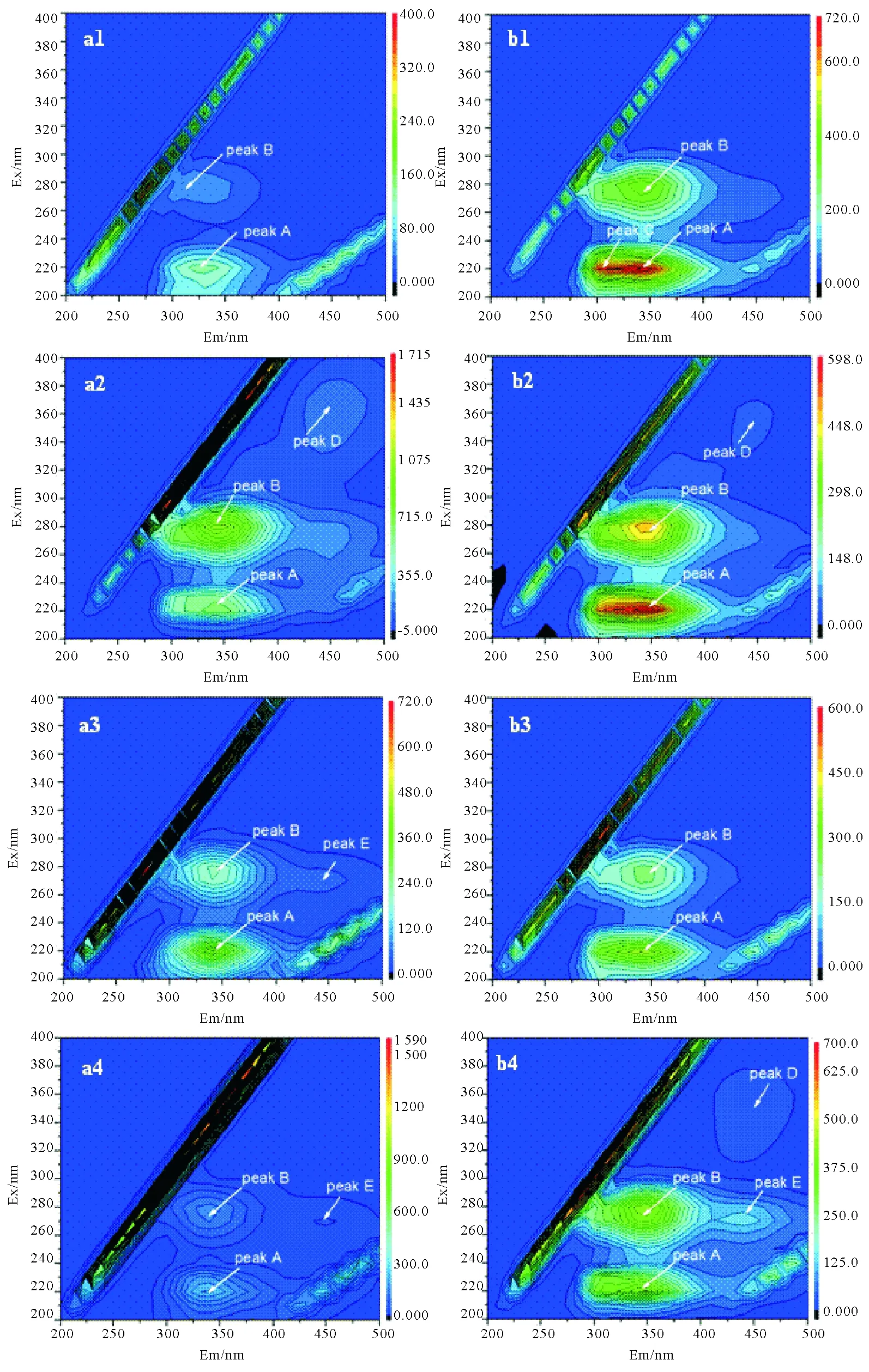
((a1)LB-EPS(0 mg/L);(b1)TB-EPS(0 mg/L);(a2)LB-EPS(5 mg/L);(b2)TB-EPS(5 mg/L);
表2表示进水中TiO2NPs浓度变化对活性污泥中LB-EPS和TB-EPS的3D-EEM光谱中荧光峰位置(Ex/Em)和荧光强度的影响。荧光峰位置沿着EX轴(或Em)方向刻度增加称为红移现象,反之称为蓝移现象。与进水中TiO2NPs浓度为0 mg/L时荧光峰A位置相比,LB-EPS中荧光峰A在TiO2NPs浓度为5 mg/L时沿着Ex/Em轴红移了5 nm/15 nm,在TiO2NPs浓度为10和60 mg/L时分别沿着Em轴红移了15和10 nm;TB-EPS中荧光峰A在TiO2NPs浓度为5 mg/L时未发生红移或蓝移,在TiO2NPs浓度为10 mg/L时沿着Em轴红移了5 nm,而在TiO2NPs浓度为60 mg/L时沿着Ex/Em轴红移了5 nm/5 nm。与进水中TiO2NPs浓度为0 mg/L时荧光峰B位置相比,TB-EPS中荧光峰B在TiO2NPs浓度为5 mg/L时沿着Ex/Em轴红移了5 nm/40 nm,在TiO2NPs浓度为10和60 mg/L时分别沿着Em轴红移了35和30 nm;TB-EPS中荧光峰B在TiO2NPs浓度为5、10和60 mg/L时分别沿着Em轴红移了5、5和5 nm。在TiO2NPs浓度为60 mg/L时TB-EPS中荧光峰C相对于TiO2NPs浓度为5 mg/L时TB-EPS中荧光峰D沿着Em轴蓝移了5 nm,而与进水中TiO2NPs浓度 10 mg/L时LB-EPS中荧光峰E相比TiO2NPs浓度 60 mg/L时LB-EPS中荧光峰E位置沿着Ex轴红移了5 nm。根据以往文献报道[25],荧光峰的红移与荧光基团中羰基、羧基、羟基和氨基的增加密切相关的。本研究中荧光峰的红移可能是由于进水中TiO2NPs出现使高激发波长类色氨酸中的羰基、羧基等官能团的含量增多,导致荧光峰的红移。荧光峰的蓝移与其所含苯环数量的降低相关的,这可能是进水中TiO2NPs出现导致荧光峰A所代表的芳环蛋白类物质中苯环数量降低。不同荧光峰的红移由表2可知,荧光峰A、荧光峰B、荧光峰C、荧光峰D和荧光峰E的荧光强度在不同的进水TiO2NPs浓度或增大或减少,这进一步说明了进水中TiO2NPs的出现能够影响LB-EPS和TB-EPS的化学组成。

表2 活性污泥的LB-EPS和TB-EPS中荧光峰特征
2.4 TiO2 NPs浓度变化对活性污泥中LB-EPS和TB-EPS官能团的影响
为了评价TiO2NPs对活性污泥中LB-EPS和TB-EPS的官能团影响,本研究考察了进水浓度TiO2NPs为0、5、10和30 mg/L时LB-EPS和TB-EPS的FTIR光谱图变化情况(见图4)。3 400 cm-1附近的宽吸收峰与多糖化合物中的羟基和蛋白质类物质中的氨基的伸缩振动相关[27],3 006 cm-1附近的吸收峰是C-H拉伸造成的[28],1 639 cm-1附近的吸收峰是由蛋白质二级结构中β-折叠的C=O伸缩振动导致[29],1 400 cm-1附近吸收峰是甲基中C-H键振动产生的[30],1 116 cm-1附近吸收峰是多糖类化合物和芳香族化合物中C-O键的伸缩振动导致[31],615 cm-1附近属于指纹区,表明样品中存在着不饱和键。由图4可知,在活性污泥中LB-EPS和TB-EPS的FTIR光谱中3 400、1 640、1 400和1 110 cm-1附近有明显的吸收峰存在,表明了LB-EPS和TB-EPS中存在着蛋白质类化合物和多糖类化合物。在不同进水TiO2NPs浓度变化时,LB-EPS和TB-EPS的FTIR光谱是类似的,但是每个峰的相对强度却发生了相应的变化。与0 mg/L TiO2NPs相比,LB-EPS中3 400 cm-1附近峰相对强度在5 mg/L TiO2NPs时明显地增加,随后随着进水TiO2NPs浓度增加而有所降低,然而TB-EPS中3 400 cm-1附近峰相对强度随着TiO2NPs浓度增加未呈现明显的变化。LB-EPS和TB-EPS中1 640和1 110 cm-1附近吸收峰在5 mg/L TiO2NPs时明显地增加,随后随着进水TiO2NPs浓度增加而有所降低。LB-EPS和TB-EPS中1 640和1 110 cm-1附近吸收峰在5 mg/L TiO2NPs时明显地增加,随后随着进水TiO2NPs浓度增加而有所降低。1 640 cm-1附近吸收峰所代表的蛋白质二级结构中β-折叠可以促进污泥絮体的絮凝,进水TiO2NPs浓度增加可能影响SBR中活性污泥的絮凝过程。1 400 cm-1附近吸收峰的相对强度在TiO2NPs浓度为0、5和10 mg/L时没有明显变化,但在TiO2NPs浓度为30 mg/L时有轻微增加。目前研究结果表明,进水TiO2NPs 浓度变化对活性污泥的LB-EPS和TB-EPS中多糖和蛋白质的官能团有着明显的影响。

图4 不同TiO2 NPs浓度下LB-EPS和TB-EPS的红外光谱Fig. 4 FTIR spectra of LB-EPS and TB-EPS at different TiO2 NPs concentration
3 结论
(1)当TiO2NPs浓度为10~60 mg/L时对SBR反应器中COD去除只产生了轻微抑制,但是并未影响活性污泥的硝化过程。磷的去除率在TiO2NPs浓度从0 mg/L逐渐增加到5 mg/L过程中是逐渐降低,随后在TiO2NPs浓度从10 mg/L逐渐增加到60 mg/L过程中出现了逐渐升高的趋势。
(2)活性污泥中LB-EPS和TB-EPS产量随着进水TiO2NPs浓度从0 mg/L增加到60 mg/L而逐渐增加。
(3)进水中TiO2NPs浓度变化使LB-EPS和TB-EPS的3D-EEM荧光光谱中代表不同化学组成的荧光峰消失或增加,或者荧光峰位置发生了红移或蓝移,表明TiO2NPs浓度变化影响了LB-EPS和TB-EPS的化学组成。
(4)LB-EPS和TB-EPS的FTIR光谱中不同吸收峰的强度随着TiO2NPs浓度变化变化而变化,说明TiO2NPs浓度变化对LB-EPS和TB-EPS中PN和PS 的官能团有明显的影响。
[1] Yang X N, Cui F Y, Guo X C, et al. Effects of nanosized titanium dioxide on the physicochemical stability of activated sludge flocs using the thermodynamic approach and Kelvin probe force microscopy [J]. Water Research, 2013, 47: 3947-3958.
[2] Weir A, Westerhoff P, Fabricius L, et al. Titanium dioxide nanoparticles in food and personal care products[J]. Environmental Science Technology, 2012, 46: 2242-2250.
[3] Aruoja V, Dubourguier H C, Kasemets K, et al. Toxicity of nanoparticles of CuO, ZnO and TiO2to microalgaePseudokirchneriellasubcapitata[J]. Science of the Total Environment, 2009, 407: 1461-1468.
[4] Chen J Y, Dong X, Xin Y Y, et al. Effects of titanium dioxide nano-particles on growth and some histological parameters of zebrafish (Daniorerio) after a long-term exposure [J]. Aquatic Toxicology, 2011, 101: 493-499.
[5] Zhu X S, Chang Y, Chen Y S. Toxicity and bioaccumulation of TiO2nanoparticle aggregates inDaphniamagna[J]. Chemosphere, 2010, 78: 209-215.
[6] VBermejo-Nogales A, Connolly M C, Rosenkranz P, et al. Negligible cytotoxicity induced by different titanium dioxide nanoparticles in fish cell lines [J]. Ecotoxicology and Environmental Safety, 2017, 138: 309-319.
[7] Wu Q L, Wang W, Li Y X, et al. Small sizes of TiO2-NPs exhibit adverse effects at predicted environmental relevant concentrations on nematodes in a modified chronic toxicity assay system [J]. Journal of Hazardous Materials, 2012, 243: 161-168.
[8] Bermudez E, Mangum J B, Asgharian B, et al. Long-term pulmonary responses of three laboratory rodent species to subchronic inhalation of pigmentary titanium dioxide particles [J]. Toxicological Sciences, 2002, 70: 86-97.
[9] Hu Q L, Guo F L, Zhao F H, et al. Effect of titanium dioxide nanoparticle exposure on parkinsonism in zebrafish larvae and PC12 [J]. Chemosphere, 2017, 173: 373-379.
[10] Zheng X, Chen Y G, Wu R. Long-term effects of titanium dioxide nanoparticles on nitrogen and phosphorus removal from wastewater and bacterial community shift in activated sludge [J]. Environmental Science and Technology, 2011, 45: 7284-7290.
[11] Yang X N, Cui F Y, Guo X C, et al. Effects of nanosized titanium dioxide on the physicochemical stability of activated sludge flocs using the thermodynamic approach and Kelvin probe force microscopy [J]. Water Research, 2013, 47: 3947-3958.
[12] Li D P, Cui F Y, Zhao Z W, et al. The impact of titanium dioxide nanoparticles on biological nitrogen removal from wastewater and bacterial community shifts in activated sludge[J]. Biodegradation, 2014, 25: 167-177.
[13] 吴志高. 胞外聚合物对污泥沉降性能的影响及其生物除磷中的作用研究[D]. 重庆: 重庆大学, 2006. Wu Zhi-Gao. Study on the Effect of Extracellular Polymer Substances on the Settleability of the Sludge and Its Role in Biological Removal of Phosphorus [D]. Chongqing: Chongqing University, 2006.
[14] Yang S F, Li X Y. Influence of extracellular polymeric substances (EPS) on the characteristics of activated sludge under non-steady-state conditions [J]. Process Biochemistry, 2009, 44(1): 91-96.
[15] Li X Y, Yang S F. Influence of loosely bound extracellular polymeric substances (EPS) on the flocculation, sedimentation and dewater ability of activated sludge[J]. Water Research, 2007, 1(5): 1022-1030.
[16] 杨敏, 胡学伟, 宁平, 等. 废水生物处理中胞外聚合物(EPS)的研究进展 [J]. 工业水处理, 2011, 31(7): 7-12. Yang M, Hu X W, Ning P, et al. Research progress in extracellular polymeric substances applied to biological wastewater treatment [J]. Industrial Water Treatment, 2011, 31(7): 7-12.
[17] Miao L Z, Wang C, Hou J, et al. Response of wastewater biofilm to CuO nanoparticle exposure in terms of extracellular polymeric substances and microbial community structure [J]. Science of The Total Environment, 2017, 579: 588-597.
[18] Wang Z C, Gao M C, Wei J F, et al. Extracellular polymeric substances, microbial activity and microbial community of biofilm and suspended sludge at different divalent cadmium concentrations [J]. Bioresource Technology, 2016, 205: 213-221.
[19] Li N, Wei D, Wang S T, et al. Comparative study of the role of extracellular polymeric substances in biosorption of Ni (II) onto aerobic/anaerobic granular sludge [J]. Journal of Colloid and Interface Science, 2017, 490: 754-761.
[20] Keller A A, Wang H, Zhou D, et al. Stability and aggregation of metal oxide nanoparticles in natural aqueous matrices [J]. Environmental Science and Technology, 2010, 44: 1962-1967.
[21] 国家环境保护总局, 水和废水监测分析方法编委会. 水和废水监测分析方法(第四版)[M]. 北京:中国环境科学出版社, 2002. Chinese NEPA. Water and Wastewater Monitoring Methods[M]. Fourth ed. Beijing: Chinese Environmental Science Publishing Press, 2002.
[22] Li X Y, Yang S F. Influence of loosely bound extracellular polymeric substances (EPS) on the flocculation, sedimentation and dewaterability of activated sludge [J]. Water Research, 2007, 41: 1022-1030.
[23] 杨晓南. 水中纳米TiO2特性及对SBR活性污泥系统稳定性的影响研究 [D]. 哈尔滨: 哈尔滨工业大学, 2013. Yang Xiaonan. Characteristics of TiO2Nanoparticle in Water and Effects on the Satablility of SBR Activated Sludge System[D]. Harbin: Harbin Institute of Technology, 2013.
[24] Sheng G P, Yu H Q. Characterization of extracellular polymeric substances of aerobic and anaerobic sludge using three-dimensional excitation and emission matrix fluorescence spectroscopy [J]. Water Research, 2006, 40: 1233-1239.
[25] Chen W, Westerhoff P, Leenheer J A, et al. Fluorescence excitation-emission matrix regional integration to quantify spectra for dissolved organic matter [J]. Environmental Science and Technology, 2003, 37: 5701-5710.
[26] Yamashita Y, Tanoue E. Chemical characterization of protein-like fluorophores in DOM in relation to aromatic amino acids [J]. Marine Chemistry, 2003, 82: 255-271.
[27] Ramesh A, Lee D J, Hong S G. Soluble microbial products (SMP) and soluble extracellular polymeric substances (EPS) from wastewater sludge [J]. Applied Microbiology and Biotechnology, 2006, 73: 219-225.
[28] Sun X F, Ma Y, Liu X W, et al. Sorption and detoxification of chromium(VI) by aerobic granules functionalized with polyethylenimine [J]. Water Research, 2010, 44: 2517-2524.
[29] Wang Z, Wu Z, Yin X, et al. Membrane fouling in a submerged membrane bioreactor (MBR) under sub-critical flux operation: Membrane foulant and gel layer characterization [J]. Journal of Membrane Science, 2008, 325: 238-244.
[30] Pongjanyakul T, Puttipipatkhachorn S. Xanthan-alginate composite gel beads: molecular interaction and in vitro characterization [J]. International Journal of Pharmaceutics, 2007, 331: 61-71.
[31] Zhu L, Lv M L, Dai X, et al. The stability of aerobic granular sludge under 4-chloroaniline shock in a sequential air-lift bioreactor (SABR) [J]. Bioresource Technology, 2013, 140: 126-130.
