Affymetrix基因芯片测序技术分析垂体对 大鼠椎动脉型颈椎病模型的调控机制
2018-02-27巩彦龙刘建鸿董万涛刘小钰侯红艳
宋 敏,巩彦龙,刘 涛,刘建鸿,董万涛,刘小钰,侯红艳
(1. 甘肃中医药大学,甘肃兰州 730000;2. 甘肃中医药大学附属医院,甘肃兰州 730000)
椎动脉型颈椎病(cervical spondylosis of vertebral artery type, CSA)在中医学属于“眩晕”“项痹”的范畴,好发于中老年人,男性多于女性,其发病率约占颈椎病的20%~25%。其发病是由于颈椎出现不同程度的退化而导致椎-基底动脉狭窄[1],供血量下降,引起颅内供血不足,从而出现以眩晕为主要表现,伴有其他颈部及全身不适的临床综合征[2-3]。近年来,随着人们生活方式改变,CSA的发病率呈现快速上升的趋势,并趋向于年轻化。下丘脑-垂体-肾上腺轴(hypothalamic-pituitary-adrenal axi, HPA轴)是神经-内分泌-免疫(neuro-endocrine-immune, NEI)网络的关键组成部分,与CSA的发病密切相关。当椎动脉局部受到刺激时,机体应激信息在大脑通过复杂的神经通路激活HPA轴而改变机体的生理状态[4]。在HPA轴的调控下CSA的发病机制极其复杂[5],椎-基底动脉痉挛、血流量下降是CSA的基本发病机制,多种因素导致的椎动脉血管功能改变是CSA发生发展中的主要环节。研究基因调控对CSA的发病和治疗具有重要价值。本研究通过建立CSA大鼠模型,并设置正常对照,应用基因芯片技术,分析正常组和模型组大鼠垂体组织基因表达谱特征,进而筛选差异表达的基因,从基因功能、信号通路等方面探讨垂体对CSA模型大鼠的调控机制。
1 材料与方法
1.1 试剂及药品 Trizol试剂和ds-cDNA合成试剂盒购自Invitrogen公司;单色DNA标记试剂盒购自美国Nimble Gen Systems公司;逆转录试剂盒购自BioTNT公司;Affymetric HumangenomeU 133 plus2.0芯片购自Affymetrix公司;NucleoSpin®RNA clean-up试剂盒购自MACHEREY-NAGEL(Germany);PCR NucleoSpinExtract Ⅱ Kit(MN)和RNA Clean-up Kit(MN)购自上海浩然生物技术有限公司;T7 Oligo(dT)Primer上海宾智生物科技有限公司;注射用青霉素钠160 U/支(华北制药股份有限公司,批号:F5022318);水合氯醛,规格100 g/瓶(上海展云化工有限公司,产品编号:CAS-302-170)。
1.2 实验动物 雄性Wistar大鼠10只,10月龄,体质量(300±20)g,由甘肃中医药大学SPF级实验室[合格证号SCXK(甘)2011-0001]提供。每日给予充足的水和饲料,适应1周,24 h光照明暗各半,每3只饲养在同一笼中,每2 d更换1次垫料,已排除其他环境因素。
1.3 动物造模与分组 大鼠按体质量随机分为正常组和模型组。模型组动物均采用复合造模法(力学失衡法与植骨压迫法相结合)[6]建立CSA大鼠模型;造模成功后两组分别随机取出4只进行基因芯片检测。
1.4 组织取材 造模成功后分别解剖分离CSA模型组大鼠及正常组大鼠垂体组织,于液氮中速冻待送检测。
1.5 RNA提取及纯化 应用Trizol法提取大鼠垂体组织样品中总RNA;使用NanoDropND-1000进行质检;根据RNeasy MiNi Protocol,使用QLAGENR Neasy®Kit纯化Total RNA。
1.6 基因芯片检测 应用Agilent mRNA大鼠全基因单通道表达谱芯片,由北京博奥生物技术有限公司进行实验检测。
1.7 统计学方法 芯片数据由北京博奥生物技术有限公司生物芯片分析系统(MAS系统)进行归一化整理,对归一化数据进行差异表达基因分析,将差异基因以上调及下调2倍为限,通过DAVID(the database for annotation, visualization and integrated discovery)网站整合的数据库进行基因本体论(gene ontology, GO)、KEGG pathway分析差异基因在信号通路上的富集程度、分子功能和生物学过程;两组组内比较采用独立样本t检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 样品质量控制 8个待测样本中A260/280均在1.8~2.0之间,RNA总量≥1 μg,待测样本符合芯片实验要求(表1)。
经甲醛变性琼脂糖凝胶电泳检测RNA完整性的结果显示:有清晰可见的28S、18S条带,12号RNA样品28S∶18S rRNA条带亮度略小于1∶1,样品有轻微降解;其余RNA样品电泳条带清晰,28S∶18S rRNA条带亮度大于或接近1∶1(图1)。
2.2 基因表达谱分析
2.2.1 差异基因分析 基于R语言和BRB语言,模型组与正常组垂体组织之间的基因芯片表达数据进行差异基因的筛选,总共有203个基因上调、118个基因下调(图2),聚类分析热图中红色方块表示|fold change︱=2.205(>2),OR方法修正后的P=0.017(≤0.05)的差异表达基因。
2.2.2 CSA模型组大鼠与正常组大鼠垂体组织差异基因表达谱构成的散点图 见图3。
2.2.3 GO分析 使用DAVID对CSA模型组与正常组大鼠垂体组织比较获得的差异基因进行GO分析,结果显示,1 181个GOs被上调的差异基因调节,其中包括GO BP(biological process)944条、GO CC(cellular componen)111条、GO MF(molecular function)126条。在此分析中,主要针对GO BP进行分析,并且P值越小,该条GO Term越有意义,其中与调节CSA有相关联系的GO Term主要包括对细胞间信号传导活性的调节、G蛋白偶联受体信号调节、神经细胞功能的调节、对外界刺激的应激反应、凝血功能的调节、血管形成、酶活性的调节等;113个GOs被下调的差异基因调节,其中包括GO BP 49条、GO CC 37条、GO MF 27条。其中较为有意义的GO Term主要包括对细胞周期的调节、细胞对药物的反应、调节内膜系统、糖皮质激素刺激、离子通道活性的调节、运动行为的调节等。图4和表2为最有意义的部分差异基因所参与的GO功能及注释。
表1 评估RNA量和RNA质量
Tab.1 Assessment of RNA quantity and RNA quality
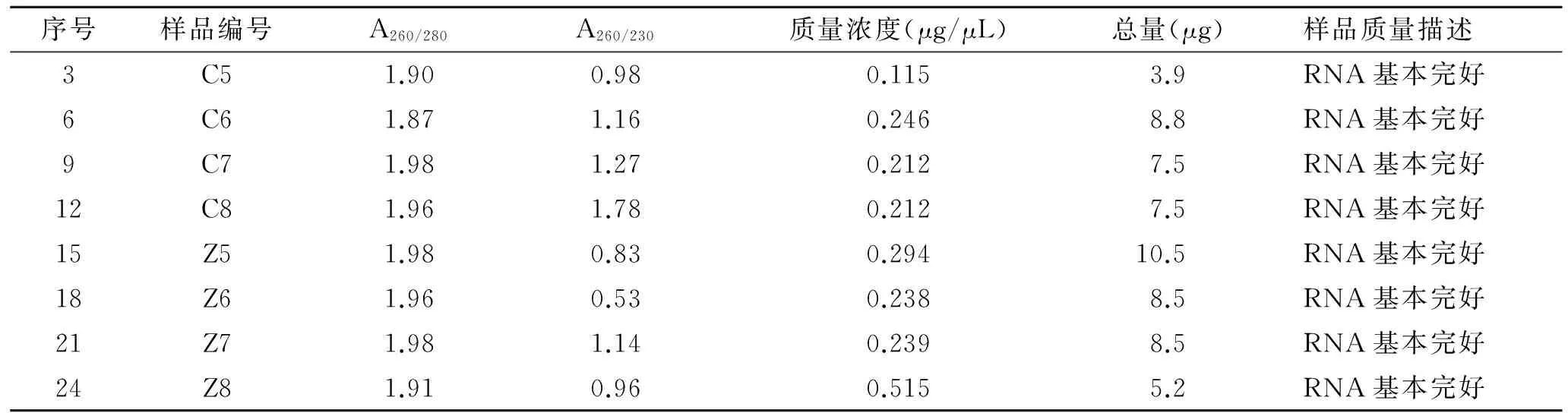
序号样品编号A260/280A260/230质量浓度(μg/μL)总量(μg)样品质量描述3C51.900.980.1153.9RNA基本完好6C61.871.160.2468.8RNA基本完好9C71.981.270.2127.5RNA基本完好12C81.961.780.2127.5RNA基本完好15Z51.980.830.29410.5RNA基本完好18Z61.960.530.2388.5RNA基本完好21Z71.981.140.2398.5RNA基本完好24Z81.910.960.5155.2RNA基本完好
Z为正常组垂体组织; C为模型组垂体组织。

图1 变性琼脂糖凝胶电泳法检测RNA样本的完整性
Fig.1 Detection of RNA sample integrity by denaturing agarose gel electrophoresis
数字代表样品编号,M泳道Hela Cell Control RNA。

图2 CSA模型组大鼠与正常组大鼠垂体组织聚类分析热图
Fig.2 Clustering analysis thermogram of pituitary tissue of rats in the CSA model and the normal group
红色:上调基因;绿色:下调基因;黑色:无差异基因。

图3 CSA模型组大鼠与正常组大鼠垂体组织差异基因表达谱构成的散点图
Fig.3 Scatter plot of the gene expression profile of the pituitary tissue in the CSA model group and the normal group
2.2.4 信号通路分析 将CSA模型组与正常组大鼠垂体组织比较所得到的差异基因进行信号通路分析,结果显示,上调的差异基因共调控96条信号通路(图5A),主要涉及神经活性的配体-受体相互作用、脂肪细胞因子信号通路、TGF-β信号通路、AMPK信号通路、PPAR信号通路、p53信号通路、ECM受体相互作用等。下调的差异基因共调控48条信号通路(图5B),

图4 模型组与正常组垂体组织差异基因所调控的部分GOs
Fig.4 Part of GOs regulated by pituitary tissue differential genes in the model group and the normal group
A:上调的差异基因所调控的部分GOs;B:下调的差异基因所调控的部分GOs。
表2 差异基因GO功能注释结果
Tab.2 GO function annotation results of the differential genes
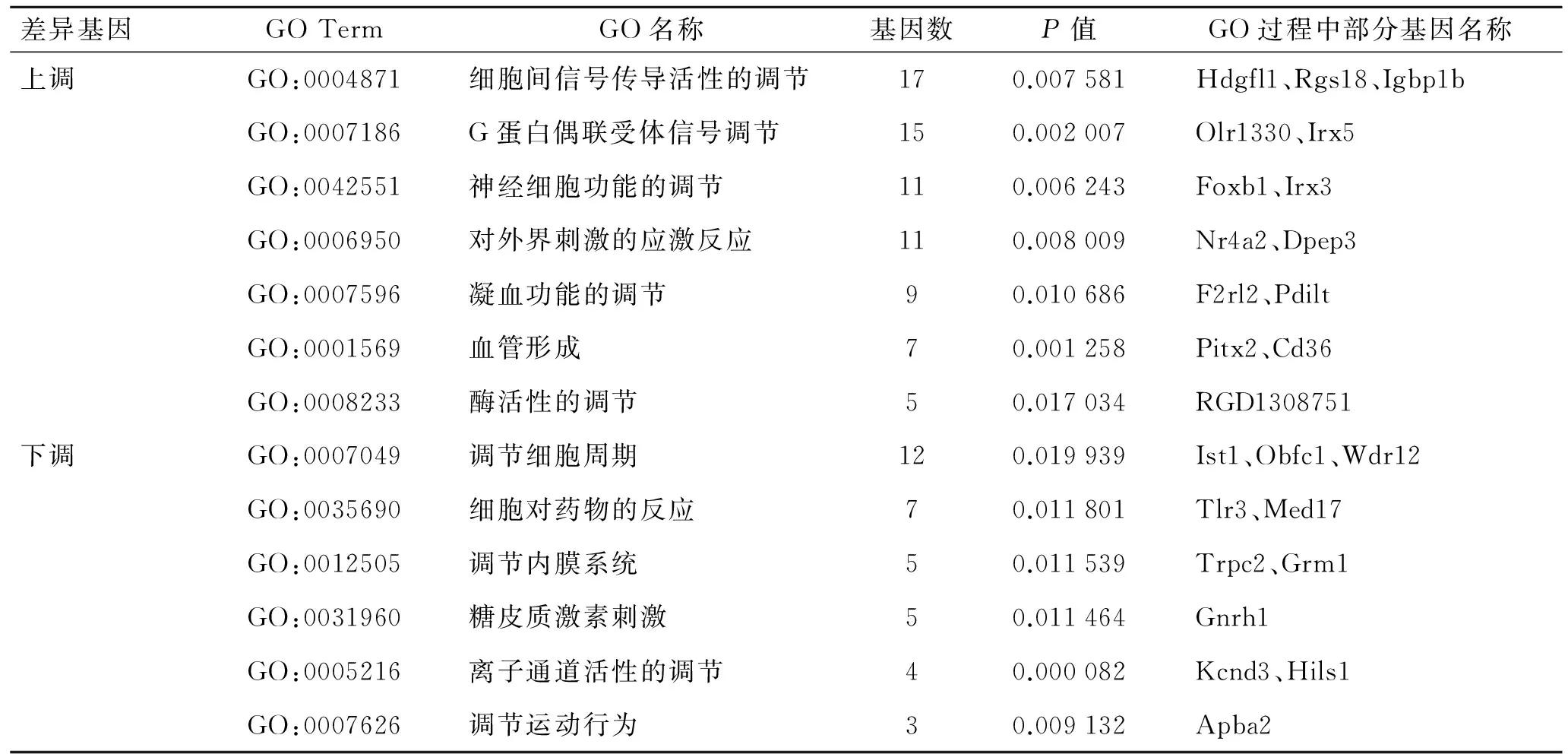
差异基因GOTermGO名称基因数P值GO过程中部分基因名称上调GO:0004871细胞间信号传导活性的调节170.007581Hdgfl1、Rgs18、Igbp1bGO:0007186G蛋白偶联受体信号调节150.002007Olr1330、Irx5GO:0042551神经细胞功能的调节110.006243Foxb1、Irx3GO:0006950对外界刺激的应激反应110.008009Nr4a2、Dpep3GO:0007596凝血功能的调节90.010686F2rl2、PdiltGO:0001569血管形成70.001258Pitx2、Cd36GO:0008233酶活性的调节50.017034RGD1308751下调GO:0007049调节细胞周期120.019939Ist1、Obfc1、Wdr12GO:0035690细胞对药物的反应70.011801Tlr3、Med17GO:0012505调节内膜系统50.011539Trpc2、Grm1GO:0031960糖皮质激素刺激50.011464Gnrh1GO:0005216离子通道活性的调节40.000082Kcnd3、Hils1GO:0007626调节运动行为30.009132Apba2
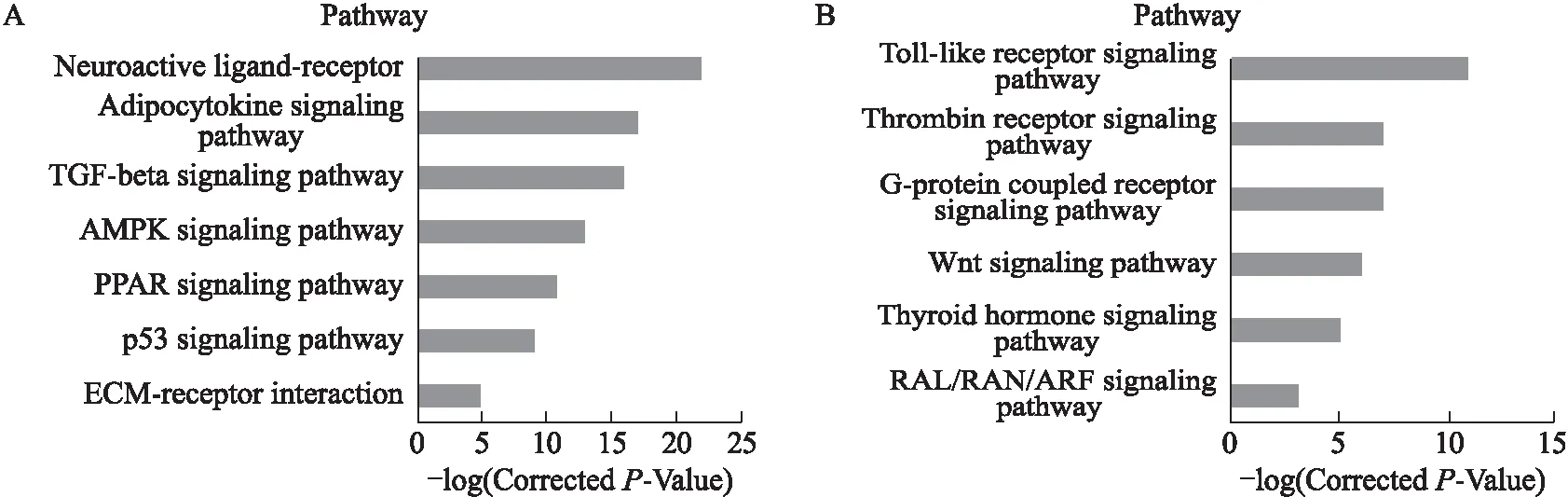
图5 垂体组织组间比较所得到的差异基因所调控的信号通路
Fig.5 Pituitary tissue was compared with the resulting differential gene regulated by the signaling pathway
A:上调的差异基因调节的信号通路;B:下调的差异基因调节的信号通路。
为Toll样受体信号通路、凝血酶受体信号通路、G蛋白偶联受体信号通路、Wnt信号通路、甲状腺激素信号通路、RAL/RAN/ARF信号通路等。表3为部分差异基因所调控的信号通路及注释。
表3 差异基因KEGG通路注释
Tab.3 Annotation of differential gene KEGG pathway
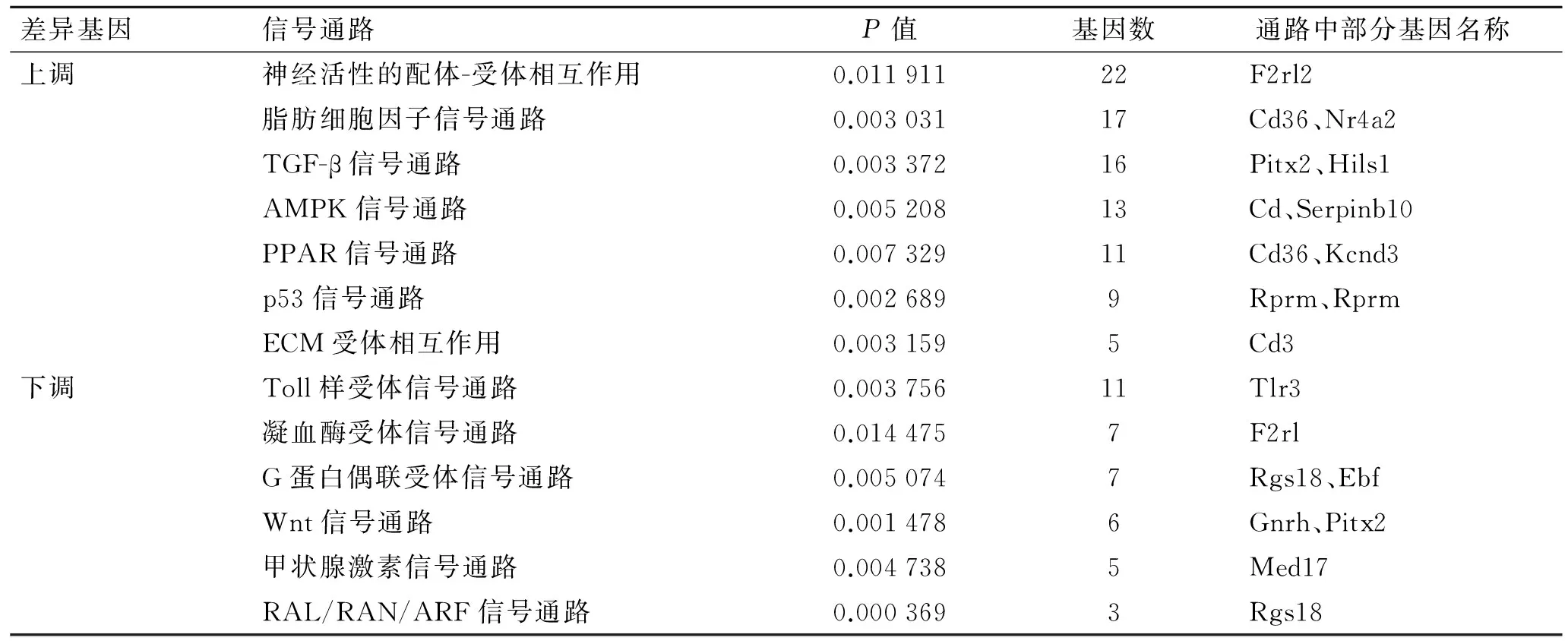
差异基因信号通路P值基因数通路中部分基因名称上调神经活性的配体-受体相互作用0.01191122F2rl2脂肪细胞因子信号通路0.00303117Cd36、Nr4a2TGF-β信号通路0.00337216Pitx2、Hils1AMPK信号通路0.00520813Cd、Serpinb10PPAR信号通路0.00732911Cd36、Kcnd3p53信号通路0.0026899Rprm、RprmECM受体相互作用0.0031595Cd3下调Toll样受体信号通路0.00375611Tlr3凝血酶受体信号通路0.0144757F2rlG蛋白偶联受体信号通路0.0050747Rgs18、EbfWnt信号通路0.0014786Gnrh、Pitx2甲状腺激素信号通路0.0047385Med17RAL/RAN/ARF信号通路0.0003693Rgs18
3 讨 论
NEI网络在CSA发病过程中起关键的调控作用,存在于NEI系统中的细胞因子、神经肽、细胞信息物质、激素等通过神经、免疫或者体液调节以维持机体的稳定性[7]。HPA轴是NEI网络的重要组成部分,与CSA的发病密切相关,当椎动脉局部受到刺激时,椎-基底动脉血管屈曲、扭转而发生痉挛,损伤血管内皮,产生无菌性炎症刺激,此时大脑通过复杂的神经通路接受机体应激信号而激活HPA轴,机体的生理状态发生改变。椎-基底动脉系统受刺激的同时具有与HPA轴相似的神经内分泌功能,通过基因调控组成特异性的、功能协调的反馈调节回路[8]。
为了进一步探讨CSA发病的分子机制,本研究采用全基因芯片技术,分析垂体差异基因表达谱,进而分析垂体在CSA发病过程中的调控作用,从生物信息学角度对其机制进一步阐释。模型组和正常组垂体组织差异基因表达谱分析结果显示,模型组与正常组比较,共有321个差异基因的表达,其中表达上调的有203个,表达下调的共有118个(|fold change︱>2,OR方法修正后的P<0.05),差异基因所调控的GO Term主要有对细胞间信号转导活性的调节、神经细胞功能的调节、对外界刺激的应激反应、凝血功能的调节、血管形成的调节、调节内膜系统、调节细胞周期等;参与的信号通路主要有脂肪细胞因子信号通路、TGF-β信号通路、AMPK信号通路、PPAR信号通路、凝血酶受体信号通路、Wnt信号通路、RAL/RAN/ARF信号通路等。
CSA的发病是机体神经、内分泌、免疫三大系统共同的作用结果,其基本病理改变是椎-基底动脉供血功能异常和动脉血管结构改变,管壁通透性增加,血管舒张功能变化等。LI等[9]报道变异的Fdgfl1基因能降低极低密度脂蛋白、低密度脂蛋白、载脂蛋白C水平,与血清高含量高密度脂蛋白引起的颈部动脉斑块疾病相关,还与缺血性心脏疾病引起的心脏血管功能改变相关。分布在椎动脉及周围组织的交感神经,由于长期遭受血管形态改变或局部无菌炎性刺激时,交感神经通过复杂的神经通路向大脑传递应激信号而激活HPA轴。本研究中垂体组织神经功能相关的上调基因有Foxb1和Irx3等,BILELLA等[10]研究表明,Foxb1基因的表达参与机体的多种生理病理过程,其中包括参与调节交感神经的功能而进一步调节血管的舒缩功能,垂体高表达的Foxb1基因在CSA疾病过程中与椎-基底动脉痉挛有关,Foxb1也与炎性刺激[11]、神经免疫相关[12],可参与疾病的免疫反应;SCARLETT等[13]研究发现,在血管内皮生长因子的刺激下,Irx3通过Notch信号通路介导在人类微血管内皮细胞(VEGF)中高表达,在创伤愈合的过程中Irx3能调节血管内皮细胞的迁移、趋化和浸润,致新血管形成,CSA中椎-基底动脉的舒缩功能改变与Irx3调控的血管内皮细胞的迁移、血管重构有关。CSA患者血液较正常人粘稠度增高[14]。本研究结果显示,调节凝血功能的F2rl2、Pdilt等基因上调,这与CSA患者血液高凝状态有关,血液相对呈高凝状态,使已受损的血管内膜更易附着粘附因子,使椎-基底动脉舒缩功能障碍加重;而调节内膜系统的基因Trpc2和Grm1在垂体组织中表达下调,这与椎-基底动脉内膜活性下降有关。
垂体组织中上调的差异基因信号通路有脂肪细胞因子信号通路。脂肪细胞因子是一类具有血管活性,并在维持血管系统内环境稳定和免疫应答过程中发挥重要作用的激素和细胞因子[15],脂肪细胞因子信号通路的激活能够抑制生长因子引起动脉平滑肌细胞的增殖及迁移。TGF-β信号通路激活使成纤维细胞增加ECM的合成与分泌[16],CSA患者由于椎动脉及其周围组织遭受长期慢性、反复损伤,引起TGF-β1持续合成释放及自我诱生,而使ECM沉积在椎动脉及周围组织,形成组织纤维化和瘢痕。AMPK信号通路激活不仅能促进血管内皮细胞生成[17],而且能导致颈椎周围的骨骼肌功能异常[18]。PPAR信号通路激活可导致血管内皮细胞损伤、血管平滑肌细胞及单核/巨噬细胞等增殖迁移,导致早期血管壁硬化[19]。Toll样受体信号通路下调,使炎症反应刺激细胞产生糖皮质激素的合成而激活HPA轴,这在免疫应答的调控过程中发挥着关键作用,垂体细胞感应这种信号释放促炎性细胞因子IL-6、LIF,形成负反馈糖皮质激素回路。Wnt信号通路能促进血管的新生,但在本研究中表达下调,这可能与多种激活的信号通路相拮抗有关。
本研究成功复制CSA大鼠模型后,应用基因芯片技术,分析了模型组和正常组大鼠垂体组织基因表达谱特征,得出大鼠垂体对CSA的主要调节作用,研究方法较新颖,对阐明CSA发病机制和进一步实验研究及临床实际具有一定的指导意义。结果表明,CSA的发病作用机制是多基因、多信号通路、多功能的综合方式进行调节的结果,垂体的调控机制主要通过对炎性刺激、免疫调节、调节椎动脉功能及内膜系统而实现,这为进一步研究CSA的防治提供了线索。但是,垂体对CSA的调控乃至HPA轴甚至是整个NEI网络调控的具体机制仍需要进一步研究。中医药治疗CSA有明显的优势。本课题组下一步将进行中医药干预并应用基因芯片技术,寻找中医药治疗CSA具有重要意义的调控靶点,为临床治疗提供有效的科学依据。
[1] FENG MS, GAO JH, ZHU LG, et al. Analysis of X-ray signs of cervical spondylosis between vertebral artery type and radiculopathy[J]. Zhongguo Gu Shang, 2015, 28(4):330-334.
[2] YONG CL, BAOGAN P. Pathogenesis, diagnosis, and treatment of cervical vertigo[J]. Pain Physician, 2015, 18(4):583-595.
[3] 刘智勇,郝阳泉. 椎动脉型颈椎病的病因病机研究进展[J]. 实用中西医结合临床, 2015, 15(4):88-90.
[4] 董万涛,宋敏,蒋宜伟,等. “柔筋养精”手法治疗椎动脉型颈椎病临床研究[J]. 中华中医杂志, 2014, 29(7):2294-2297.
[5] 宋敏,董万涛,蒋宜伟,等. 浅析椎动脉型颈椎病发病中神经-内分泌-免疫网络信息分子的影响[J]. 甘肃中医学院学报, 2012, 29(1):15-18.
[6] 巩彦龙,宋敏,刘涛,等. 3种方法评价椎动脉型颈椎病大鼠模型[J]. 暨南大学学报(自然科学与医学版), 2016, 37(6):497-502.
[7] BONN M, SCHMITT A, LESCH KP, et al. Serotonergic innervation and serotonin receptor expression of NPY-producing neurons in the rat lateral and basolateral amygdaloid nuclei[J]. Brain Struct Funct, 2013, 218(2):421-435.
[8] ZHAO XJ, ZHAO Z, YANG DD, et al. Activation of ATP-sensitive potassium channel by iptakalim normalizes stress-induced HPA axis disorder and depressive behaviour by alleviating inflammation and oxidative stress in mouse hypothalamus[J]. Brain Res Bull, 2017, 30(16):30455-30465.
[9] LI J, LANGE LA, DUAN Q, et al. Genome-wide admixture and association study of serum iron, ferritin, transferrin saturation and total iron binding capacity in African Americans[J]. Hum Mol Genet, 2015, 24(2):572-581.
[10] BILELLA A, ALVAREZ-BOLADO G, CELIO MR. The Foxb1-expressing neurons of the ventrolateral hypothalamic parvafox nucleus project to defensive circuits[J]. J Comp Neurol, 2016, 524(15):2955-2981.
[11] MA Y, WANG X, PENG Y, et al. Forkhead box O1 promotes INS1 cell apoptosis by reducing the expression of CD24[J]. Mol Med Rep, 2016, 13(4):2991-2998.
[12] BILELLA A, ALVAREZ-BOLADO G, CELIO MR. Coaxiality of Foxb1- and parvalbumin-expressing neurons in the lateral hypothalamic PV1-nucleus[J]. Neurosci Lett, 2014, 566(2):111-114.
[13] SCARLETT K, PATTABIRAMAN V, BARNETT P, et al. The proangiogenic effect of iroquois homeobox transcription factor Irx3 in human microvascular endothelial cells[J]. J Biol Chem, 2015, 290(10):6303-6315.
[14] 李清林,宋敏,孙定平,等. 活血定眩胶囊对CSA模型大鼠椎动脉血流量及血浆PAI、t-PA水平的影响[J]. 四川大学学报(医学版), 2016, 47(6):862-865.
[15] 张洁,李兴. 脂肪细胞因子的研究进展[J]. 中国现代药物应用, 2011, 5(2):237-239.
[16] 刘镕,赵琴平,董惠芬,等. TGF-β信号传导通路及其生物学功能[J]. 中国病原生物学杂志, 2014, 9 (1):77-83.
[17] 张普,刘铭雅,朱伟,等. Apelin经Akt/AMPK信号通路促进心肌微血管内皮细胞血管生成[J]. 国际心血管病杂志, 2013, 40(1):44-48.
[18] KOU X, LI J, LIU X, et al.Ampelopsin attenuates the atrophy of skeletal muscle from d-gal-induced aging rats through activating AMPK/SIRT1/PGC-1α signaling cascade[J]. Biomed Pharmacother, 2017, 90(3):311-320.
[19] 张友明,杨笛,吴恒芳,等. 低剪切力下调PPAR信号通路参与BALB/c小鼠局部血管早期病变的实验研究[J]. 南京医科大学学报(自然科学版), 2015, 5(5):607-614.
