3.0T二维多体素磁共振波谱对新生儿脑发育评价的研究
2018-02-27孙亲利杜永浩徐小玲鱼博浪
孙亲利,金 超,杜永浩,徐小玲,郑 婕,曹 盼,鱼博浪,杨 健
(西安交通大学第一附属医院:1. 医学影像科;2. 临床研究中心,陕西西安 710061)
磁共振波谱(magnetic resonance spectroscopy, MRS)是目前唯一无创性的研究活体组织代谢、生化变化及化合物定量分析的方法[1-2],其可实现脑内生化代谢过程的定量刻画,提供有关细胞能量代谢、神经元功能及选择性神经递质活动等信息,已被广泛应用于新生儿脑损伤疾病的早期诊断和疗效评估[3-8]。然而,目前尚未建立新生儿脑波谱代谢物水平的正常值标准[9-10]。既往关于正常新生儿脑发育的研究多采用单体素波谱技术,其体素较大,混合了脑发育成熟度不同的脑区,测量结果不甚准确[9,11]。现有的多体素波谱成像技术,体素较小,一次采集实现多脑区分析,已广泛应用于中枢神经系统疾病的临床诊断及鉴别诊断。本研究应用3.0T多体素MRS技术比较新生早产儿与足月儿脑内不同部位代谢物比值的差异,分析代谢物比值与校正胎龄(母亲末次月经第1天至新生儿MRI检查时的周数)的相关性,探讨多体素MRS在脑发育评价中的价值及建立波谱代谢物正常值范围的可行性。
1 材料与方法
1.1 病例资料 本研究经西安交通大学第一附属医院伦理委员会批准,所纳入新生儿的父母均签署了MR检查知情同意书。连续性收集自2011年1月-12月在我院行头颅MRS检查的新生儿。正常新生儿纳入标准:①检查日龄≤28 d;②头颅MRI未见异常。排除标准:①临床神经系统表现异常;②严重代谢性疾病;③MRS谱线信噪比差无法进行定量分析的病例。
1.2 扫描设备及方法 应用3.0T GE Signa HDxt磁共振扫描仪,8通道头部相控阵线圈进行头颅MR扫描。为减少新生儿头动并顺利完成MRI检查,在扫描前30 min,由责任护士遵照临床主管医师医嘱,给予100 g/L水合氯醛0.5 mL/kg口服或苯巴比妥10~15 mg/kg肌内注射,患者的选择、生命体征监护以及后续跟踪观察严格按照指南要求执行[12]。待新生儿入睡后由主管医师和家属护送至MR室,包裹在襁褓中放置于MRI扫描床上,外耳道放置防噪声弹性耳塞以减小MRI设备噪声对听力的影响,并在头部两侧用海绵固定以减少运动伪影,扫描全程对新生儿实施心电监护,监测心率和呼吸情况,扫描结束后,由主管医师及父母将其护送回新生儿监护室。
扫描序列及成像参数如下:①T1WI:FSPGR序列,3D轴位扫描;TR/TE:10/4.6 ms;层厚/间距:1/0 mm;矩阵:256×256;视野(field of view, FOV):180 mm×180 mm;采集次数:1次;扫描时间:5 min 5 s;②T2WI:FSE序列,行轴位扫描;TR/TE:4 200/102~118 ms;层厚/间距:4/0 mm;矩阵:320×320;FOV:180 mm×180 mm;采集次数:1.5次;扫描时间:2 min 14 s;③垂直横轴位T2WI:FSE序列;TR/TE:2 900/120 ms;层厚/间距:5/0 mm;矩阵:320×192;FOV:200 mm×200 mm;采集次数:2次;扫描时间:35 s;④MRS:选用PRESS序列,Probe 2D-SI,在垂直横轴位T2WI上并结合三平面来定位,感兴趣区位于基底节区层面,包括双侧豆状核、双侧丘脑及侧脑室前角旁白质等解剖区域(图1),参数:TR 1 000 ms,TE 144 ms,层厚10 mm,矩阵:18×18;FOV:240 mm×240 mm;采集次数:1次;扫描时间:5 min 28 s。在感兴趣边缘添加饱和带。扫描过程包括自动匀场和水抑制,要求水峰半高线宽≤10,水抑制≥98%。
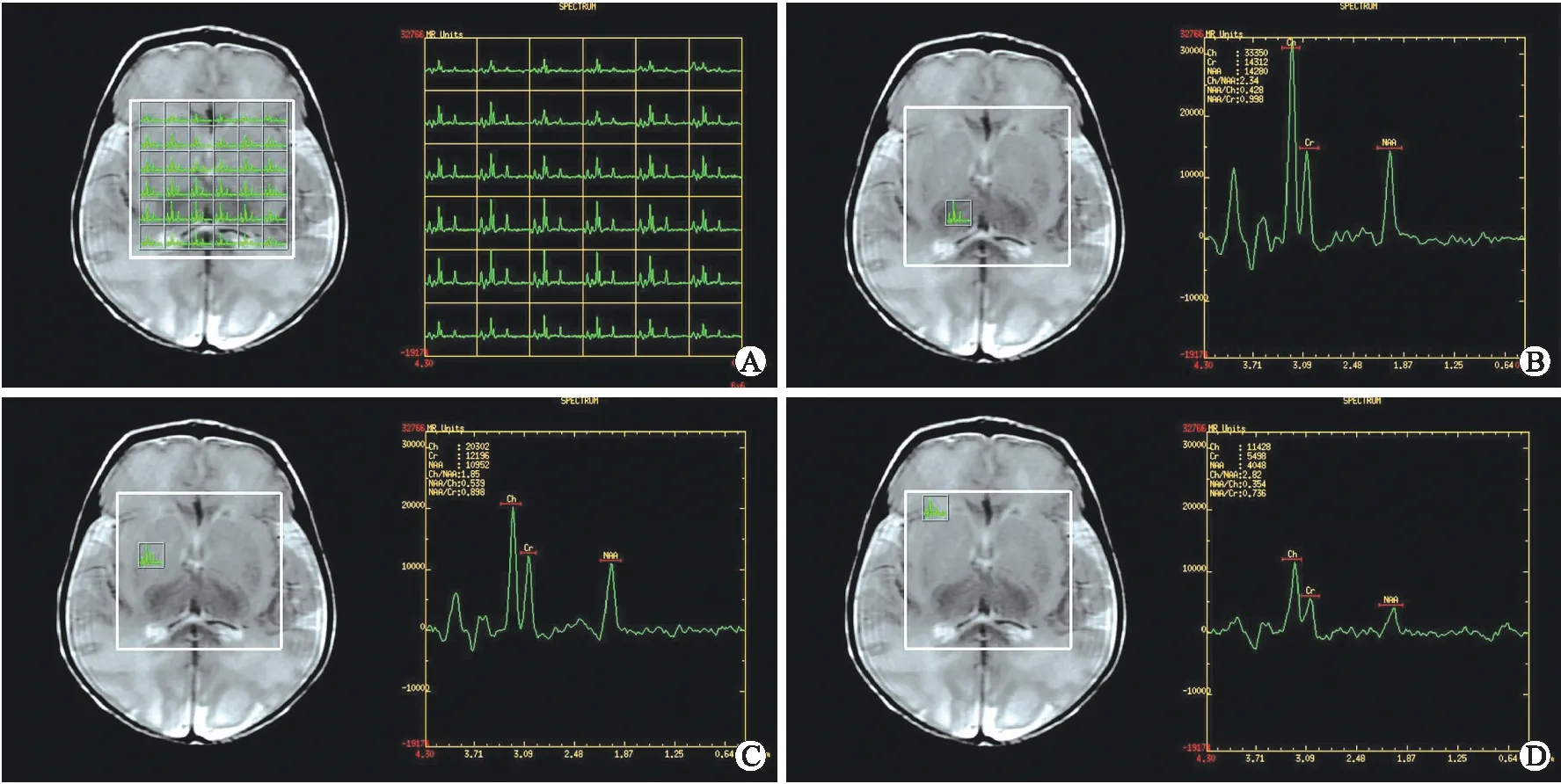
图1 MRS检查感兴趣区定位图、测量部位及谱线图示例(女,胎龄33+6周,生后8 d)
Fig.1 Representative MRS images of anatomical location and spectroscopy metabolites:A newborn girl of 33+6weeks’ gestation, imaged on day 8
A:基底节区层面多体素MRS定位图;B:右侧丘脑;C:右侧豆状核;D:右侧侧脑室前角旁白质。
1.3 图像后处理及测量方法 应用GE AW4.4工作站Functool软件进行波谱后处理,调整体素位置使分别位于左右侧豆状核、左右侧丘脑及左右侧脑室前角旁白质,测量胆碱(Cho,3.20 ppm)、N-乙酰天门冬氨酸(NAA,2.02 ppm)、肌酸(Cr,3.00 ppm)波峰下面积,记录Cho/Cr、NAA/Cho、NAA/Cr峰下面积比值。

2 结 果
2.1 一般情况 如图2流程图所示,依据纳入标准及排除标准,本研究最终纳入分析的正常新生儿MRS数据共54例,其中早产儿、足月儿各27例,基本人口统计学资料见表1。早产儿:出生胎龄30+1~36+1周[平均(34.03±1.30)周],MRS检查时生后日龄3~20 d[平均(9.59±4.35)d],校正胎龄32+2~37+4周[平均(35.40±1.31)周]。足月儿:出生胎龄37~41周[平均(39.11±1.23)周],MRS检查时生后日龄3~28 d[平均(9.44±6.84)周],校正胎龄37+4~43周[平均(40.46±1.65)周]。早产儿组与足月儿组间生后日龄没有统计学差异(P=0.925)。
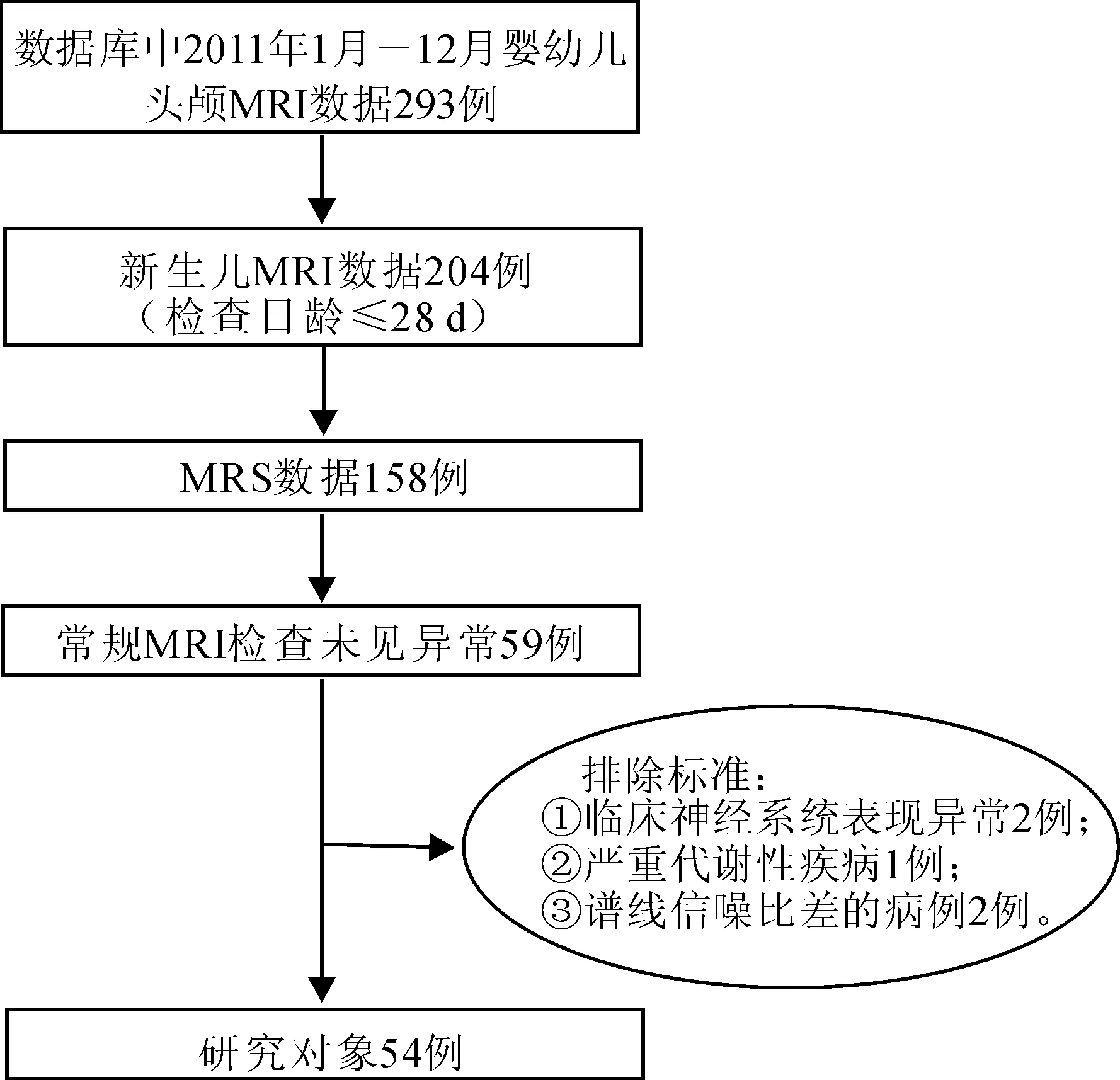
图2 研究人群选择的流程图及纳排标准
Fig.2 Flow chart for determining the research participants based on the inclusion and exclusion criteria
2.2 MRS代谢物比值分析
2.2.1 早产儿与足月儿MRS代谢物比值的比较 新生儿MRS表现为Cho峰最高,其次为Cr、NAA峰。各部位左右侧MRS代谢物比值比较无统计学差异,取左右侧平均值进行统计分析,早产儿与足月儿各部位MRS代谢物比值见表2。早产儿组豆状核、丘脑及侧脑室前角旁白质Cho/Cr、NAA/Cho与足月儿组比较均有统计学差异(P<0.05):Cho/Cr早产儿组高于足月儿组(P<0.05),NAA/Cho早产儿组低于足月儿组(P<0.001)。早产儿组与足月儿组NAA/Cr仅在豆状核有差异(P<0.001),早产儿组低于足月儿组,丘脑及侧脑室前角旁白质两组间无差异(P>0.05,图3)。
表1 研究对象的人口统计学资料
Tab.1 Patient demographics (preterm and term neonates)

项目早产儿(n=27)足月儿(n=27)P男孩[n(%)] 17(62.96) 11(40.74)0.173胎龄(x±s,周)34.03±1.3039.11±1.23<0.001体质量(x±s,g)1819.26±382.612865.56±619.48<0.001生后日龄(x±s,d)9.59±4.359.44±6.840.925校正胎龄(x±s,周)35.40±1.3140.46±1.65<0.001
表2 早产儿与足月儿各部位MRS代谢物比值
Tab.2 Metabolite ratios of preterm and term neonates in three regions

(±s)
2.2.2 各部位间MRS代谢物比值的比较 早产儿Cho/Cr、NAA/Cho、NAA/Cr在豆状核、丘脑及侧脑室前角旁白质等3个部位两两之间比较均有统计学差异(豆状核与丘脑、豆状核与侧脑室前角旁白质、丘脑与侧脑室前角旁白质Cho/Cr比较P值分别为0.002、<0.001、0.015,NAA/Cho比较P值分别为0.004、<0.001、<0.001,NAA/Cr比较P值分别为0.010、0.011、<0.001)。足月儿Cho/Cr、NAA/Cho、NAA/Cr在豆状核与侧脑室前角旁白质间比较有统计学差异(P值分别为<0.001、<0.001、0.002),在豆状核与丘脑间没有统计学差异(P值分别为0.090、0.276、0.465);丘脑与侧脑室前角旁白质间NAA/Cho、NAA/Cr有统计学差异(P均<0.001),Cho/Cr没有统计学差异(P=0.053,图3)。
2.2.3 MRS代谢物比值与校正胎龄相关性分析 除侧脑室前角旁白质NAA/Cr与校正胎龄没有相关性外(P=0.285),其余各部位各代谢物比值均与校正胎龄有相关性(P<0.05,图4)。豆状核、丘脑及侧脑室前角旁白质Cho/Cr均与校正胎龄呈负相关(r=-0.325、-0.633、-0.438,P=0.017、<0.001、0.001),NAA/Cho均与校正胎龄呈正相关(r=0.604、0.773、0.483,P均<0.001);NAA/Cr在豆状核、丘脑与校正胎龄呈正相关(r=0.487、0.367,P<0.001、P=0.006)。回归方程见图4所示。
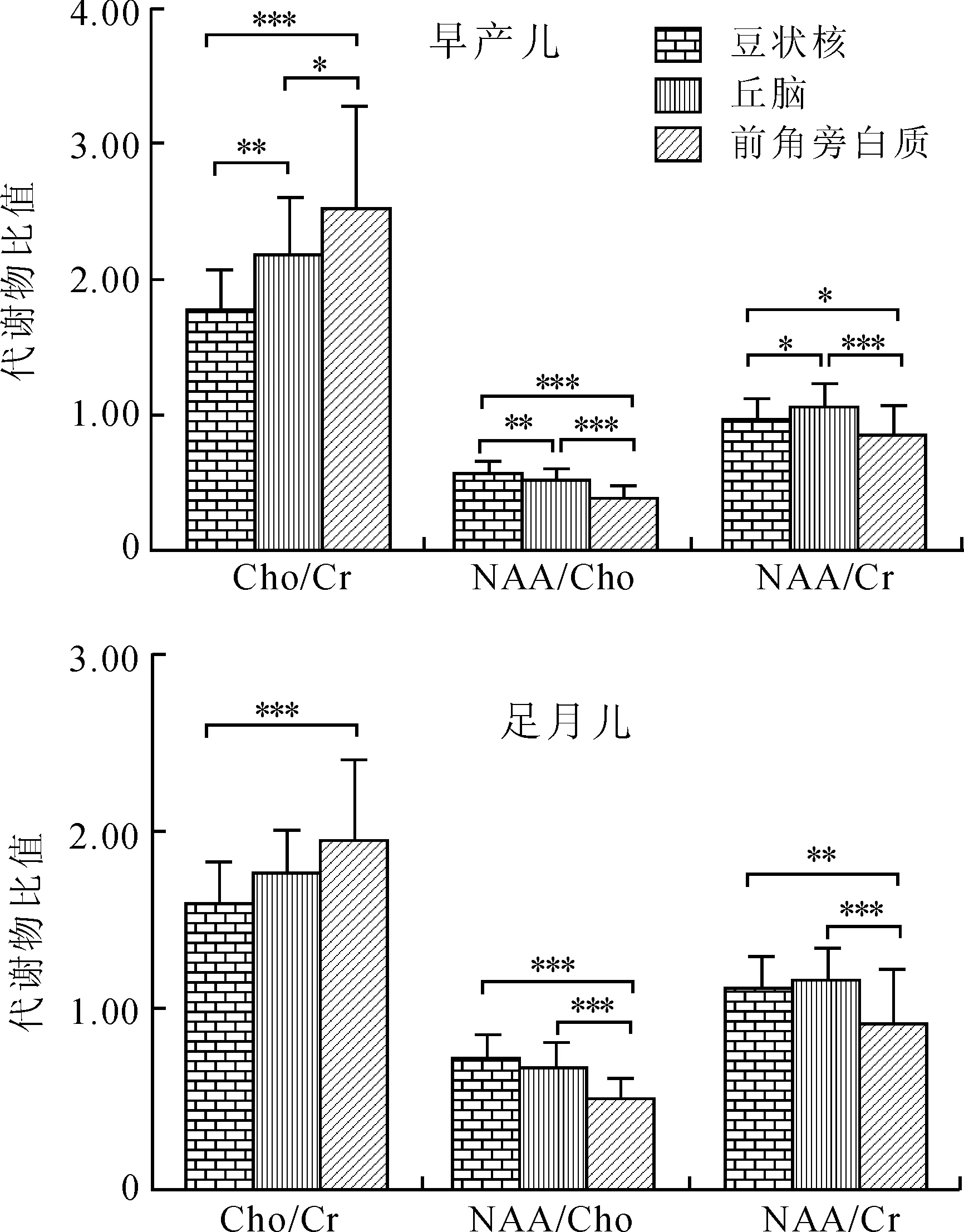
图3 各部位间MRS代谢物比值的比较
Fig.3 Comparison of metabolite ratios among the three regions in preterm and term groups
***P<0.001,**P<0.01,*P<0.05。
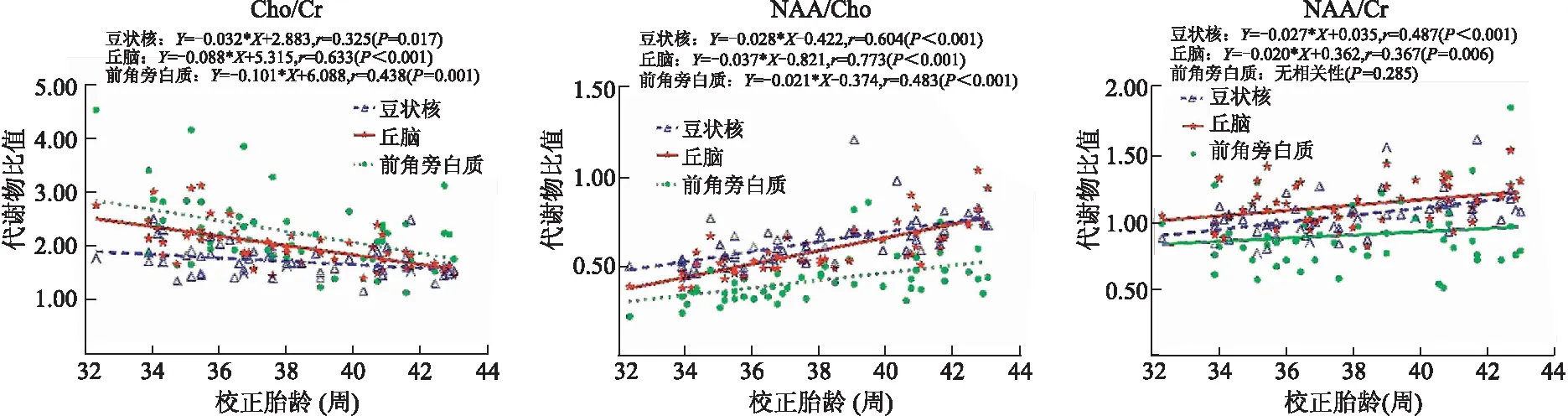
图4 各部位MRS代谢物比值与校正胎龄的相关与回归分析
Fig.4 Correlation and regression analyses of metabolite ratios with postmenstrual ages (PMA) in the three regions
3 讨 论
本研究应用3.0T二维多体素MRS对新生儿大脑基底节层面脑内重要区域代谢物进行量化分析,研究结果显示,早产儿Cho/Cr高于足月儿,NAA/Cho低于足月儿;脑内不同部位代谢物比值有差异,白质区域Cho/Cr高于灰质,NAA/Cho低于灰质;Cho/Cr随校正胎龄升高而降低,NAA/Cho随校正胎龄升高而增加。以上结果表明,随着大脑不断发育成熟,脑内代谢物比值呈现时空演变的特征。这也进一步证明MRS在新生儿脑发育评估中的应用价值。
3.1 早产儿与足月儿MRS代谢物比值不同 本研究发现,早产儿与足月儿脑内MRS代谢物比值明显不同,早产儿Cho/Cr较足月儿高,NAA/Cho较足月儿低。既往研究在基底节区、丘脑、侧脑室周围脑白质等部位亦发现早产儿与足月儿代谢物比值有差异[9,13-14]。有关新生儿脑内代谢物浓度的研究发现,新生儿脑内NAA与Cr呈动态变化,其浓度随年龄增长不断升高,而Cho的浓度在新生儿期无明显变化[15]。据此分析,随着脑发育的成熟,神经元密集、髓鞘形成活跃、能量需求增加,MRS代谢物比值Cho/Cr与NAA/Cho分别会呈现降低与升高趋势,这亦是早产儿与足月儿MRS代谢物比值Cho/Cr、NAA/Cho存在差异的原因所在。而发育中NAA与Cr浓度均不断升高,其比值NAA/Cr较难反映大脑成熟度的变化,正如本研究结果所示,早产儿与足月儿间丘脑、侧脑室前角旁白质NAA/Cr没有明显差异。以上分析,我们可以得出,MRS代谢物比值Cho/Cr、NAA/Cho可作为脑代谢评价的生物学指标,评估新生儿脑发育进程及成熟度。
3.2 不同部位MRS代谢物比值不同 比较豆状核、丘脑及侧脑室前角旁白质3个部位间MRS代谢物比值,发现早产儿Cho/Cr、NAA/Cho与NAA/Cr在3部位间均存在差异,足月儿在豆状核与侧脑室前角旁白质、丘脑与侧脑室前角旁白质间存在差异。以上结果进一步印证了人类大脑发育的时空变化特征,即不同部位生化成熟的速率不同[9,16]。Cho/Cr比值在侧脑室前角旁白质最高,其次为丘脑和豆状核;NAA/Cho比值在豆状核、丘脑高于侧脑室前角旁白质。以上结果提示,新生儿发育过程中,丘脑和豆状核较侧脑室前角旁白质较早成熟,这也符合脑发育从背侧到腹侧、从中心到外周的一般规律[16]。值得注意的是,我们发现豆状核NAA/Cho比值最高,与以往研究中丘脑NAA/Cho比值最高、为发育最成熟区的结论不一致[9,11]。笔者分析,这可能与其仅进行丘脑与基底节区比较,而未将豆状核单独测量分析有关。本研究亦发现,早产儿部位间代谢物比值的差异较足月儿大,这与VIGNERON等[9]的研究一致;足月儿丘脑与豆状核部位间Cho/Cr、NAA/Cho、NAA/Cr无差异,可能说明此两部位间的成熟度差异随着发育呈逐渐缩小趋势。
3.3 MRS代谢物比值的随龄性变化特点 通过分析脑内MRS代谢物比值与校正胎龄的相关性,发现豆状核、丘脑及侧脑室前角旁白质区NAA/Cho及豆状核、丘脑NAA/Cr随着校正胎龄的升高而增加,Cho/Cr均随着校正胎龄的升高而降低;其中丘脑与校正胎龄的相关性最强,其次是豆状核,再次为侧脑室前角旁脑白质,且以NAA/Cho与校正胎龄相关系数最高。刘岭岭等[17]应用单体素MRS分析正常新生儿右侧额叶及右侧基底节区脑代谢物亦发现代谢物比值的这种随龄性变化。XU等[11]应用三维多体素磁共振波谱分析55例早产儿基底节、丘脑、视辐射、距状皮层、皮质脊髓束、顶叶白质及额叶白质等7个脑区,发现所有部位的NAA/Cho均随着胎龄明显升高,但其未对Cho/Cr、NAA/Cr与校正胎龄的相关性进行分析。从回归曲线亦可以看出,随着胎龄的增加,部位间的差异逐渐缩小,尤其是豆状核与丘脑,这可能与豆状核和丘脑同属额部皮层下环路(frontal-subcortical circuits)有关[18],均为灰质结构,随着发育其代谢速率逐渐同步。
相较国内外1.5T磁共振波谱分析,本研究应用3.0T多体素磁共振波谱技术对早产与足月新生儿进行扫描,所得MRS波谱谱线较好、信噪比高,且多体素采集较单体素测量的结果更为准确。虽然分析浓度更能反映脑内代谢情况,但其需专业软件,分析过程复杂,难以普及应用,而选取代谢物比值分析更加便捷,结果适用于临床实际。本研究亦存在以下不足:①考虑新生儿耐受性差,本研究选用二维多体素,未进行三维多体素的全脑分析;②考虑到伦理方面,选取的研究对象并非健康志愿者,但已尽最大努力进行临床随访排除有异常的研究对象。
本研究证实了应用3.0T二维多体素MRS研究新生儿脑发育的可行性,新生儿脑代谢物比值有部位差异及随龄性的时空变化特点,在分析新生儿波谱时考虑部位和胎龄非常重要。通过收集正常新生儿MRS数据建立不同部位不同胎龄的正常值标准,才能更好地进行新生儿脑发育成熟度的评价及脑损伤疾病的早期诊断。
[1] XU D, VIGNERON D. Magnetic resonance spectroscopy imaging of the newborn brain—A technical review[J]. Semin Perinatol, 2010, 34(1):20-27.
[2] SOARES DP, LAW M. Magnetic resonance spectroscopy of the brain: Review of metabolites and clinical applications[J]. Clin Radiol, 2009, 64(1):12-21.
[3] VIGNERON DB. Magnetic resonance spectroscopic imaging of human brain development[J]. Neuroimaging Clin N Am, 2006, 16(1):75-85, viii.
[4] WU W, ZHANG P, WANG X, et al. Usefulness of (1) H-MRS in differentiating bilirubin encephalopathy from severe hyperbilirubinemia in neonates[J]. J Magn Reson Imaging, 2013, 38(3):634-640.
[5] KENDALL GS, MELBOURNE A, JOHNSON S, et al. White matter NAA/Cho and Cho/Cr ratios at MR spectroscopy are predictive of motor outcome in preterm infants[J]. Radiology, 2014, 271(1):230-238.
[6] CARD D, NOSSIN-MANOR R, MOORE AM, et al. Brain metabolite concentrations are associated with illness severity scores and white matter abnormalities in very preterm infants[J]. Pediatr Res, 2013, 74(1):75-81.
[7] PANIGRAHY A, NELSON MDJR, BLUML S. Magnetic resonance spectroscopy in pediatric neuroradiology: Clinical and research applications[J]. Pediatr Radiol, 2010, 40(1):3-30.
[8] 李美蓉,李玉华. 正常新生儿脑组织~1H-MRS研究[J]. 国际医学放射学杂志, 2011, 34(6):522-525.
[9] VIGNERON DB, BARKOVICH AJ, NOWOROLSKI SM, et al. Three-dimensional proton MR spectroscopic imaging of premature and term neonates[J]. AJNR Am J Neuroradiol, 2001, 22(7):1424-1433.
[10] BARTHA AI, YAP KR, MILLER SP, et al. The normal neonatal brain: MR imaging, diffusion tensor imaging, and 3D MR spectroscopy in healthy term neonates[J]. AJNR Am J Neuroradiol, 2007, 28(6):1015-1021.
[11] XU D, BONIFACIO SL, CHARLTON NN, et al. MR spectroscopy of normative premature newborns[J]. J Magn Reson Imaging, 2011, 33(2):306-311.
[12] COTE CJ, WILSON S. Guidelines for monitoring and management of pediatric patients during and after sedation for diagnostic and therapeutic procedures: An update[J]. Pediatrics, 2006, 118(6):2587-2602.
[13] 刘绪明,张嫣然,万诚,等. 磁共振波谱在早产儿神经系统发育落后早期预测的价值[J]. 医学影像学杂志, 2016, 26(6):962-966.
[14] 肖钢明,刘丽芳,姜梅,等. 不同胎龄新生儿脑代谢物及脑内不同部位体积的研究[J]. 中国新生儿科杂志, 2015, 30(4):255-258.
[15] TOMIYASU M, AIDA N, ENDO M, et al. Neonatal brain metabolite concentrations: Aninvivomagnetic resonance spectroscopy study with a clinical MR system at 3 Tesla[J]. PLoS One, 2013, 8(11):e82746.
[16] BLUML S, WISNOWSKI JL, NELSON MD JR, et al. Metabolic maturation of the human brain from birth through adolescence: Insights frominvivomagnetic resonance spectroscopy[J]. Cereb Cortex, 2013, 23(12):2944-2955.
[17] 刘岭岭,孛茹婷,杨文君,等. 正常新生儿脑发育的~1H-MRS研究[J]. 实用医学杂志, 2015, 31(20):3343-3346.
[18] LAO Y, WANG Y, SHI J, et al. Thalamic alterations in preterm neonates and their relation to ventral striatum disturbances revealed by a combined shape and pose analysis[J]. Brain Struct Funct, 2016, 221(1):487-506.
