磁共振扩散张量成像多参量评估早产与足月新生儿脑白质发育
2018-02-27李贤军孙亲利王苗苗刘聪聪刘黎明
李贤军,刘 哲,孙亲利,王苗苗,刘聪聪,侯 欣,刘黎明,杨 健
(西安交通大学第一附属医院:1. 影像科;2. 儿保科,陕西西安 710061)
早产儿出生胎龄较低(<37周),与足月儿相比,脑发育不完善[1],是脑白质损伤的高发人群[2]。而脑发育结局往往与出生时的脑白质发育状态密切相关[3-4]。因此,需要量化分析早产与足月新生儿脑白质发育,为临床评估脑发育状态提供客观指标。
尽管病理标本研究可直接展示脑白质发育的程度,但无法反映活体状态下脑发育水平[5],基于磁共振成像(magnetic resonance imaging, MRI)的扩散张量成像(diffusion tensor imaging, DTI)技术为研究活体状态下脑白质发育提供了量化指标[6]:平行扩散率(axial diffusivity, AD)反映脑白质轴突排列对齐程度以及胶质细胞的生长;垂直扩散率(radial diffusivity, RD)反映胶质细胞的生长以及髓鞘化程度;各向异性分数(fractional anisotropy, FA)综合反映脑白质结构的完整性,包括轴突排列对齐程度、胶质细胞的生长以及髓鞘化程度等。DUBOIS等[5,7]基于DTI多变量的变化组合将白质发育分为3个阶段:以轴突排列有序化为特征的白质纤维裁剪阶段,表现为AD升高、RD降低、FA升高;以少突胶质细胞的分化与增殖为主要特征的预髓鞘化阶段,表现为AD降低、RD降低、FA不变或升高;以髓鞘厚度增加为特征的髓鞘化阶段,表现为AD不变、RD降低、FA升高。
然而,既往DTI多参量研究多集中于出生后数月乃至数年的婴幼儿人群[5,7-8],对早产与足月新生儿的研究尚不深入。本研究旨在探讨新生儿脑白质DTI各参量变化组合的特点,评价早产儿与足月儿脑白质不同区域的发育状态。
1 资料与方法
1.1 研究对象 本研究获得医院伦理委员会的批准,连续性收集2011年4月至2013年4月于西安交通大学第一附属医院进行颅脑MRI检查的新生儿,在检查前,医师告知监护人检查目的与潜在风险,并由新生儿监护人签署知情同意书。
研究对象的纳入标准包括:新生儿(检查时出生日龄≤28 d);完整的MRI影像资料,包括3维T1加权图像,T2加权图像及DTI数据;完整的新生儿出生指标资料。排除标准包括:局灶性白质损伤;脑出血;弥漫性白质高信号;缺血缺氧性脑病;室管膜下囊变;脑软化灶;其他常规MRI诊断异常。
经过纳入排除标准的筛选,最终入组研究对象共66例(图1):33例早产儿及33例足月儿。
图1 研究对象的纳入排除流程图
Fig.1 Flowchart of the inclusion and exclusion for participants
1.2 数据采集设备及方案 为了减少新生儿头动并顺利完成MRI检查,在进行MRI扫描前30 min,由责任护士遵照主管医师医嘱,给予新生儿口服或灌肠低剂量的100 g/L水合氯醛(25~50 mg/kg),患者的选择、生命体征监护以及后续跟踪观察严格按照指南要求执行[9]。待新生儿入睡后由主管医师和家属护送至MRI室,包裹在襁褓中放在MRI扫描床上,头部两侧用海绵适当固定,外耳道放置防噪声弹性耳塞以减小MRI设备噪声对听力的影响,在MRI扫描过程中,监测新生儿心率和呼吸情况,MRI扫描结束后,主管医师和家属将新生儿护送回新生儿监护室。
使用GE 3.0T MRI系统(Signa HDxt, General Electric Medical System, Milwaukee, WI, USA)进行数据采集,使用8通道头线圈。采用3维快速扰相梯度回波序列采集T1加权图像:重复时间(repetition time, TR) 10.18 ms;回波时间(echo time, TE) 4.62 ms;1 mm×1 mm×1 mm等体素采集;采集视野(field of view, FOV)240 mm×240 mm。采用快速自旋回波序列采集T2加权图像:TR 4 200 ms;TE 118.91 ms;层数20;层厚4 mm;FOV 180 mm×180 mm;采集矩阵320×320。DTI数据采集使用单次激发平面回波序列,主要成像参数为:b值分别为0、1 000 s/mm2;采集扩散敏感梯度磁场方向数为35;TR 5 500 ms;TE 95~105 ms;层数20;层厚4 mm;FOV 180 mm×180 mm;采集矩阵128×128。
1.3 数据处理 使用运动伪影校正方法[10]对DTI数据进行预处理,使用FMRIB software library(FSL)[11]软件中的brain extraction tool(BET)模块进行脑区提取,使用FMRIB’s diffusion toolbox(FDT)模块进行涡流校正、张量估计及参量计算,从而获得FA、AD及RD参量图像。
本研究采用了针对新生儿的优化处理方法[12]进行感兴趣区域提取,流程如图2所示。第一步为选择目标FA图像:使用FSL软件中的线性配准与非线性配准相结合的方法获得所有图像的平均FA图,以此平均FA图像为参照,将个体被试FA图像与平均FA图像逐一配准,变形位移参数是衡量配准过程中图像变形程度的量化指标[13-14],选择变形位移参数最小的FA图像作为目标FA图像;第二步为FA图像标准化:将每个被试的FA图像配准至目标FA图像,继而通过目标FA图像配准至新生儿脑FA模板[15],对所有标准化后的FA图像进行平均,并提取平均FA图像的白质纤维束主干(FA>0.15);第三步为DTI其他参量的标准化:将FA图像标准化过程中产生的图像变换参数应用于其他参量上,从而实现所有DTI参量的标准化。根据新生儿脑白质图谱[15],本研究选取了涵盖投射纤维、连合纤维以及联络纤维的代表性区域(图2B):大脑脚(cerebral peduncle, CP)、内囊后肢(posterior limb of internal capsule, PLIC)、放射冠上部(superior corona radiata, SCR)、胼胝体(corpus callosum, CC)、下额枕束(inferior fronto-occipital fasciculus, IFO)以及外囊(external capsule, EC)。
图2 新生儿脑DTI数据分析流程图
Fig.2 Flow chart of the DTI data analysis on neonatal brain
1.4 白质发育状态的评估方法 DUBOIS等[5,7]对脑白质发育状态的评估方法如图3所示:AD升高、RD降低、FA升高反映轴突排列有序化(图3A);AD降低、RD降低、FA不变或升高反映白质预髓鞘化(图3B);AD不变、RD降低、FA升高反映白质髓鞘化(图3C)。

图3 基于DTI多参量变化组合评价脑白质发育状态的原理示意图[5]
Fig.3 Principle for evaluating the brain white matter developmental states based on co-variations in DTI metrics[5]
1.5 统计学分析 针对不符合正态分布的变量,采用Mann-WhitneyU检验方法比较组间差异,本研究
运用SPSS软件中的Mann-WhitneyU检验方法比较组间胎龄、校正胎龄(校正胎龄=胎龄+MRI检查时日龄)及出生体重的差异,使用χ2检验比较组间性别比例的差异。运用Spearman秩相关分析评价各感兴趣区域内DTI参量与校正胎龄的相关性。参量值的组间比较采用Mann-WhitneyU检验方法,并按照公式“相对变化量=100%×(足月儿参量值―早产儿参量值)/早产儿参量值”,计算DTI各参量的相对变化量。以P<0.05为差异有统计学意义。
2 结 果
2.1 早产儿与足月儿基本信息的组间比较 两组新生儿的胎龄、校正胎龄及出生体重差异有统计学意义,性别比例组间差异无统计学意义(表1)。
2.2 早产儿与足月儿脑白质发育状态的评估 早产儿与足月儿脑白质不同区域DTI参量与校正胎龄的相关性结果如表2所示。基于Dubois的脑白质发育状态的评估方法可见,早产儿的PLIC和CC、足月儿CP和CC处于髓鞘化阶段,表现为AD变化无统计学意义、RD降低、FA升高;而早产儿与足月儿的SCR、IFO以及EC处于预髓鞘化阶段,表现为AD与RD降低、FA升高。在早产儿的CP与足月儿的PLIC等区域DTI参量的变化无统计学意义。
表1 研究对象的人口统计学资料
Tab.1 Demographics of the participants
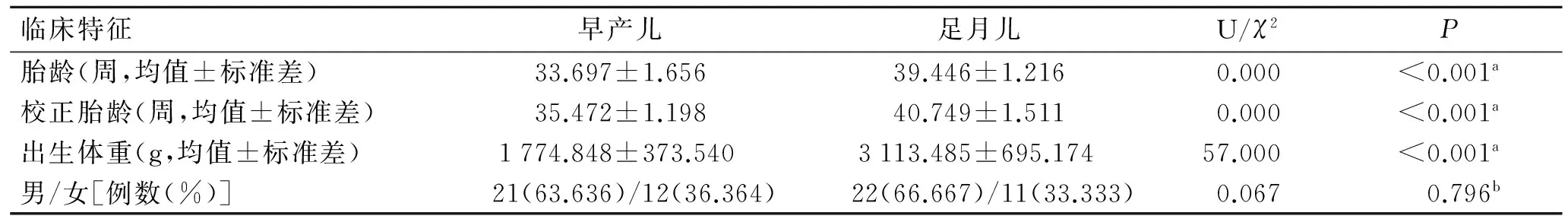
临床特征早产儿足月儿U/χ2P胎龄(周,均值±标准差)33.697±1.65639.446±1.2160.000<0.001a校正胎龄(周,均值±标准差)35.472±1.19840.749±1.5110.000<0.001a出生体重(g,均值±标准差)1774.848±373.5403113.485±695.17457.000<0.001a男/女[例数(%)]21(63.636)/12(36.364)22(66.667)/11(33.333)0.0670.796b
A:胎龄、校正胎龄、出生体重组间比较采用Mann-WhitneyU检验;b:性别比例组间比较采用χ2检验。
表2 早产儿与足月儿脑白质不同区域DTI参量与校正胎龄的相关性分析Tab.2 Correlation between DTI metrics and postmenstrual age in different white matter regions in the preterm and term neonates

感兴趣区域组别AD rs PRD rs PFArs P发育状态CP早产儿0.1880.2950.0900.6170.1770.325─足月儿-0.2030.258-0.3530.0440.3410.049髓鞘化PLIC早产儿-0.0740.683-0.3710.0340.4050.019髓鞘化足月儿-0.0780.665-0.3000.0900.3060.084─SCR早产儿-0.4000.021-0.4570.0070.4690.006预髓鞘化足月儿-0.5630.001-0.696<0.0010.639<0.001预髓鞘化CC早产儿-0.1280.479-0.3660.0360.4380.011髓鞘化足月儿-0.1640.363-0.3970.0220.5450.001髓鞘化IFO早产儿-0.3400.049-0.4090.0180.3530.044预髓鞘化足月儿-0.4820.004-0.5330.0010.3410.049预髓鞘化EC早产儿-0.4070.019-0.4740.0050.3620.038预髓鞘化足月儿-0.5320.001-0.5690.0010.3520.045预髓鞘化
rs:DTI参量与校正胎龄Spearman秩相关系数;─:DTI参量发育变化无统计学意义。
2.3 早产儿与足月儿DTI参量的组间比较 DTI参量组间比较显示(图4),与早产儿相比,足月儿CP区AD变化无统计学意义(相对变化=0.701%,P=0.380),RD降低(相对变化=-2.361%,P<0.05),FA升高(相对变化=7.923%,P<0.05);PLIC、SCR、CC、IFO以及EC等区AD与RD降低(AD相对变化依次为:-5.161%、-9.846%、-2.849%、-8.890%、-9.027%;RD相对变化依次为:-10.369%、-16.026%、-8.112%、-12.372%、-14.210%;P<0.05),FA升高(相对变化依次为:8.348%、24.269%、13.726%、14.548%、22.892%;P<0.05)。

图4 脑白质不同区域早产儿与足月儿DTI参量的比较
Fig.4 Comparison of DTI metrics between the preterm and term neonates in different white matter regions
3 讨 论
新生儿期是脑白质发育的关键时期,既往DTI多参量研究多集中于出生后婴幼儿人群[5,7-8]或使用FA单参量对新生儿展开研究[12,16],本研究通过观察DTI多参量的变化组合发现,新生儿不同脑白质区域所处的发育状态不同,早产儿与足月儿之间也存在差异。
DTI不同参量的发育变化特点各异,多参量的变化组合类型有助于鉴别不同的发育状态[5]。本研究中DTI参量的发育变化特点与以往研究[5,8,16]相一致,新生儿FA在发育过程中升高[16];同时,自出生至生后2岁阶段,FA持续升高,AD与RD持续降低,但RD相对变化的幅度大于AD[8]。与既往新生儿研究结果[16]不同的是,本研究增加了对AD和RD的观测,同时比较了早产与足月新生儿的脑白质发育状态。AD与RD可反映平行和垂直于轴突方向上白质结构属性的发育变化,对判断发育状态至关重要[5,7-8]。本研究结果显示,新生儿脑白质发育过程中,AD、RD和FA的变化组合存在2种类型:AD降低、RD降低、FA升高;AD不变、RD降低、FA升高。根据DTI多变量协同变化与白质发育的关系[5]可推断:新生儿脑白质发育存在预髓鞘化和髓鞘化2种状态。本研究未观察到轴突排列有序化所伴随的DTI参量的变化特征,这与观测对象所处的发育时期有密切关系,轴突排列有序化主要发生在胎儿期[17],新生儿期脑深部白质轴突排列的整齐程度已经达到较高水平[5]。
本研究中脑白质不同区域发育状态的差异反映了髓鞘化的时空顺序[7],总体而言,脑白质髓鞘化的顺序为自下而上,从后向前,投射纤维早于连合纤维和联络纤维[8]。本研究结果与脑白质不同区域发育的时序规律相一致[7]:PLIC是端脑最早开始髓鞘化的区域,自孕晚期即开始髓鞘化,本研究中早产儿内囊后肢处于髓鞘化状态(表2),足月儿该区域已经达到较高髓鞘化水平(图4),投射纤维中CP和SCR髓鞘化相对较晚,CP在足月新生儿期才开始髓鞘化,而SCR在早产与足月新生儿期均处于预髓鞘化状态。以往研究表明CC区域在出生时已经有部分区域可观察到髓鞘化的结构[18],这与本研究在早产儿和足月儿均观察到CC髓鞘化状态相一致;早产儿与足月儿IFO和EC均处于预髓鞘化状态,可见,联络纤维在各类纤维中髓鞘化最晚。既往研究表明,EC在出生后10月时才开始髓鞘化,甚至部分联络纤维在成年人阶段才最终完成髓鞘化[7]。
本研究发现,在新生儿期早产儿PLIC和CP所处的发育状态与足月儿不同,针对处于相同发育状态的SCR、CC、IFO和EC等区域,DTI参量值存在差异。一方面,反映了早产儿胎龄较小,发育存在一定的时序[5];另一方面,即使校正到足月时期,早产儿与足月儿的脑白质结构属性依然存在差异[19],甚至在儿童、青少年人群中这种差异仍然存在[20],表明早产因素对脑白质发育存在影响。而脑白质的结构完整性与后期的神经行为能力密切相关[4],对早产儿采取早期干预措施或将有助于改善发育结局。
本研究尚存在一些不足之处,仅是一项断面研究,发育规律仍需要进一步通过纵向数据加以验证。DTI成像技术的局限性导致本研究无法刻画更加精细的发育进程,未来工作需运用新的技术手段(比如扩散峰度成像、多室模型[21])细化研究脑白质的发育规律。尽管本研究采用了全自动化的数据分析方法,克服手动分析存在的主观偏移,但是研究对象胎龄仍存较大跨度,使用同一个新生儿脑模板可能会影响图像配准的精度,下一步将对不同胎龄段分别建立脑模板,有望克服该不足。
综上所述,基于脑白质DTI多参量的变化和Dubois的方法可以评估新生儿脑白质发育状态,其符合髓鞘化和预髓鞘化阶段DTI参量变化特点,且不同脑白质区域存在着差异,早产儿较足月儿的脑白质发育落后。
[1] BALDOLI C, SCOLA E, DELLA ROSA PA, et al. Maturation of preterm newborn brains: A fMRI-DTI study of auditory processing of linguistic stimuli and white matter development[J]. Brain Struct Funct, 2015, 220(6):3733-3751.
[2] CAI Y, WU X, SU Z, et al. Functional thalamocortical connectivity development and alterations in preterm infants during the neonatal period[J]. Neuroscience, 2017, 356:22-34.
[3] SUZUKI K. Neuropathology of developmental abnormalities[J]. Brain Dev, 2007, 29(3): 129-141.
[4] VAN KOOIJ BJ, DE VRIES LS, BALL G, et al. Neonatal tract-based spatial statistics findings and outcome in preterm infants[J]. Am J Neuroradiol, 2012, 33(1):188-194.
[5] DUBOIS J, DEHAENE-LAMBERTZ G, KULIKOVA S, et al. The early development of brain white matter: A review of imaging studies in fetuses, newborns and infants[J]. Neuroscience, 2014, 276(6):48-71.
[6] QIU A, MORI S, MILLER MI. Diffusion tensor imaging for understanding brain development in early life[J]. Annu Rev Psychol, 2015, 66(1):853-876.
[7] DUBOIS J, DEHAENE-LAMBERTZ G, PERRIN M, et al. Asynchrony of the early maturation of white matter bundles in healthy infants: Quantitative landmarks revealed noninvasively by diffusion tensor imaging[J]. Hum Brain Mapp, 2008, 29(1):14-27.
[8] GENG X, GOUTTARD S, SHARMA A, et al. Quantitative tract-based white matter development from birth to age 2 years[J]. Neuroimage, 2012, 61(3):542-557.
[9] COTÉ CJ, WILSON S, PEDIATRICS AA, et al. Guidelines for monitoring and management of pediatric patients during and after sedation for diagnostic and therapeutic procedures: An update[J]. Pediatrics, 2006, 118(6):2587-2602.
[10] LI X, YANG J, GAO J, et al. A robust post-processing workflow for datasets with motion artifacts in diffusion kurtosis imaging[J]. PLoS One, 2014, 9(4):e94592.
[11] SMITH SM, JENKINSON M, WOOLRICH MW, et al. Advances in functional and structural MR image analysis and implementation as FSL[J]. Neuroimage, 2004, 23(Suppl 1): S208-S219.
[12] LI X, GAO J, WANG M, et al. Rapid and reliable tract-based spatial statistics pipeline for diffusion tensor imaging in the neonatal brain: Applications to the white matter development and lesions[J]. Magn Reson Imaging, 2016, 34(9):1314-1321.
[13] SMITH SM, JENKINSON M, JOHANSEN-BERG H, et al. Tract-based spatial statistics: Voxelwise analysis of multi-subject diffusion data[J]. Neuroimage, 2006, 31(4): 1487-1505.
[14] BALL G, COUNSELL SJ, ANJARI M, et al. An optimised tract-based spatial statistics protocol for neonates: Applications to prematurity and chronic lung disease[J]. Neuroimage, 2010, 53(1):94-102.
[15] OISHI K, MORI S, DONOHUE PK, et al. Multi-contrast human neonatal brain atlas: Application to normal neonate development analysis[J]. Neuroimage, 2011, 56(1):8-20.
[16] 刘岭岭, 孛茹婷, 杨文君, 等. 磁共振弥散张量成像技术在新生儿脑白质发育中的研究 [J]. 磁共振成像, 2015, 6(4): 253-257.
[17] ZANIN E, RANJEVA JP, CONFORT-GOUNY S, et al. White matter maturation of normal human fetal brain. Aninvivodiffusion tensor tractography study[J]. Brain Behavior, 2011, 1(2):95-108.
[18] KUNZ N, ZHANG H, VASUNG L, et al. Assessing white matter microstructure of the newborn with multi-shell diffusion MRI and biophysical compartment models[J]. Neuroimage, 2014, 96(8):288-299.
[19] ROSE SE, HATZIGEORGIOU X, STRUDWICK MW, et al. Altered white matter diffusion anisotropy in normal and preterm infants at term-equivalent age[J]. Magn Reson Med, 2008, 60(4):761-767.
[20] EIKENES L, LØHAUGEN GC, BRUBAKK AM, et al. Young adults born preterm with very low birth weight demonstrate widespread white matter alterations on brain DTI[J]. Neuroimage, 2011, 54(3):1774-1785.
[21] JELESCU IO, VERAART J, ADISETIYO V, et al. One diffusion acquisition and different white matter models: How does microstructure change in human early development based on WMTI and NODDI?[J]. Neuroimage, 2015, 107(1):242-256.
