脑瘫儿童深部灰质损伤MRI分级系统的临床价值比较
2018-02-27王苗苗王小玗赵慧芳蒋昊翔刘聪聪李贤军孙亲利马敬伟
刘 衡,王苗苗,王小玗,赵慧芳,吴 亮,蒋昊翔,刘聪聪, 李贤军,金 超,孙亲利,马敬伟,王 辉,杨 健
(1. 西安交通大学第一附属医院影像科,陕西西安 710061;2. 西安交通大学生物医学信息工程教育部 重点实验室,生命科学与技术学院,生物医学工程系,陕西西安 710049;3. 西安中医脑病医院 脑病科,陕西西安 710032;4. 陕西省康复医院影像科,陕西西安 710049)
脑瘫(cerebral palsy, CP)儿童中约70%~90%的颅脑磁共振成像(magnetic resonance imaging, MRI)表现异常[1]。其中,深部灰质损伤(deep gray matter injury, DGMI)约占12.8%~36.3%[2],根据病因又可分为新生儿缺血缺氧性脑病(hypoxic ischemic encephalopathy, HIE)型和核黄疸型[3],前者主要累及基底节、丘脑及内囊后肢[4],后者主要损伤苍白球中后部[5]。其中,基底节、丘脑在儿童运动和姿势控制中占有重要作用,围产期急性缺氧缺血导致其损伤是新生儿死亡和脑瘫的重要原因[6]。因此,HIE型DGMI患儿临床结局不容乐观。然而,部分研究亦发现DGMI患儿运动损伤轻重不一[4,6-8]。
MRI被认为是最佳的在体研究HIE型DGMI的影像学方法[1]。欧洲小儿脑瘫监测组织培训指南[9]和KRAGELOH等[8],基于MRI横断位、斜冠状位T2WI图像,根据基底节、丘脑、中央区皮层/皮层下以及海马的改变将DGMI分为3级,CHOI等[7]将其分为4级。目前,国内外尚缺乏针对以上2种DGMI分级方法的一致性检验。本文拟通过Kappa检验评价2种MRI分级系统的一致性,以探寻一种较好的方法用于HIE型DGMI临床工作和系列研究。
此外,目前临床上主要采用粗大运动功能分级系统(gross motor function classification system, GMFCS)和手功能分级系统(manual ability classification system, MACS)评价CP儿童运动功能、手功能障碍[10-11]。但对于DGMI的CP儿童,MRI所显示的DGMI程度与CP儿童运动功能、手功能障碍的关系尚不明确,国内尚缺乏针对以上2种MRI分级系统与GMFCS、MACS的关系研究。因此,本文拟通过相关分析探讨CP儿童深部灰质损伤与运动、手功能障碍的相关性。
1 资料与方法
1.1 研究对象 回顾性分析2016年3月1日-2017年6月24日,经西安交通大学第一附属医院影像科颅脑MRI检查,表现为HIE型深部灰质(基底节、丘脑)损伤的CP患儿。
纳入标准:①符合脑瘫诊断标准[1];②颅脑MRI表现为深部灰质损伤(主要累及基底节、丘脑及内囊后肢[4]);③新生儿缺血缺氧性脑病史。同时满足以上3条者纳入分析。本研究为回顾性研究,已获得医院伦理委员会的批准,并免除签署知情同意书。
1.2 MR检查方法 MR扫描采用美国GE公司Signa HDxt 3.0 T MR扫描仪和8通道头颅相控阵线圈。年龄较小不能配合的患儿,均给予100 g/L水合氯醛(0.5 mL/kg,最大剂量10 mL)口服或灌肠,待入睡后进行MR检查。患儿在检查床包裹严实避免受凉,置于扫描床后,外耳道用耳塞堵塞,并在头部两侧用海绵固定,减少扫描过程中噪音对患儿的影响,同时减少运动伪影。
扫描序列及参数:轴位3D-FSPGR T1WI TR 10 ms,TE 4.6 ms,层厚1 mm,无间隔扫描,FOV 180 mm×180 mm,矩阵256×256;轴位FSE T2WI TR 4 200 ms,TE 120 ms,层厚4.0 mm,层间隔1.0 mm;轴位T2-FLAIR TR 4 200 ms,TE 120 ms,层厚4.0 mm,层间隔1.0 mm;斜冠状位FSE T2WI(即海马短轴面)层厚5.0 mm,间隔1.5 mm;轴位扫描平行于前-后联合线(AC-PC线)。
1.3 CP儿童DGMI不同分级系统评价 不同工作经历的2名影像科医师(A:副主任医师,10年影像诊断工作经历,现从事3年儿童神经影像专业研究与工作;B:住院医师,3年影像诊断工作经历),基于不同分级系统(三分级[8-9],四分级[7])分别评价14例DGMI的CP儿童颅脑MRI图像。评价中,不提供受试者年龄、性别、症状等相关临床信息。此外,当DGMI的改变符合2种不同级别的判断标准时,以高级别为准。每名影像科医师将14例颅脑MRI图像根据2种 不同的MRI分级方法(表1、表2,图1、图2)评价。
表1 脑瘫儿童深部灰质损伤MRI三分级标准[8-9]
Tab.1 Three classification criteria for deep gray matter injury in children with cerebral palsy[8-9]

分级MRI-T2WI描述Ⅰ级单侧或双侧基底节或丘脑病变Ⅱ级Ⅰ+中央区皮层及皮层下病变Ⅲ级Ⅱ+海马病变
表2 脑瘫儿童深部灰质损伤MRI四分级标准[7]
Tab.2 Four classification criteria for deep gray matter injury in children with cerebral palsy[7]

分级MRI-T2WI描述Ⅰ级单侧豆状核后外侧,伴或不伴内囊病变Ⅱ级双侧豆状核后外侧、丘脑腹外侧核高信号Ⅲ级Ⅱ+中央区皮层及皮层下病变Ⅳ级Ⅲ+海马病变
1.4 临床分级 本研究采用中文版GMFCS和MACS,在MRI检查前后1周内,由2名儿童康复科评估师对患儿粗大运动功能、手功能进行评估。其中,GMFCS是临床常用的评估CP患儿粗大运动功能的可靠、有效方法,Ⅰ、Ⅱ级为轻度运动功能障碍,Ⅲ、Ⅳ级为中、重度运动功能障碍[8];MACS被推荐用于4~18岁 CP患儿上肢功能的评价,研究表明MACS亦可应用于2~5岁的CP儿童[11-12]。
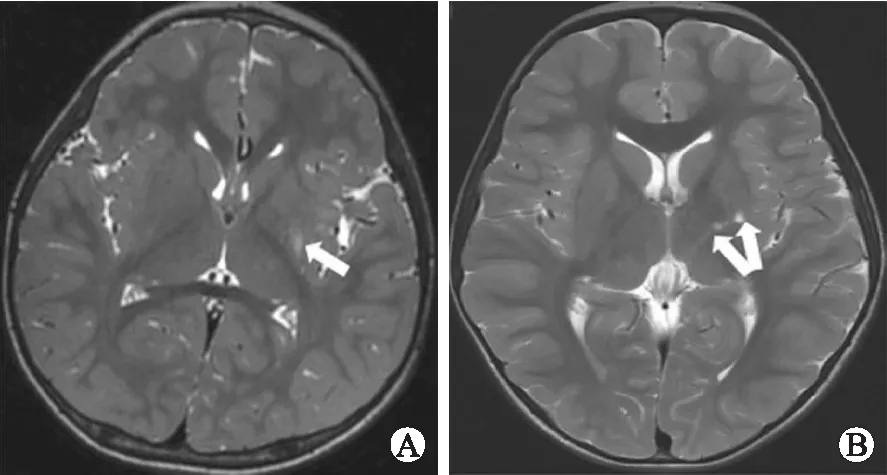
图1 脑瘫儿童深部灰质损伤Ⅰ级(T2加权图像)
Fig.1 Grade I pattern on axial T2-weighted images
A:左侧豆状核后外侧斑片状长T2信号(白箭),1/3级或1/4级;B:左侧豆状核后外侧片状长T2信号,伴内囊小片状长T2信号(白箭),1/3级或1/4级。

图2 脑瘫儿童深部灰质损伤(Ⅱ~Ⅳ级)
Fig.2 Grade Ⅱ-Ⅳ pattern on axial MRI images
A:双侧丘脑腹外侧核、双侧豆状核后外侧斑片状长T2信号(白箭),1/3级或2/4级;B:双侧半卵圆中心、中央区皮层条片状长T2信号(白箭),2/3级或3/4级;C:双侧海马体积缩小(白箭),3/3级或4/4级。
1.5 统计学分析 采用SPSS 19.0统计分析软件,正态分布连续变量采用均数±标准差表示,病例数采用人数/(百分比),P<0.05为差异有统计学意义。2名阅片者基于不同的分级系统,根据分级标准评价CP儿童DGMI,采用Kappa检验,分别计算不同分级系统的组内及组间一致性。评价水准[13]:Kappa<0,一致性极差;0.00~0.20,微弱;0.21~0.40,弱;0.41~0.60,中度;0.61~0.80,显著一致;>0.81,一致性极佳。两种MRI分级系统与GMFCS/MACS相关性采用Spearman相关分析,进一步对MRI四分级法与GMFCS/MACS的相关性分析采用偏相关分析。
2 结 果
2.1 脑瘫患儿纳入分析流程图 见图3、表3,14例DGMI的CP儿童,根据MRI三分级法,Ⅰ~Ⅲ级分别有8例、4例、2例;根据MRI四分级法,Ⅰ~Ⅳ级分别有4例、4例、4例、2例。本组患儿GMFCS和MACS分级情况见表4;两种MRI分级方法的组内和组间一致性见表5。

图3 缺血缺氧型深部灰质损伤脑瘫患儿流程图
Fig.3 Flow chart of DGMI children with cerebral palsy
表3 脑瘫儿童的临床信息
Tab.3 Clinical information of children with cerebral palsy

一般资料统计量性别(%) 男9(64.3) 女5(35.7)MRI检查时年龄(月)55.2±16.8(36.3~99.4)胎龄(周)38.9±1.8(35~41)早产(<37周)2(14.3)足月(≥37周)12(85.7)脑瘫类型 痉挛型四肢瘫2(14.3) 痉挛型双瘫1(7.1) 痉挛型偏瘫4(28.6) 不随意运动型3(21.4) 混合型4(28.6)
数字表示方式为例数(百分比)或均数±标准差(最小值-最大值)。
2.2 MRI三分级法与GMFCS、MACS的相关性分析 MRI三分级法与GMFCS分级无相关(r=0.053,P>0.05),与MACS分级亦无相关(r=0.128,P>0.05)。
2.3 MRI四分级法与GMFCS的相关性分析 MRI四分级法与GMFCS呈正相关,相关系数r=0.605,P=0.02(表6)。使用偏相关分析(调整年龄、体质量、性别),MRI与GMFCS的相关系数r=0.743,P=0.009。
2.4 MRI四分级法与MACS的相关性分析 MRI四分级法与MACS呈正相关,相关系数r=0.779,P=0.001(表7)。使用偏相关分析(调整年龄、体质量、性别),MRI与MACS的相关系数r=0.810,P=0.003。
表4 脑瘫儿童GMFCS、MACS分级
Tab.4 GMFCS and MACS of children with cerebral palsy [(n, %)]

表5 2种MRI分级方法的组内和组间一致性评价
Tab.5 The reliability of two grading systems of intra-observer and inter-observer

分级系统Kappa值组内一致性组间一致性三分级法0.873*0.873*四分级法0.901*0.611*
*P<0.001。
表6 MRI四分级法与GMFCS的相关性
Tab.6 Correlation between four-grading system of MRI and GMFCS

GMFCSMRI分级[n(%)]Ⅰ(n=13)Ⅱ(n=1)Ⅲ(n=6)Ⅳ(n=4)r值P值Ⅰ3(75.0)-1(25.0) -Ⅱ--3(100.0) -Ⅲ--2(66.7)1(33.3)0.605*0.02Ⅳ-1(33.3) -2(66.7)Ⅴ-- -1(100.0)
注:“-”代表无,*P<0.05。
表7 MRI四分级法与MACS的相关性
Tab.7 Correlation between four-grading system of MRI and MACS

MACSMRI分级[n(%)]Ⅰ(n=13)Ⅱ(n=1)Ⅲ(n=7)Ⅳ(n=3)r值P值Ⅰ3(100.0)- - -Ⅱ--5(100.0) -Ⅲ-1(33.3)1(33.3)1(33.3)0.779*0.001Ⅳ--1(50.0)1(50.0)Ⅴ-- -1(100.0)
注:“-”代表无,*P<0.05。
3 讨 论
MRI是早期评估脑损伤位置及程度的最佳方式。因此,建议尽早对CP患儿行MRI检查,以确定脑部病变并获得对临床结局的预测。研究表明,新生儿颅脑MRI对于白质损伤CP儿童临床结局预测价值较高,但对灰质损伤CP儿童预测价值较低[14]。因此,对于DGMI的CP儿童,应再次进行MRI检查以评估其预后。目前,对于CP儿童DGMI的MRI评价主要采用三分级法和四分级法,但对以上2种分级方法的一致性检验尚缺乏[3-7]。此外,对于DGMI的CP儿童,目前主要采用GMFCS、MACS评价其运动和手功能[10-11],但国内尚缺乏针对以上2种MRI分级方法与GMFCS、MACS的关系研究。本研究纳入3岁以上DGMI的HIE型CP儿童颅脑MRI图像,根据文献[6-8]对其分级,并比较不同分级对临床结局的预测价值。
DGMI的CP患儿多为足月儿,其与缺氧缺血性脑病儿童颅脑MRI表现类似,主要累及基底节、丘脑腹外侧核[8]。早产儿大部分的丘脑信号异常是继发性损伤,而不是直接损伤[15]。较重的脑室周围白质软化可累计丘脑,但主要损伤丘脑枕部[16]。本组病例足月儿12例,早产儿2例。本研究显示,2种分级方法组内、组间一致性均较好,四分级法与GMFCS、MACS呈正相关,三分级法与后两者均无相关。四分级法将豆状核、丘脑分开评价,结果表明豆状核与丘脑损伤对CP儿童粗大运动功能、手功能均有影响,且影响程度不同,其中基底节病变多位于豆状核(壳核、苍白球)后外侧,丘脑损伤多位于腹外侧核。以往研究亦表明,HIE病史的CP儿童深部灰质损伤程度与粗大运动功能相关,其中苍白球损伤与粗大运动功能密切相关,且独立于其它损伤脑区[17-18]。因此,儿童时期MRI检查能有效评估DGMI的CP儿童的粗大运动功能。
在DGMI的CP患儿中,双侧DGMI不伴锥体束损伤,通常引起锥体外束异常,临床表现为不随意运动型CP[19]。REID等[17]研究显示,壳核、苍白球损伤多见于混合型或不随意运动型CP,尤其是皮层-皮层下病变不广泛者。本组病例,痉挛型CP 7例,混合型4例,不随意运动型3例。广泛皮层-皮层下病变和白质丢失的CP患儿,临床常伴有癫痫,尤其是海马、颞叶萎缩患儿。这与缺血缺氧性脑病患儿海马病变与癫痫有关一致,且癫痫发生的可能性与皮层损伤严重程度有关[20-21]。
本研究为回顾性试验,病例数较少,且部分患儿失访导致其临床信息不全,患儿年龄跨度亦较大,较小儿童的功能分类可能随着年龄变化而变化,特别是GMFCS、MACS在Ⅱ~Ⅳ级的患儿。因此,在以后的研究中应扩大样本量、比较同一年龄段的患儿。同时,CP儿童DGMI的MRI表现多样,不同研究制定的MRI评估方法存在差异。比如:部分研究仅纳入双侧深部灰质损伤患儿[6,20],部分研究还纳入矢状旁分水岭区或白质部位损伤患儿[17,22]。为了更好地理解深部灰质损伤脑瘫儿童的脑结构与功能的关系,应采用统一的评估DGMI的MRI方法。
综上所述,本研究表明MRI四分级法是一个可重复的、一致性较高的评价CP儿童HIE型DGMI的方法;同时显示MRI四分级法与GMFCS、MACS密切相关,可用于初步判断粗大运动功能、手功能损伤程度。
[1] GRAHAM HK, ROSENBAUM P, PANETH N, et al. Cerebral palsy[J].Nat Rev Dis Primers, 2016, 2:15082.
[2] REID SM, DAGIA CD, DITCHFIELD MR, et al. An Australian population study of factors associated with MRI patterns in cerebral palsy[J]. Dev Med Child Neurol, 2014, 56(2):178-184.
[3] JR HA.Neuroimaging in cerebral palsy: Patterns of brain dysgenesis and injury[J]. J Child Neurol, 2005, 20(12):936-939.
[4] RUTHERFORD M, MALAMATENIOU C, MCGUINNESS A, et al. Magnetic resonance imaging in hypoxic-ischaemic encephalopathy[J]. Early Hum Dev, 2010, 86(6):351-360.
[5] MANCHANDA S, PRASAD A, BARUAH BP. MRI findings in kernicterus[J]. Indian J Pediatr, 2013, 80(2):181-182.
[6] MARTINEZ BM, DIEZ SJ, KAPELLOU O, et al. Predicting motor outcome and death in term hypoxic-ischemic encephalopathy[J]. Neurology, 2011, 76(24):2055-2061.
[7] CHOI JY, CHOI YS, RHA DW, et al. The clinical outcomes of deep gray matter injury in children with cerebral palsy in relation with brain magnetic resonance imaging[J].Res Dev Disabil, 2016, 55:218-225.
[8] KRAGELOH MI, HELBER A, MADER I, et al. Bilateral lesions of thalamus and basal ganglia: Origin and outcome[J]. Dev Med Child Neurol, 2002, 44(7):477-484.
[9] HIMMELMANN K, HORBER V, DE LCJ, et al. MRI classification system (MRICS) for children with cerebral palsy:Development, reliability, and recommendations[J]. Dev Med Child Neurol, 2017, 59(1):57-64.
[10] 李初阳,史惟,周美琴,等. 脑瘫粗大运动功能分级系统修订扩展版(中文版)的信度和效度研究[J]. 中国康复理论与实践,2011, 17(12):1112-1115.
[11] 史惟,李惠,苏怡,等. 中文版脑瘫患儿手功能分级系统的信度和效度研究[J]. 中国循证儿科杂志, 2009, 4(3):263-269.
[12] PLASSCHAERT VF, KETELAAR M, NIJNUIS MG, et al. Classification of manual abilities in children with cerebral palsy under 5 years of age: How reliable is the Manual Ability Classification System?[J]. Clin Rehabil, 2009, 23(2):164-170.
[13] LANDIS JR, KOCH GG. The measurement of observer agreement for categorical data[J]. Biometrics, 1977, 33(1):159-174.
[14] WOODWARD LJ, ANDERSON PJ, AUSTIN NC, et al. Neonatal MRI to predict neurodevelopmental outcomes in preterm infants[J].N Engl J Med, 2006, 355(7):685-694.
[15] KRAGELOH MI, TOFT P, LUNDING J, et al. Brain lesions in preterms: Origin, consequences and compensation[J]. Acta Paediatr, 1999, 88(8):897-908.
[16] YOKOCHI K. Thalamic lesions revealed by MR associated with periventricular leukomalacia and clinical profiles of subjects[J]. Acta Paediatr, 1997, 86(5):493-96.
[17] REID SM, DAGIA CD, DITCHFIELD MR, et al. Grey matter injury patterns in cerebral palsy: Associations between structural involvement on MRI and clinical outcomes[J]. Dev Med Child Neurol, 2015, 57(12):1159-1167.
[18] KRAGELOH MI, HELBER A, MADER I, et al. Bilateral lesions of thalamus and basal ganglia: Origin and outcome[J]. Dev Med Child Neurol, 2002, 44(7):477-484.
[19] OKEREAFOR A, ALLSOP J, COUNSELL SJ, et al. Patterns of brain injury in neonates exposed to perinatal sentinel events[J]. Pediatrics, 2008, 121(5):906-914.
[20] MARTINEZ BM, DIEZ SJ, RUTHERFORD MA, et al. Outcomes after central grey matter injury in term perinatal hypoxic-ischaemic encephalopathy[J]. Early Hum Dev, 2010, 86(11):675-682.
[21] WILLIAMS PA, DOU P, DUDEK FE. Epilepsy and synaptic reorganization in a perinatal rat model of hypoxia-ischemia[J]. Epilepsia, 2004, 459(10):1210-1218.
[22] TWOMEY E, TWOMEY A, RYAN S, et al. MR imaging of term infants with hypoxic-ischaemic encephalopathy as a predictor of neurodevelopmental outcome and late MRI appearances[J]. Pediatr Radiol, 2010, 40(9):1526.
