过表达THBS2对宫颈鳞癌SiHa细胞生物学特性的影响
2018-02-22董婷婷戴盛康龙颖伍光腾冯一鸣徐勋卢艳姚德生
董婷婷 戴盛康 龙颖 伍光腾 冯一鸣 徐勋 卢艳 姚德生
宫颈癌是女性常见的恶性肿瘤之一,与人乳头状瘤病毒持续感染关系密切[1]。宫颈癌的治疗主要以手术、放疗和化疗为主,但晚期和复发患者疗效不理想[2],分子靶向治疗为其提供了新的线索。血小板反应蛋白 2(thrombospondin-2,THBS2)是 THBS 蛋白家族中的一员,广泛存在于上皮来源组织的细胞外基质糖蛋白,对细胞黏附能力、增殖以及凋亡等有调节作用[3]。研究发现THBS2在胃癌、前列腺癌和宫颈癌组织中呈低表达,且可影响患者预后[4-6]。然而THBS2调节宫颈癌细胞生物学功能的相关机制尚不明确,本课题组前期研究发现宫颈鳞癌组织中mir-1246呈异常表达,且证实THBS2为mir-1246的靶基因[7]。本研究通过在宫颈鳞癌SiHa细胞中过表达THBS2,观察其对SiHa细胞增殖、凋亡、侵袭、迁移等生物学特性的影响,同时建立裸鼠模型,观察其体外成瘤能力,以探讨THBS2在宫颈鳞癌发生发展中的作用,为其治疗提供新的依据。
1 材料与方法
1.1 主要材料与仪器
宫颈鳞癌SiHa细胞株购自上海吉凯基因公司,用含10%胎牛血清及10 IU/mL青霉素-链霉素的DMEM培养基,在37℃、5%CO2条件下培养,取对数生长期细胞进行实验。DMEM培养基购自美国gibco公司,THBS2过表达慢病毒转染试剂购自上海吉凯基因公司,cDNA反转录试剂盒购自日本TaKaRa公司,THBS2抗体购自美国Santa Cruz公司,内参GAPDH抗体购自美国Cell Signaling Technology公司,IX51型荧光显微镜购自日本Olympus公司。
1.2 细胞转染与分组
将宫颈鳞癌SiHa细胞接种于6孔板中,根据上海吉凯基因公司提供的慢病毒转染说明书进行,实验分为3组:THBS2-LV组(转染THBS2过表达慢病毒的宫颈鳞癌SiHa细胞)、NC组(转染空载病毒的宫颈鳞癌SiHa细胞)、空白对照组(正常培养的宫颈鳞癌SiHa细胞)。转染慢病毒72 h后,在实时荧光显微镜下初步观察转染效率,待细胞密度达80%左右转移至25 cm2培养瓶继续培养。
1.3 RT-qPCR检测宫颈鳞癌SiHa细胞THBS2 mRNA的表达
取转染后并经嘌呤霉素筛选的THBS2-LV组、NC组以及空白对照组宫颈鳞癌SiHa细胞,采用吸附柱法提取总RNA。按cDNA反转录试剂盒说明书进行操作,将RNA反转录为cDNA,以此为模板进行扩增。THBS2序列:上游引物为5'-AGCTGGTTCAGACAGCCAACTC-3',下游引物为5'-CATAGTCGTCGTCCCGGTCA-3';内参GAPDH序列:上游引物为5'-GAAGGTGAAGGTCGGAGTC-3',下游引物为5'-GAAGATGGTGATGGGATTTC-3'。反应总体积为 20 μl,其中 cDNA 模板 2 μL、上下游引物分别为 0.8 μL、SYBR混合物10 μL、无菌蒸馏水6.4 μL。反应条件:预变性95 ℃ 30 s;PCR 反应 95 ℃ 5 s、60 ℃ 30 s,共 40个循环;溶解分析95℃ 15 s、60℃ 60 s、95℃ 15 s。反应结束后采用2-△△Ct法计算THBS2的相对表达量,实验重复3次。
1.4 Western blot检测宫颈鳞癌SiHa细胞THBS2的表达
取转染后并经嘌呤霉素筛选的THBS2-LV组、NC组以及空白对照组宫颈鳞癌SiHa细胞,将细胞从培养瓶转移至1.5 mL EP管中,1 000 r/min离心5 min,弃上清液,在细胞沉淀中加入RIPA蛋白裂解液和PMSF蛋白酶抑制剂混合液于冰上裂解30 min,以12 000 r/min离心10 min。在THBS2-LV组、NC组和空白对照组细胞蛋白样品中添加上样缓冲液,100℃变性5 min。每个凝胶泳道以50 μL蛋白样品上样,以湿转法将蛋白转移至PVDF膜,将膜置于5%的脱脂奶粉中封闭2 h,加入对应一抗鼠抗THBS2抗体(体积稀释比例为1∶100)和鼠抗GAPDH抗体(体积稀释比例为1∶1 000)在4℃下孵育过夜。加入二抗兔抗鼠(体积稀释比例为1∶1 000)孵育1 h,ECL化学发光显色,并用凝胶成像仪观察分析,实验重复3次。
1.5 CCK-8法检测宫颈鳞癌SiHa细胞增殖能力
取转染后并经嘌呤霉素筛选的THBS2-LV组、NC组以及空白对照组宫颈鳞癌SiHa细胞,以密度为5 000个/孔取100 μL加入96孔板中,分别培养24 h、48 h、72 h,检测前每孔加入 10 μL CCK-8 工作液,于37℃培养箱中孵育1 h,然后采用酶联免疫检测仪检测吸光度值(OD值),记录结果,绘制细胞生长曲线;实验重复3次。
1.6 流式细胞术检测宫颈鳞癌SiHa细胞凋亡能力
取转染后并经嘌呤霉素筛选的THBS2-LV组、NC组以及空白对照组宫颈鳞癌SiHa细胞,用0.25%不含EDTA的胰酶消化,1 000 r/min离心5 min,用PBS重悬离心2次,离心后用100 μL 1×Binding Buffer制成细胞悬液,先后加入5 μL APC AnnexinⅤ和5μL7-ADD染液,常温孵育15 min后置于冰上,1 h内用流式细胞仪检测细胞凋亡率,实验重复3次。
1.7 细胞划痕实验检测宫颈鳞癌SiHa细胞迁移能力
取转染后并经嘌呤霉素筛选的THBS2-LV组、NC组以及空白对照组宫颈鳞癌SiHa细胞,接种于6孔板内,待细胞长满后,用已灭菌消毒的200 μL枪头在细胞底部划痕,分别于0 h、24 h、48 h在显微镜下拍照,观察细胞迁移及愈合能力,实验重复3次。
1.8 Transwell实验检测宫颈鳞癌SiHa细胞侵袭能力
取转染后并经嘌呤霉素筛选的THBS2-LV组、NC组以及空白对照组宫颈鳞癌SiHa细胞,用无血清的DMEM培养液重悬细胞,使细胞终密度为5×105个/mL。取出于4℃溶解好的Matrigel胶,用DMEM培养基按1∶8稀释,取80 μL混合液加入Transwell小室上室底部,置于37℃培养箱待Matrigel胶凝固后取出,将100 μL细胞悬液加入Transwell小室上室,下室为含20%胎牛血清的DMEM培养基,放入恒温培养箱24 h,4%多聚甲醛固定30 min,革兰液染色10 min,晾干。光学显微镜下观察并计算穿模细胞数,实验重复3次。
1.9 裸鼠成瘤实验
选取4~5周龄雌性胸腺免疫缺陷SPF级15只裸鼠,体重14~17g,购于广西医科大学实验动物中心,本实验符合动物伦理学规定。取转染后并经嘌呤霉素筛选的THBS2-LV组、NC组以及空白对照组宫颈鳞癌SiHa细胞,扩大培养,于对数生长期收集细胞,用PBS重悬。15只裸鼠分为3组,每组5只,分别接种THBS2-LV组、NC组以及空白对照组宫颈鳞癌SiHa细胞,每只裸鼠接种量为1×107个细胞200 μL,注射于裸鼠腹股沟上脊柱旁皮下。于注射后7 d裸鼠皮下可触摸到结节,每3 d用游标卡尺测量瘤体长径(L)和短径(W),按照公式V(mm3)=(L×W2)/2 计算瘤体体积,并绘制曲线,于注射后第3周处死裸鼠,分离皮下瘤体,绘制瘤体生长曲线,实验重复3次。
1.10 统计学分析
采用统计学软件SPSS 17.0分析数据,计量数据以均数±标准差(±s)表示,两组比较采用独立样本t检验,多组间比较采用单因素方差分析,若组间差异有统计学意义,进一步的两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 荧光显微镜下观察细胞转染效率
转染慢病毒72 h后,在荧光显微镜下观察THBS2-LV组和NC组宫颈鳞癌SiHa细胞转染效率,可见两组表达绿色荧光蛋白的细胞占比均大于80%,可初步判定慢病毒成功转染宫颈鳞癌SiHa细胞,见图1。
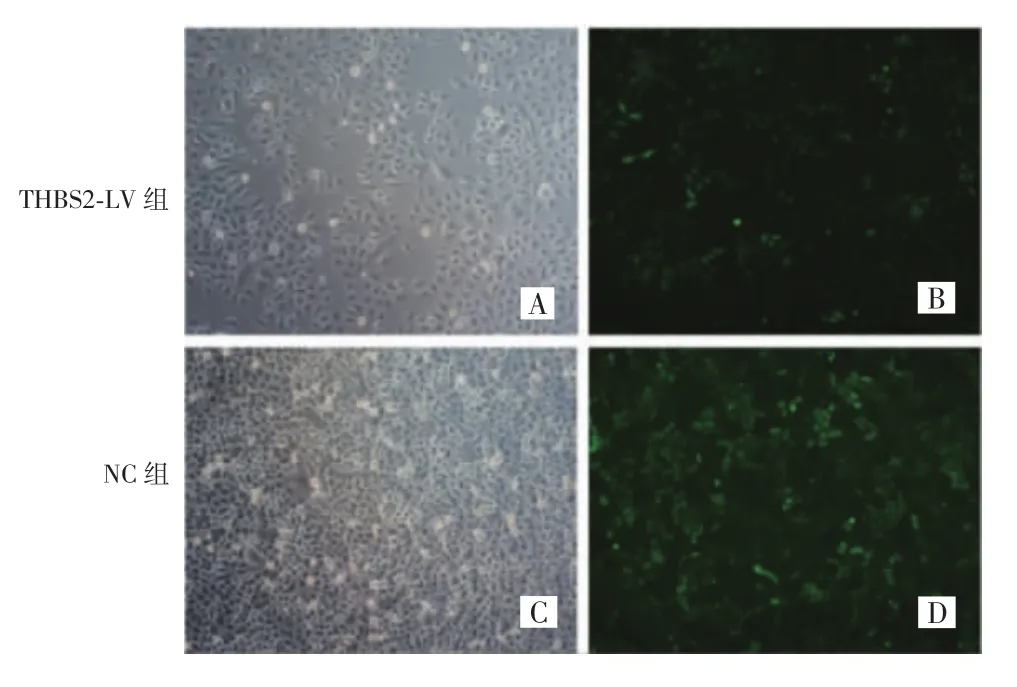
图1 慢病毒转染宫颈鳞癌SiHa细胞的荧光及白光照片(×100)
2.2 转染过表达THBS2慢病毒后宫颈鳞癌SiHa细胞中THBS2 mRNA的表达
RT-qPCR检测结果显示,THBS2-LV组THBS2 mRNA的相对表达量为283 399.05±524 79.70,NC组和空白对照组分别为1.32±0.14和1.00±0.11,THBS2-LV组THBS2 mRNA的表达量较NC组和空白对照组显著升高,差异有统计学意义(P=0.003,0.003),NC组和空白对照组差异无统计学意义(P=0.765),见图2。
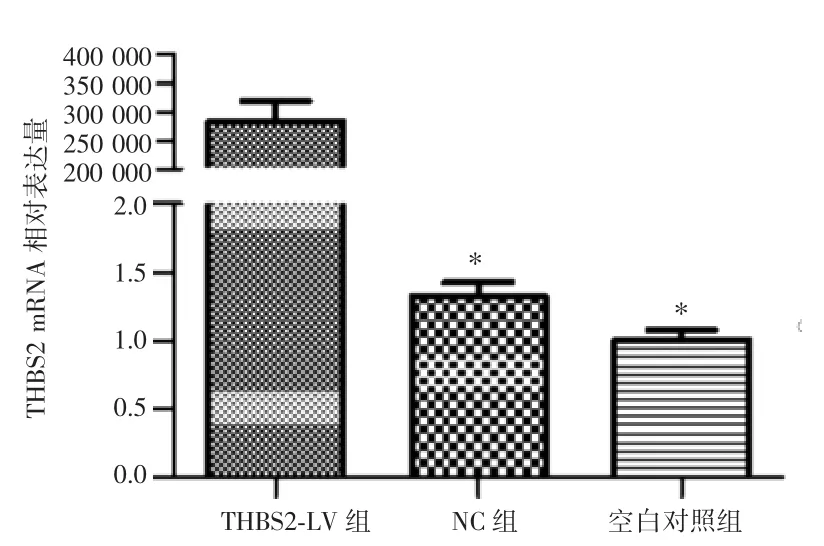
图2RT-qPCR检测宫颈鳞癌SiHa细胞中THBS2 mRNA的表达
2.3 转染过表达THBS2慢病毒后宫颈鳞癌SiHa细胞中THBS2蛋白的表达
Western blot实验结果显示,THBS2-LV组THBS2蛋白表达量为 1.45±0.19,明显高于 NC 组(0.87±0.20)和空白对照组(0.84±0.22),差异有统计学意义(P=0.003,0.002),NC组和空白对照组差异无统计学意义(P=0.825),见图 3。
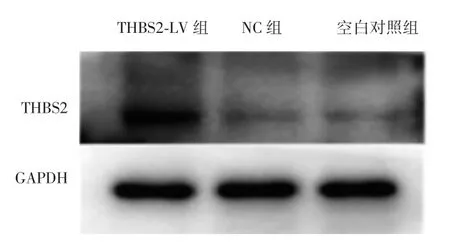
图3 Western blot检测宫颈鳞癌SiHa细胞中THBS2蛋白的表达
2.4 转染过表达THBS2慢病毒对宫颈磷癌SiHa细胞增殖能力的影响
CCK-8法检测结果显示,THBS2-LV组、NC组和空白对照组OD值分别0.74±0.08、1.23±0.02和1.25±0.00,THBS2-LV组细胞生长速度明显低于NC组和空白对照组,差异有统计学意义(P<0.001),NC组和空白对照组差异无统计学意义(P=0.765),见图4。
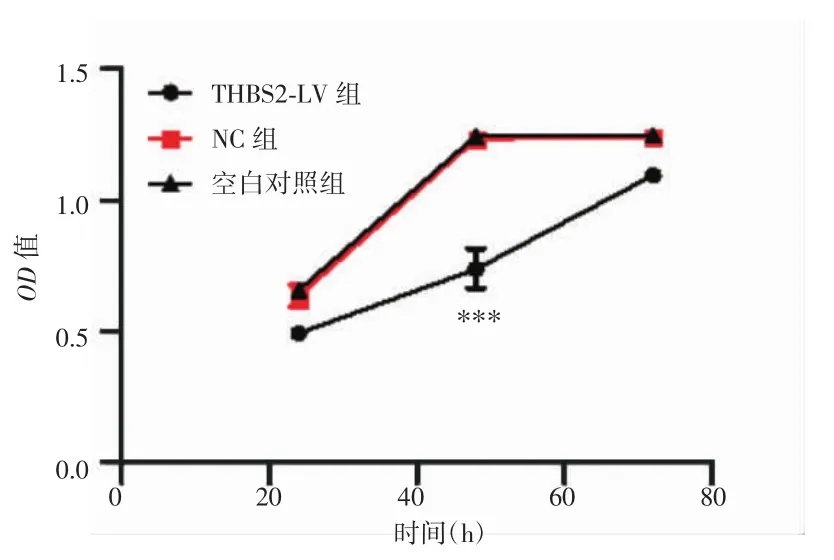
图4 转染后不同处理组宫颈鳞癌SiHa细胞的增殖能力
2.5 转染过表达THBS2慢病毒对宫颈磷癌SiHa细胞凋亡的影响
流式细胞仪检测结果显示,THBS2-LV组、NC组和空白对照组的细胞凋亡率分别为(21.40±1.20)%、(16.05±1.46)%和(13.91±2.62)。THBS2-LV 组细胞凋亡率高于NC组和空白对照组,差异有统计学意义(P=0.014,0.003),NC组和空白对照组差异无统计学意义(P=0.221),见图 5。
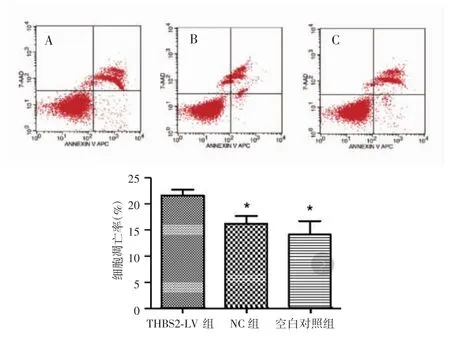
图5 转染后不同处理组宫颈鳞癌SiHa细胞的凋亡率
2.6 转染过表达THBS2慢病毒对宫颈鳞癌SiHa细胞侵袭能力的影响
Transwell侵袭实验结果显示,转染48 h后THBS2-LV组、NC组和空白对照组细胞穿膜数分别为(44.20±4.21)个、(71.80±5.63)个和(68.40±7.40)个,THBS2-LV组细胞穿膜数较NC组和空白对照组少,差异有统计学意义(P<0.001),NC组和空白对照组差异无统计学意义(P=0.380),见图6。
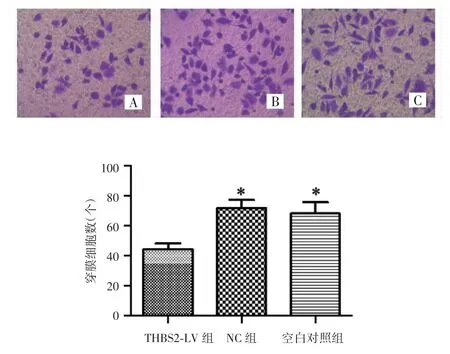
图6 转染后不同处理组宫颈鳞癌SiHa细胞的侵袭能力(×200)
2.7 转染过表达THBS2慢病毒对宫颈鳞癌SiHa细胞迁移能力的影响
转染72 h后,THBS2-LV组的细胞迁移率为(51.01±7.40)%,NC 组和空白对照组分别为(71.05±8.40)%和(69.58±13.80)%。THBS2-LV 组细胞迁移率较NC组和空白对照组低,差异有统计学意义(P=0.014,0.009),NC组和空白对照组差异无统计学意义(P=0.824),见图 7。
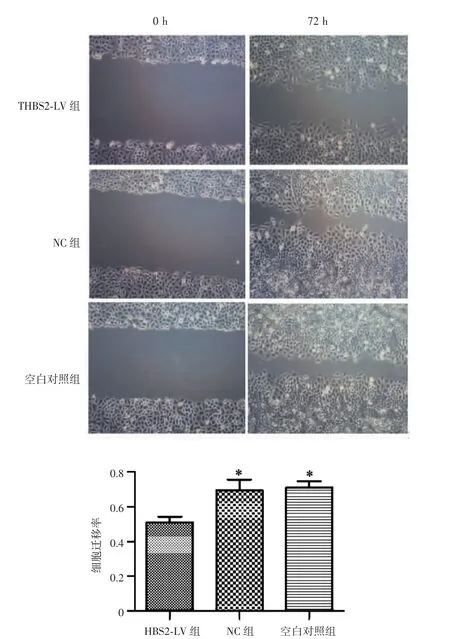
图7 转染后不同处理组宫颈鳞癌SiHa细胞的迁移能力(×100)
2.8 裸鼠成瘤实验结果
THBS2-LV组成瘤率为80%,NC组及空白对照组成瘤率均为100%。第22天处死裸鼠,结果显示,接种THBS2-LV组细胞的裸鼠肿瘤平均体积为(218.26±72.44)mm3,明显小于接种NC组细胞裸鼠的肿瘤平均体积(416.96±88.46)mm3和接种空白对照组细胞裸鼠的肿瘤平均体积(403.64±103.12)mm3,差异有统计学意义(P=0.004,0.006),NC组和空白对照组差异无统计学意义(P=0.817),见图8、图9、表1。

表1 实验期间裸鼠皮下肿瘤体积的变化
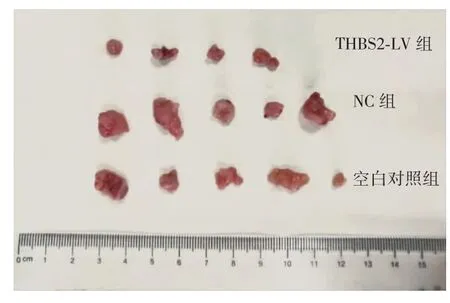
图8 不同处理组裸鼠成瘤实验瘤体大体形态
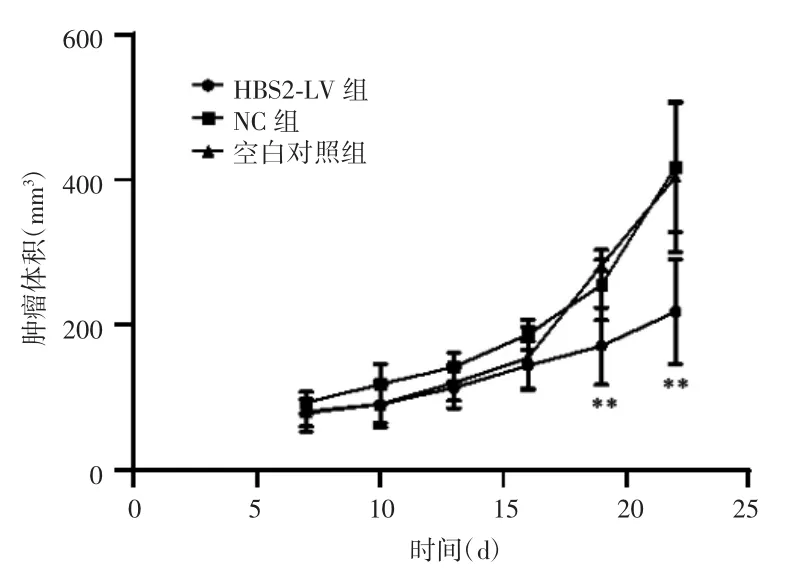
图9 实验期间不同处理组裸鼠皮下肿瘤体积的生长曲线
3 讨论
中国每年新发宫颈癌病例占全球的五分之一[8]。近年来,人乳头状瘤病毒预防性疫苗的应用使宫颈癌得到有效预防[9]。手术和放疗可治愈大部分早期宫颈癌患者,但晚期和复发患者疗效不理想。分子靶向治疗为这类患者的治疗提供了新的思路,而寻找敏感的肿瘤标志物成为研究重点。
Bornstein等[10]于小鼠基因测序中首先发现THBS2,其为THBS蛋白家族中的一员,含有Ⅰ型重复区域结构,在抗血管生成中起重要作用[3,11]。近年在多种类型肿瘤研究中发现THBS2在癌组织中呈低表达,并影响肿瘤细胞的生物学特性。Sun等[5]在胃癌研究中发现THBS2在癌组织中呈低表达,而THBS2过表达的MKN-45细胞和SGC-7901细胞在软琼脂上形成更少集落,并促进SGC-7901细胞凋亡。Zhou等[12]在宫颈癌研究中发现miR-20a通过THBS2抑制细胞增殖并诱导细胞凋亡。Slavin等[6]研究发现前列腺癌组织中THBS2呈低表达,在癌相关成纤维细胞中敲低THBS2可中断雌激素受体α介导的细胞侵袭抑制。本课题组前期研究发现在宫颈鳞癌组织中mir-1246呈高表达,并促进细胞增殖、侵袭和迁移,且THBS2为mir-1246的靶基因[7],以上研究提示THBS2可能是治疗宫颈癌的新靶点。为探讨THBS2对宫颈鳞癌SiHa细胞生物学特性的影响,本研究通过转染THBS2过表达慢病毒构建过表达THBS2的宫颈鳞癌SiHa细胞,RT-qPCR和Western blot实验结果显示,在转染过表达THBS2慢病毒的宫颈鳞癌SiHa细胞中THBS2 mRNA和蛋白的表达量明显高于转染空载病毒和正常培养的宫颈鳞癌SiHa细胞,说明本研究成功建立了稳定过表达THBS2的宫颈鳞癌SiHa细胞,可用于后续实验。
宫颈鳞癌细胞发生侵袭、转移是患者死亡率高的主要原因之一,研究其侵袭转移机制对改善患者预后有重要意义。本研究通过Transwell、划痕实验、流式细胞仪和CCK-8法观察细胞侵袭、迁移、凋亡和增殖能力,结果发现过表达THBS2的宫颈鳞癌SiHa细胞侵袭和转移能力较NC组和空白对照组明显降低,细胞凋亡率明显升高;其中细胞增殖率较NC组和空白对照组降低,与肺腺癌研究中下调THBS2可抑制A549细胞增殖的结论相悖,可能与肺腺癌免疫相关调节的特异性有关[13],以上实验结果提示,在体外细胞实验中过表达THBS2可降低宫颈鳞癌SiHa细胞增殖、侵袭和迁移能力,且增强细胞凋亡能力。为进一步验证THBS2在宫颈鳞癌发生发展中的作用,本研究建立裸鼠模型,观察接种过表达THBS2慢病毒宫颈鳞癌SiHa细胞的裸鼠皮下成瘤情况,结果发现其皮下成瘤能力明显低于接种NC组和空白对照组细胞的裸鼠,且肿瘤平均体积明显缩小,与Calabro等[14]在裸鼠实验中的观察结果一致,说明THBS2可抑制裸鼠皮下宫颈鳞癌生长。可能的作用机制是THBS2具有备解素样Ⅰ 型重复区域结构,可作为血管生成抑制剂,通过对肿瘤血管生成抑制作用,阻止肿瘤发展和转移[15-17]。此外,THBS2抑制肿瘤进展的机制还可能与影响基质金属蛋白酶表达,以及参与TGF-β通路调控相关[18-19]。
综上所述,本研究在体外实验中发现上调THBS2表达可抑制宫颈鳞癌SiHa细胞增殖、侵袭、转移能力并促进其凋亡,同时在体内实验中验证过表达THBS2可抑制裸鼠皮下成瘤能力和肿瘤生长,THBS2可能是宫颈鳞癌的抑癌基因,可作为该疾病的潜在治疗靶点,具体作用机制有待进一步研究。
