NCLX介导的线粒体钙稳态对肝癌细胞生长的影响
2018-02-22金明朋尹纯尚英英曹海燕吉晓莹任婷婷邢金良吴有盛
金明朋 尹纯 尚英英 曹海燕 吉晓莹 任婷婷 邢金良 吴有盛
肝癌是目前全世界第6大常见癌症,也是全球癌症第4大死亡原因,每年约有841 000例新发病例和782 000例死亡病例[1]。我国是肝癌高发区,近年来肝癌在我国的发病率和死亡率呈逐年上升趋势[2],严重威胁人民健康。线粒体通过调节细胞代谢等功能在癌症的发生发展中扮演重要角色。研究证实线粒体结构和功能改变在促进癌症发展中发挥重要作用[3]。在线粒体众多功能中,肿瘤细胞线粒体钙稳态的变化备受关注[4]。钙离子可调节细胞增殖、分化和凋亡等。已有研究表明,一些肿瘤细胞存在特定的Ca2+通道、泵或交换剂被上调或下调[5-6]。线粒体钠钙交换体 (mitochondrial Na+/Ca2+exchanger,NCLX)是线粒体钙流出的通道,在调控线粒体钙稳态中发挥重要作用[7]。上述结果提示NCLX表达可能与肝癌的发生发展密切相关,有可能成为肿瘤治疗的潜在靶点,但目前国内外尚未有关NCLX与肝癌关系的深入研究。本研究通过构建干涉和过表达NCLX的稳定转染肝癌细胞系,观察NCLX介导的线粒体钙稳态在肝癌细胞增殖和凋亡中的作用,初步探索线粒体钙对肝癌细胞生长的影响,为寻找肝癌的潜在治疗靶点提供证据。
1 材料与方法
1.1 主要试剂与仪器
肝癌细胞系SNU-739和SNU-368购自上海中科院细胞库。NCLX扩增引物由上海生工合成,pcDNA3.1(+)载体、pSilencer3.0载体、脂质体(Lipofectamine 2000)、Rhod-2-AM、PVDF 膜、胎牛血清(FBS)、RPMI 1640培养基购自美国Invitrogen公司,限制性核酸内切酶Hind Ⅲ、BamHⅠ、T4 DNA 连接酶、DNA marker DL2000、DH5a感受态细菌菌株购自日本TaKaRa公司,细胞培养瓶购自美国Corning公司,5×蛋白上样缓冲液、RIPA裂解液购自西安晶彩科技有限公司,抗NCLX多抗购自武汉三鹰生物技术有限公司,羊抗兔二抗购自英国Abcam公司,EdU试剂盒购自广州锐博生物科技有限公司,Annexin V-FITC凋亡检测试剂盒购自上海贝博生物公司,6孔、24孔、96孔板购自美国Axygene公司,共聚焦专用玻璃购自无锡耐思生物科技有限公司,激光共聚焦显微镜购自日本Olympus公司。
1.2 细胞培养
肝癌细胞SNU-739、SNU-368用含10%FBS的RPMI 1640细胞培养基,置于37℃、5%CO2细胞培养箱中正常培养,取对数生长期细胞用于后续实验,细胞用胰蛋白酶消化、传代。
1.3 构建稳定干涉或过表达NCLX基因的肝癌细胞株
采用Lipofectamine 2000转染,肝癌细胞SNU-739和SNU-368各分为4组:SNU-739-shCtrl组、SNU-368-shCtrl组(分别用空载体shCtrl转染SNU-739和SNU-368细胞),SNU-739-shNCLX组、SNU-368-shNCLX组(用pSliencer3.0-shNCLX转染SNU-739和SNU-368细胞,构建干涉NCLX的SNU-739和SNU-368细胞);SNU-739-EV组、SNU-368-EV组(用空载体EV转染SNU-739和SNU-368细胞),SNU-739-NCLX组、SNU-368-NCLX组(用 pcDNA3.1(+)-NCLX转染 SNU-739和SNU-368细胞,构建过表达NCLX的SNU-739和SNU-368细胞)。取适量对数生长期的肝癌细胞,接种于6孔培养板,使24 h后细胞培养板覆盖率为70%~80%。转染方式按照Lipofectamine 2000说明书进行,本实验采用4μg质粒和8μLLipofectamine 2000每孔进行转染。筛选稳定干涉和过表达NCLX克隆株:细胞转染48 h后,用胰蛋白酶消化,接种1/5细胞到6孔培养板中,加入含800 μg/mL G418的RPMI 1640培养基,每2~3 d更换1次筛选培养基。细胞出现单克隆时,挑取单克隆团后进行常规培养,鉴定筛选有效克隆。
1.4 免疫印迹法检测NCLX蛋白的表达
取待测的处于对数生长期细胞,PBS洗涤3遍,加入RIPA裂解液冰上孵育30 min,4℃ 12 000 r/min离心30 min,取上清液。BCA蛋白定量试剂盒测定NCLX蛋白浓度后,加入蛋白上样缓冲液,100℃煮沸10 min使其变性。按每孔60 μg上样,SDS-PAGE电泳后将蛋白转移至PVDF膜,在5%脱脂奶粉中室温封闭 1 h,加入一抗 NCLX 抗体(1∶1000)和 β-actin 抗体(1∶3 000)4℃孵育过夜,TBST充分洗膜 3次后加入羊抗兔二抗(1∶10 000),室温孵育 1 h,TBST 洗涤 3次后,采用ECL化学发光检测试剂盒检测NCLX蛋白的表达。用Image J软件分析,以目的蛋白条带灰度值和内参β-actin的蛋白条带灰度值比值确定目的蛋白的相对表达水平,每组实验重复3次。
1.5 Rhod-2-AM染色检测线粒体钙水平
取对数生长期细胞,以每孔2×104个细胞接种于25 mm玻底细胞培养皿中,将细胞置于5%CO2、37℃恒温培养箱中培养过夜。配制1 mmol/L的Rhod-2-AM 母液:50 μg Rhod-2-AM 粉末用 44.5 μL二甲基亚砜(DMSO)溶解,分装,-20℃避光密封保存。使用时用含Ca2+、Mg2+的HBSS缓冲液以4∶1 000的比例配制4 μmol/L工作液;取出细胞弃去培养基,用含Ca2+、Mg2+的 HBSS 缓冲液洗涤细胞 3 次;加入 600 μL Rhod-2-AM工作液,37℃孵育40 min,用HBSS缓冲液洗涤细胞3次,去除残留的Rhod-2-AM工作液,然后加入HBSS溶液覆盖细胞,37℃孵育30 min;用激光共聚焦显微镜检测细胞,激发波长545 nm,发射波长565 nm。
1.6 EdU检测细胞增殖能力
取对数生长期细胞,以每孔1~4×104个细胞接种于24孔板中,于培养箱中培养过夜。用细胞培养液1∶1 000稀释EdU溶液为50 μM EdU工作液;每孔加入500 μL EdU工作液,37℃孵育2h,PBS清洗细胞2次,加500 μL 4%多聚甲醛溶液固定细胞30 min;加入 500 μL 2 mg/mL甘氨酸孵育5 min,然后用PBS清洗以中和多聚甲醛,加入500 μL 0.5%TritonX-100的PBS,脱色摇床孵育10 min后用PBS清洗;加入提前配置好的1×Apollo®染色反应液400 μL避光孵育30 min,加入渗透剂后分别用甲醇和PBS洗涤;加1×Hoechst 33342反应液进行DNA染色,荧光显微镜拍照计数。
1.7 MTS实验检测细胞生长情况
取对数生长期细胞,调整细胞悬液浓度为100 μL/孔,加入 96 孔板,2×103个/孔;5%CO2、37 ℃孵育 24 h,显微镜观察;每孔加入20 μL MTS溶液(5 mg/mL),继续培养2 h;在酶联免疫检测仪OD为490 nm处测量各孔的吸光值(OD值)。
1.8 流式细胞仪检测细胞凋亡情况
收集对数生长期细胞,用无EDTA胰酶消化,1 000 r/min离心5 min后收集细胞,弃上清液。用提前预冷的PBS洗涤细胞3次,1 000 r/min离心5 min;用400 μL 1×Binding Buffer缓冲液悬浮细胞,调整细胞浓度约为1×106个/mL;向上述细胞悬液中加入5 μL Annexin V-FITC染料,轻轻混匀,4℃冰箱中避光条件下孵育15 min;加入10 μL PI染料,轻轻混匀,于4℃冰箱中避光条件下孵育5 min;1 h内用流式细胞仪检测。激发波长为488 nm。
1.9统计学分析
采用SPSS 22.0软件进行统计分析。服从正态分布且方差齐性的两组数据之间的比较使用独立样本t检验,否则采用Wilcoxon秩和检验。以双侧P<0.05为差异有统计学意义。
2 结果
2.1 真核表达载体的构建结果
构建的真核表达载体pSliencer3.0-shNCLX、pcDNA3.1(+)-NCLX经华大基因生物公司测序确认,所构建的载体序列正确(图1),可用于后续实验。
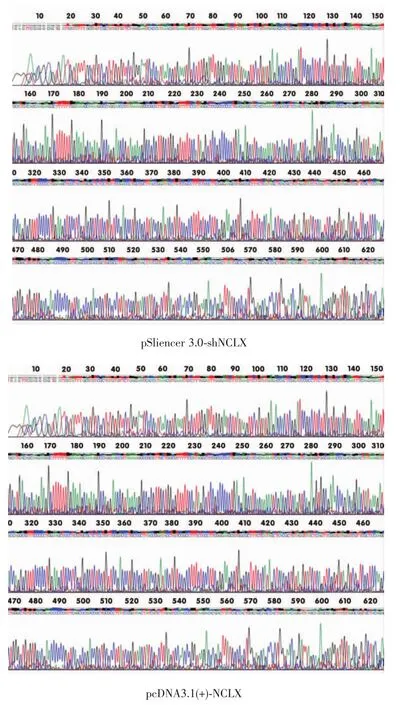
图1 干涉和过表达NCLX载体测序结果
2.2 免疫印迹法检测NCLX蛋白的表达
免疫印迹法检测结果显示(图2),SNU-739-shCtrl组和SNU-739-shNCLX组蛋白表达量分别为0.96±0.03 和 0.59±0.09,差异有统计学意义(P=0.02);SNU-739-EV组和SNU-739-NCLX组蛋白表达量分别为1.02±0.03和 1.47±0.10,差异有统计学意义(P=0.01);SNU-368-shCtrl组和SNU-368-shNCLX组蛋白表达量分别为1.16±0.08和0.69±0.06,差异有统计学意义(P=0.01);SNU-368-EV 组和 SNU-368-NCLX 组蛋白表达量分别为0.94±0.06和2.41±0.12,差异有统计学意义(P<0.01),提示稳定干涉和过表达NCLX的肝癌细胞系构建成功。
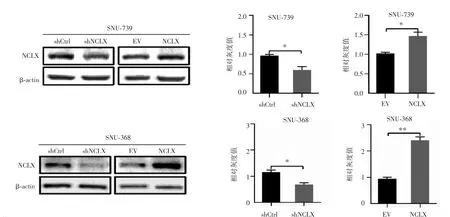
图2 免疫印迹法检测肝癌细胞中NCLX蛋白的表达
2.3 Rhod-2-AM染色检测线粒体钙水平
Rhod-2-AM染色结果显示(图3),SNU-739-shCtrl组和SNU-739-shNCLX组的相对荧光值分别为0.97±0.03和 1.53±0.08,差异有统计学意义(P<0.01);SNU-739-EV组和SNU-739-NCLX组的相对荧光值分别为1.04±0.06和 0.67±0.06,差异亦有统计学意义(P=0.01);SNU-368-shCtrl组和SNU-368-shNCLX组的相对荧光值分别为1.03±0.01 和 1.61±0.02,SNU-368-EV 组和 SNU-368-NCLX组的相对荧光值分别为1.00±0.03和0.46±0.06,差异均有统计学意义(P<0.01),提示干涉 NCLX后肝癌细胞线粒体钙明显增多,而NCLX过表达的肝癌细胞线粒体钙明显减少。
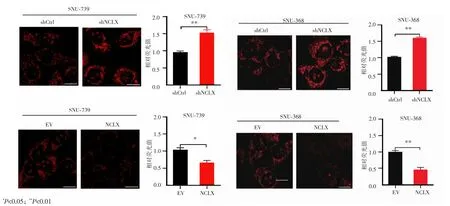
图3 线粒体钙Rhod-2-AM的染色结果
2.4 干涉和过表达NCLX对肝癌细胞生长的影响
MTS实验结果显示(图 4),SNU-739-shCtrl组和SNU-739-shNCLX组96 h时的相对应OD值分别为0.78±0.04 和 1.18±0.06,差异有统计学意义(P<0.01);SNU-739-EV组和SNU-739-NCLX组在96 h相对应的OD值分别为0.87±0.05和0.59±0.05,差异有统计学意义(P=0.02);SNU-368-shCtrl组和 SNU-368-shNCLX在96 h相对应的OD值分别为0.70±0.03和1.01±0.03,差异有统计学意义(P<0.01);SNU-368-EV组和SNU-368-NCLX组在96 h相对应的OD值分别为0.76±0.04 和 0.52±0.01,差异有统计学意义(P<0.01),提示干涉NCLX明显促进了肝癌细胞生长,而NCLX过表达则抑制肝癌细胞生长。
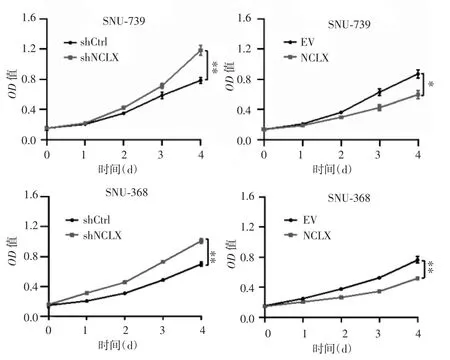
图4 干涉和过表达NCLX对肝癌细胞生长的影响
2.5 干涉和过表达NCLX对肝癌细胞增殖的影响
EdU增殖实验结果显示(图5),SNU-739-shCtrl组和SNU-739-shNCLX组的细胞增殖率分别为(27.04±1.94)%和(48.94±5.60)%,差异有统计学意义(P=0.02);SNU-739-EV 组和 SNU-739-NCLX 组的细胞增殖率分别为(32.62±2.38)%和(23.44±1.28)%,差异有统计学意义(P=0.03);SNU-368-shCtrl组和SNU-368-shNCLX组的细胞增殖率分别为(30.75±1.33)%和(40.33±1.45)%,差异有统计学意义(P<0.01);SNU-368-EV组和SNU-368-NCLX组的细胞增殖率分别为(28.67±2.40)%和(20.33±1.45)%,差异有统计学意义(P=0.04),提示干涉NCLX明显促进了肝癌细胞增殖,而NCLX过表达明显抑制肝癌细胞增殖。
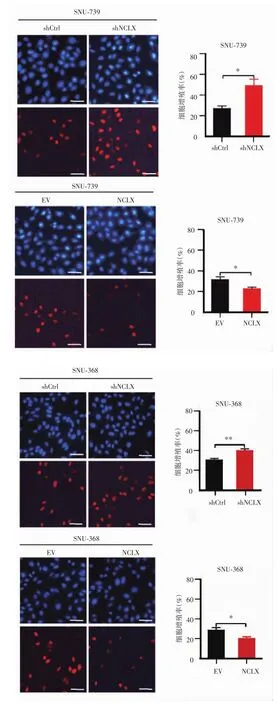
图5 干涉和过表达NCLX对肝癌细胞增殖的影响
2.6 干涉和过表达NCLX对肝癌细胞凋亡的影响
流式细胞仪检测结果显示(图6),SNU-739-shCtrl组和SNU-739-shNCLX组的细胞凋亡率分别为(8.07±0.44)%和(4.03±0.44)%,差异有统计学意义(P<0.01);SNU-739-EV组和SNU-739-NCLX组的细胞凋亡率分别为(8.23±0.34)%和(14.30±0.49)%,差异有统计学意义(P<0.01);SNU-368-shCtrl组和 SNU-368-shNCLX组的细胞凋亡率分别为(9.37±0.41)%和(3.60±0.20)%,差异有统计学意义(P<0.01);SNU-368-EV组和SNU-368-NCLX组的细胞凋亡率分别为(10.20±0.41)和(20.30±0.49),差异有统计学意义(P<0.01),提示干涉NCLX抑制了肝癌细胞凋亡,而NCLX过表达则促进肝癌细胞凋亡。
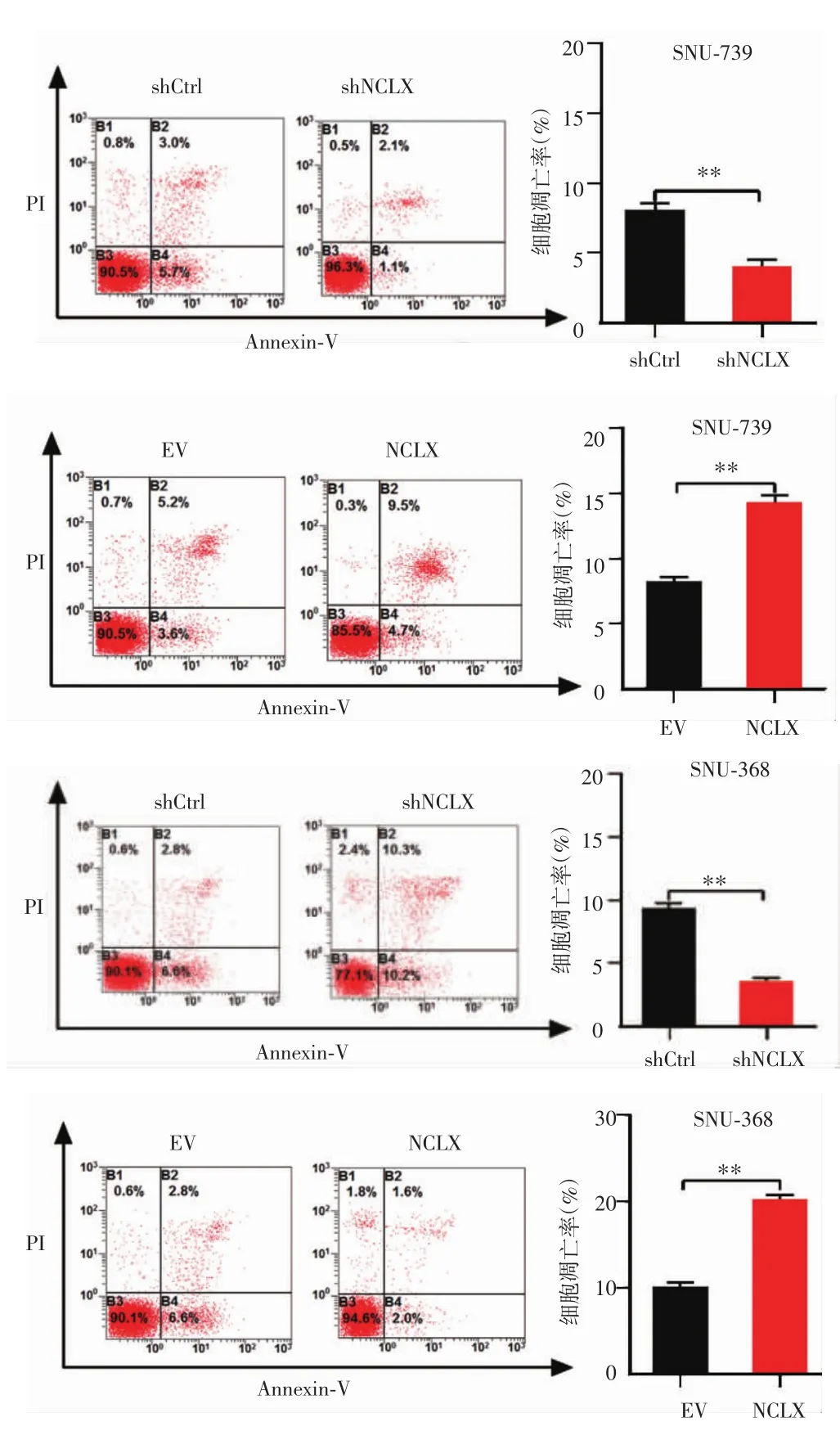
图6 干涉和过表达NCLX对肝癌细胞凋亡的影响
3 讨论
线粒体的钙离子转运调节平衡是线粒体合成ATP和诱导细胞凋亡以外的又一重要功能,一方面,线粒体钙可调控细胞质内钙离子水平,并对钙信号振荡有缓冲作用[5,8-9];另一方面,线粒体还可通过调节内部钙稳态进一步影响其他功能,如活性氧ROS生成、氧化磷酸化进程以及线粒体凋亡通路活化等,最终在细胞生存状态调节中发挥重要作用[10-11]。
NCLX是钠钙交换蛋白超家族的成员之一,该家族蛋白具有α1/α2重复结构形成催化阳离子的转运部件[12-13]。NCLX作为线粒体钙排出通道,在线粒体钙稳态调控过程中发挥作用。已有大量研究报道NCLX表达异常与多种疾病的发生和发展密切相关。在内分泌与代谢疾病相关研究中,高糖环境下敲低NCLX表达后,线粒体钙释放减少,葡萄糖依赖性胰岛素分泌延迟[8]。在心血管疾病相关研究中,美国坦普尔大学研究团队发现缺失NCLX表达的小鼠出生后14 d的存活率不到13%,致死原因多为心肌功能障碍和暴发性心力衰竭,证明了NCLX低表达能干扰线粒体稳态,进而严重影响心脏的正常功能[7]。在神经生物研究领域,有研究表明NCLX表达沉默会显著抑制星形胶质细胞的增殖和迁移能力[14]。本研究通过构建干涉和过表达NCLX肝癌细胞系,检测细胞线粒体钙水平,并通过增殖实验和凋亡实验分别检测细胞的增殖能力和凋亡情况,研究结果显示干涉NCLX诱导的线粒体钙水平升高促进了肝癌细胞生长,而过表达NCLX诱导的线粒体钙水平下降抑制了肝癌细胞生长。本研究首次证明了NCLX表达水平与肝癌的发生发展密切相关,为后续开发针对NCLX的肝癌靶向治疗药物提供了基础。
