剪切应力环境下的内皮祖细胞对肝星状细胞增殖和生物功能的影响*
2018-02-21陈信信张晓芸丁玉真官秀梅崔晓栋
陈信信, 张晓芸, 丁玉真, 李 鑫, 官秀梅, 李 宏, 成 敏△, 崔晓栋△
(1. 潍坊医学院 生物科学与技术学院, 2. 临床医学院, 山东 潍坊 261053)
肝星状细胞(hepatic stellate cells,HSCs)存在于肝血窦Disse间隙内皮屏障下,亦称贮脂细胞,HSCs也具有调节肝血窦血流的作用。当肝细胞受到某些致病因素作用发生损伤时,HSCs可被大量激活,转化成肌成纤维细胞,从而合成大量细胞外基质沉积在肝脏内,造成肝内血管重塑及血流异常,进而导致肝纤维化、肝硬化。故认为激活的HSCs是促进肝纤维化进程的重要因素[1]。
内皮祖细胞(endothelial progenitor cells,EPCs)是血管内皮细胞的前体细胞,在出生后血管形成中发挥着重要作用。近年来,越来越多的研究发现,一定剂量和频次的EPCs移植可显著改善肝纤维化的发生[2,3],故EPCs对防治肝纤维化有潜在的应用前景。但EPCs在肝纤维化发生发展中的具体作用和机制尚不清楚。
研究显示,HSCs和EPCs均定位于肝脏肝血窦Disse间隙内,此间隙被称作二者的生态小境(ecological niche)。生态小境中的HSCs和EPCs势必相互影响。不容忽视的是,肝脏血液动力学改变造成的流体切应力的变化亦影响着生态小境中各类细胞的功能状态。本课题组前期研究发现,一定的剪切应力可促进EPCs向内皮细胞分化,加速动脉血管损伤部位的修复[4]。因此,在流体力学环境下的EPCs所形成的生态小境对HSCs的生物学特性极有可能产生一定的影响,进而改变HSCs的细胞功能。本实验利用生物力学、细胞生物学和分子生物学等学科的方法和技术,在EPCs和HSCs共培养模型基础上,对EPCs行剪切应力处理,探究力学环境下的EPCs对HSCs生物学功能的影响,从而揭示EPCs治疗肝纤维化的可能机制。
1 材料与方法
1.1 主要试剂和材料
SD大鼠(200~250) g,雌雄不限,解放军第89医院实验中心提供;荧光定量PCR(Bio-Rad IQ5);5% CO2培养箱(Thermo),Millicell共同培养小室(Millipore);Histopaque-1083(Sigma);DMEM高糖(Gibco公司);EGM-2完全培养基(Lonza);胎牛血清(FBS,Hyclone);纤维连接蛋白(fibronectin,FN, Roche);Trizol试剂(Invitrogen);Annexin V-FITC/PI 凋亡检测试剂盒(联科生物);0.25%胰蛋白酶液(Hyclone);CCK-8试剂盒(同仁,日本); SYBR Prime Script® RT-PCR Kit II及相关引物设计(大连宝生物公司);抗α-SMA、抗Col-I、抗Col-III抗体(博奥森生物技术公司)。
1.2 EPCs的分离与培养
采用Histopaque-1083密度梯度离心法分离成年大鼠股骨和胫骨骨髓腔的单个核细胞,而后用EGM-2内皮细胞培养基在培养箱中诱导培养,具体操作步骤及EPCs鉴定方法参照课题组前期文献进行[5,6]。本实验采用3~4代EPCs作为研究对象。
1.3 HSC-T6的培养
将HSC-T6(上海中医药大学徐列明教授惠赠)接种于含10% FBS的DMEM(高糖)培养基中,置CO2培养箱中37℃培养,待细胞长到90%时传代培养,以3~6代用于实验研究。
1.4 HSCs与EPCs共培养模型
具体方法按参考文献[7, 8]进行。即第1日将共培养小室(膜孔径为0.4 μm)倒置,下层用纤维连接蛋白(FN)打底,将3~4代EPCs(1×105个)接种于小室底膜上,待细胞贴壁后置于6孔板中,用EGM-2培养基培养24 h。第2日将生长状态良好的HSCs(1×105个)置于小室上层膜中,培养24 h。
1.5 构建剪切应力加载系统
剪切应力加载系统由流槽瓶、管道、平板流室、蠕动泵等组成(图1)。将共培养模型小心加至平板流室的共培养小室支架上,盖好流槽盖,通过剪切应力加载系统施加剪切应力,本实验采用12 dyne/cm2加载实验。除蠕动泵外,整套系统置于CO2培养箱中。

Fig.1Sketch of co-culture model, flow chamber and shear stress loading system
1.6 分组
以EPCs和HSCs共培养静止组为对照组,12 dyne/cm2的剪切应力加载于EPCs与HSCs共培养模型的为实验组。
1.7 HSCs的增殖检测
用0.25 %胰酶液消化细胞(3~6代),计数细胞并调整细胞密度为5×104cells/ml,每孔加入100 μl细胞悬液,每组9个复孔,培养48 h后每孔加入10 μl CCK-8,培养箱孵育1 h,在酶标仪下测A450nm处的吸光度值。
1.8 HSCs细胞凋亡的检测
将0.25%胰酶液消化的细胞置EP管中离心,收集1~5×105个细胞,取300~500 μl 1×Binding Buffer重悬细胞,每管加入5 μl Annexin V-FITC和10 μl PI,轻柔混匀后,室温避光孵育15 min,上机,用流式细胞仪检测细胞凋亡率。
1.9 HSCs的粘附检测
用FN给24孔板打底1 h,用0.25 %胰酶液消化细胞,计数细胞并调整细胞密度为1×104cells/ml,每孔加1 ml细胞悬液于24孔板中,每组3个复孔,37℃孵育30 min。用PBS轻轻洗去未贴壁细胞,镜下随机拍照,每孔选取6~9个视野,计数细胞取平均值。
1.10 HSCs的迁移检测
0.25%胰酶液消化细胞,调整细胞密度为3×104cells/ml,将Boyden小室下腔加满培养基,盖上滤膜,加上膜腔,中间拧紧,上腔中垂直加入200 μl细胞悬液,每组3个复孔,加盖玻片封口,置CO2培养箱中孵育8 h。取出,用棉签轻轻拭去滤膜上方细胞,取下滤膜反面放入12孔板中,PBS清洗,切勿振荡,4%多聚甲醛液室温固定15 min,再次用PBS清洗3遍,DAPI荧光染色,荧光显微镜下拍照,每张膜选取3~5个视野(×200),计数细胞作统计分析。
1.11 提取细胞总RNA、荧光定量PCR检测相关基因表达
按照Trizol试剂说明书提取细胞总RNA,用DEPC处理的去离子水溶解并保存在-80 ℃备用。根据宝生物说明书操作荧光定量RT-PCR,宝生物公司设计合成反应引物,具体信息见表1。构建反应体系后,按设定程序进行逆转录和扩增,根据CT值,按公式 2-ΔCt(ΔCt) = Ct (target) Ct (GAPDH) 计算出各组扩增效率。
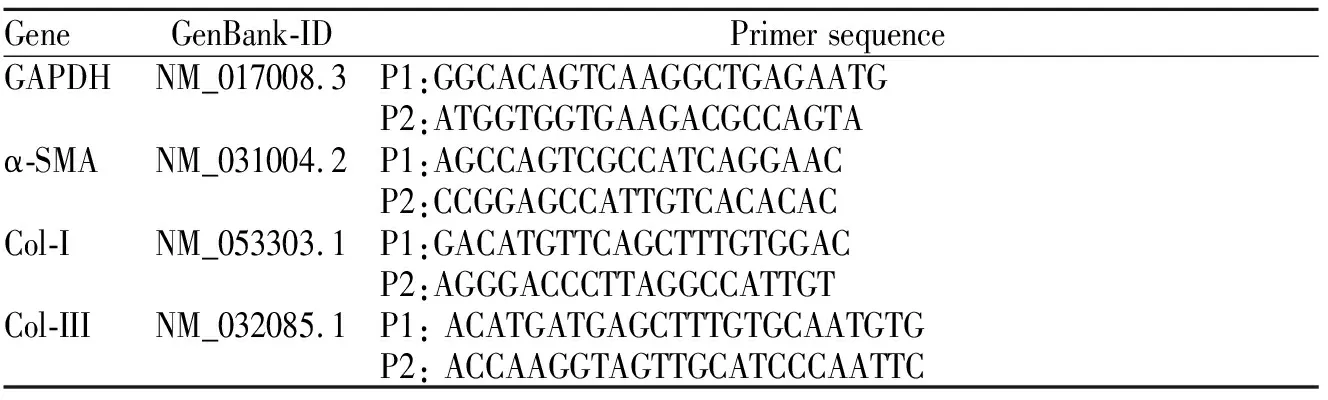
Tab. 1 Sequence information of primers
1.12 Western blot检测相关蛋白表达
收集消化所得细胞,按比例加入裂解液在冰上充分裂解细胞,加入SDS上样缓冲液稀释,煮沸5 min,6 000 r/min离心3 min,取上清上样。以12 %(w/v)胶浓度作SDS-聚丙烯酰胺凝胶电泳;转膜后室温下封闭1 h,加入兔抗鼠多克隆一抗,4 ℃孵育过夜, 再与HRP标记的二抗(1∶2 000稀释) 室温下摇育1 h,用ECL发光显色系统显示蛋白质条带,成像系统成像。
1.13 统计学处理
2 结果
2.1 剪切应力作用下EPCs生态小境对HSCs增殖、粘附和迁移能力的影响
实验结果显示:剪切应力组HSCs增殖(A450nm值)明显低于对照组(表2);粘附能力亦明显低于对照组(图2A、表2);施加剪切应力后,EPCs生态小境对HSCs的迁移能力有明显抑制作用(图2B、表2)。
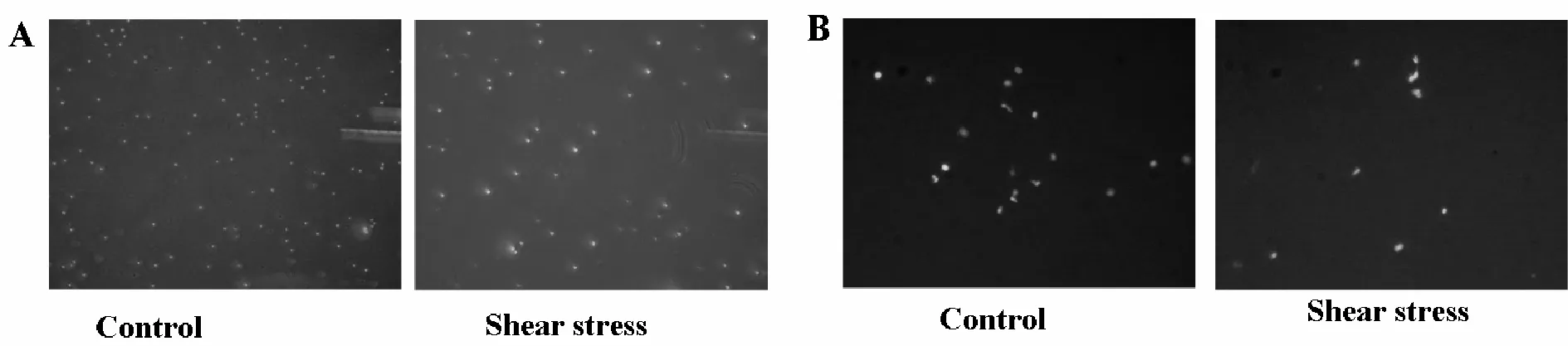
Fig.2Effect of EPCs® ecological niche on adhesion (A, uncolored ×200) and migration (B, DAPI staining ×200) of HSCs under shear stress

GroupProliferationAdhesionMigrationControl1.091±0.320109.7±4.317.2±1.5Shear stress0.565±0.054∗∗36.0±3.2∗∗8.0±1.4∗∗
**P<0.01vscontrol
2.2 剪切应力下EPCs生态小境对HSCs细胞中α-SMA、Col-I、Col-III mRNA及蛋白质表达的影响
共培养组经剪切应力处理后,HSCs α-SMA基因的mRNA和蛋白质表达与对照组无明显差异(P>0.05,表3)。结果提示,剪切应力作用下的EPCs对HSCs无明显激活作用。
与对照组相比,实验组Col-I 和Col-III的mRNA以及蛋白质表达均显著降低,且Col-I/Col-III相对比值降低(P<0.05,P<0.01, 表3,图3),提示剪切应力作用下EPCs可能通过影响HSCs的胶原分泌对肝纤维化的发生发展产生一定影响。

GroupmRNA expressionProtein expressionα-SMA0.73±0.200.911±0.01Col-I0.49±0.18∗0.42±0.03∗∗Col-III0.50±0.27∗0.70±0.07∗Col-I/Col-III —0.60±0.06∗∗
*P<0.05,**P<0.01vscontrol
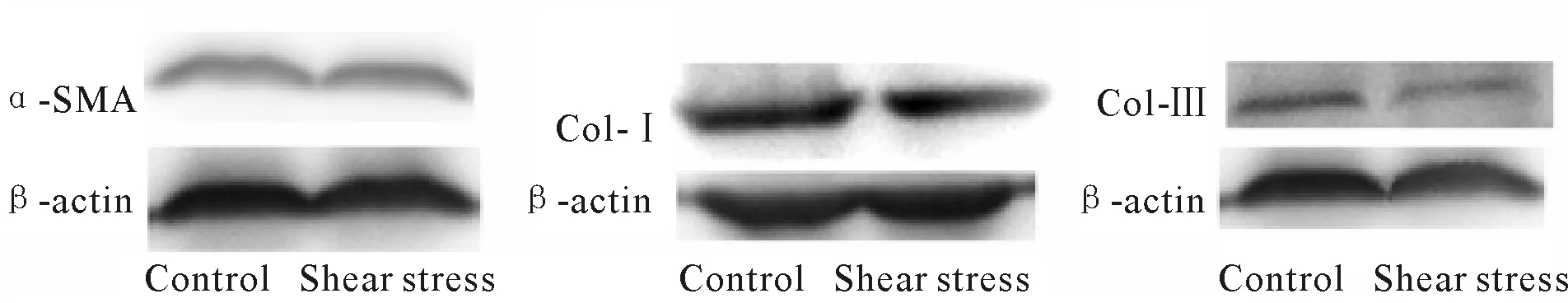
Fig.3Effect of EPCs ecological niche on protein expression of α-SMA, Col-I and Col-III in HSCs under shear stress
2.3 剪切应力下EPCs生态小境对HSCs 凋亡的影响
剪切应力作用12 h后,实验组HSCs细胞凋亡率为(39.16±3.02)%,明显高于对照组的(17.31±2.23)%(图4),提示剪切应力作用下,EPCs生态小境可促进HSCs凋亡的发生。


3 讨论
目前认为,HSCs大量活化是造成肝纤维的主要原因[9]。活化后的HSCs可转化成肌成纤维细胞,进而大量增殖,分泌大量细胞外基质,包括Col-I、Col-III、透明质酸等,造成细胞外基质或纤维成分过多,有可能导致假小叶的形成,进而发展为肝纤维化、肝硬化[9]。现阶段对肝纤维化和肝硬化的治疗手段非常有限。近年来文献证实,外源或自身来源的EPCs移植能够促进肝内血管新生,对肝纤维化有显著的治疗作用[2,3],但具体机制尚不清晰。
刘峰等体外研究显示,HSCs与EPCs可能存在一定的交互关系,进而提示二者的相互作用可能影响肝纤维化进程的发生和发展[10]。我们前期研究显示,EPCs易受流体力学影响而改变其生物学特性,如前所述,归巢后的EPCs在肝血窦内极易受到流体力学的影响,故在流体力学作用下的EPCs所形成的生态小境极有可能对HSCs的生物学特性产生一定的影响,进而改变HSCs的功能。因此,我们建立剪切应力环境下EPCs与HSCs体外共培养模型,对EPCs施加12 dyne/cm2剪切应力,研究在剪切应力作用下EPCs导致生态小境改变对HSCs生物学性能产生的影响。与单纯静止共培养的对照组相比,HSCs的增殖、粘附和迁移能力均明显下降(P<0.01),而增殖、迁移和粘附是HSCs的重要的生物学行为,也是抗肝纤维化研究的切入点。该结果提示,在剪切应力作用下的EPCs对HSCs的生物学行为起到更明显的抑制效应。
同时,本实验数据也显示,剪切应力作用下的EPCs对HSCs无明显激活作用,究其原因可能有二:(1)实验选择HSC-T6为研究细胞,而HSC-T6已是活化后的HSCs细胞株,故EPCs对HSCs无明显激活作用;(2)EPCs可能通过调节HSCs的其他生物学功能而发挥作用。后续结果显示:在剪切应力环境下的EPCs能明显抑制HSCs的粘附、迁移,显著抑制HSCs增殖并促进其凋亡,提示EPCs很可能通过影响HSCs的生物活性,抑制肝纤维化的发生、发展。
正常肝脏的胶原等细胞外基质约占肝脏总蛋白的5%~10%,活化的HSCs可产生大量的细胞外基质,是肝纤维化时产生细胞外基质的主要来源细胞。慢性肝脏损伤是以Col-I、Col-III含量改变,尤其是Col-I比例增加为主要特点[11]。据此,本文研究了剪切应力环境下的EPCs对HSCs生成Col-I、Col-III的影响。结果显示,与静止共培养组相比,在剪切应力作用下,EPCs抑制了HSCs Col-I、Col-III的表达,Col-I/Col-III相对比值减小,提示在剪切应力环境下EPCs可更好地抑制细胞外基质的生成。
综上,本研究从细胞生物学、分子生物学角度,探讨了剪切应力作用下的EPCs对HSCs生物学特性的影响,该研究对揭示EPCs治疗肝纤维化的机理有重要提示和意义。本实验仅初步探索了力学环境下的EPCs对HSCs细胞生物学特性的影响,有关二者间的相互作用、细胞交流机制等尚需深入研究。
