辛伐他汀对大鼠糖尿病所致心肌细胞凋亡的影响及其机制*
2018-02-21李凡璐吴亚俐陈还珍崔香丽
李凡璐, 宛 欣, 王 茜, 刘 鑫, 吴亚俐, 陈还珍, 崔香丽△
(1. 山西医科大学生理系省部共建细胞生理学重点实验室, 太原 030001; 2. 山西医科大学第一医院心血管内科, 太原 030001)
糖尿病(diabetes mellitus, DM)是一组慢性高血糖为特征的代谢性疾病。糖尿病心肌损伤是由糖尿病导致的心肌结构和功能发生变化的病变状态,可进展为糖尿病心肌病。糖尿病心肌病(diabetic cardiomyopathy,DCM)独立于缺血性心脏病、高血压或其他心脏疾病,是糖尿病患者最常见的并发症,也是糖尿病人群心衰甚至死亡的主要原因之一[1]。研究表明氧化应激和细胞凋亡在糖尿病心肌病的发展中起着至关重要的作用[2-3]。目前对于该病的治疗主要集中在改善心功能方面,并没有明确针对干预其发病机制的有效治疗手段。他汀类作为临床常用调节脂代谢异常的一类药物,除了具有降脂作用外,它还能有效的稳定动脉粥样硬化斑块、保护内皮、减少凋亡、清除自由基、抗炎、抗血管和心肌组织增生等,近年来常被用来防治糖尿病患者出现的心血管系统疾病[4-6]。本实验室的前期研究发现,辛伐他汀对糖尿病并发急性低血糖造成的心肌损伤具有保护作用,且与抑制NF-κB表达有关[7],但辛伐他汀对糖尿病心肌保护的分子机制尚不清楚,本课题采用STZ建立糖尿病大鼠模型,给予辛伐他汀灌胃,来研究辛伐他汀对糖尿病所致心肌损伤保护作用及可能分子机制。
1 材料与方法
1.1 实验动物
SPF级雄性SD大鼠180~220 g,由中国人民解放军军事医学科学院实验动物中心提供,许可证号:SCXK-(军)2012-0004。实验动物在室温22~25℃、湿度50%~60%,明暗交替12 h的环境分笼饲养,允许自由饮水摄食,保持垫料干燥,在动物观察室适应性饲养1周后开始实验。
1.2 药品及试剂
辛伐他汀(杭州默沙东制药公司),链脲佐菌素(Sigma公司),无醇苏木素染液,伊红染液 (Jiancheng Biotech),SABC免疫组化染色剂试剂盒(武汉博士德生物工程有限公司),浓缩型DAB试剂盒(北京中山金桥生物技术有限公司),总SOD活性检测试剂盒(WST-8法)、脂质氧化(MDA)检测试剂盒、BCA试剂盒(碧云天生物技术研究所),TUNEL细胞凋亡检测试剂盒(KeyGEN BioTECH),Phospho-p53(Ser15)Antibody、Anti-Mouse IgG antibody(WB)(cell signaling),p53 polyclonal antibody(WB/IHC)、β-actin monoclonal antibody(proteintech),Anti-Rabbit IgG HRP(WB)(TRANS),Protein Marker (10-250KD)(BIO-RAD)。
1.3 大鼠糖尿病模型的建立与分组
将24只SD雄性大鼠(180~220 g)随机分为对照组(control组,n=8)和模型组(n=16)。避光条件下将链脲佐菌素(STZ)溶于pH 4.5的0.1mol/L柠檬酸缓冲液,将大鼠称重,模型组按55 mg/kg剂量单次腹腔注射STZ柠檬酸缓冲液建立糖尿病模型,对照组大鼠给予腹腔注射等剂量的柠檬酸缓冲液。72 h后从大鼠尾静脉采血测量血糖,随机血糖连续3 d≥16.7 mmol/L提示糖尿病模型制备成功。然后随机将模型组分为糖尿病组(DM组,n=8)和糖尿病给予辛伐他汀组(DM+S组,n=8),DM+S组给予辛伐他汀生理盐水40 mg/(kg·d)灌胃四周,其余两组给予的等量生理盐水灌胃至实验结束。实验过程,每天固定时间点记录各组大鼠的体重,每三日对各组大鼠进行一次血糖检测。实验结束后,各组大鼠断头处死,迅速取左心室,1/2经生理盐水冲洗后10%福尔马林保存,1/2 -80℃保存用于Western blot等分子生物学实验。
1.4 氧化应激指标测定
按照总SOD活性检测试剂盒(WST-8法)、脂质氧化(MDA)检测试剂盒说明书要求,测定各组大鼠心肌组织脂质过氧化物丙二醛(MDA)含量、超氧化物歧化酶(SOD)的活性。
1.5 大鼠心脏组织HE染色
心脏组织在10%的福尔马林中固定3 d后石蜡包埋并切片,切片厚度约5 μm。将切片浸入二甲苯进行脱蜡,并依次浸入100%、95%、90%、80%、70%的乙醇。再依次进行苏木素染色和伊红染色,脱水和透明化后,中性树胶封片。HE染色后显微镜下观察心肌细胞的形态。
1.6 TUNEL细胞凋亡原位检测
TUNEL细胞凋亡试剂盒用来检测细胞在凋亡过程中细胞核DNA的断裂情况,其原理是生物素(Biotin)标记的dUTP在脱氧核糖核苷酸末端转移酶(TdT Enzyme)的作用下,可以连接到凋亡细胞中断裂 DNA的 3′-OH 末端,并可与连接辣根过氧化酶的链霉亲和素(Streptavidin-HRP)特异结合,在辣根过氧化酶底物二氨基联苯胺(DAB)的存在下,产生很强的颜色反应(呈深棕色),特异准确地定位正在凋亡的细胞,各组石蜡切片常规脱蜡,60℃烘片1 h后,依次滴加1%Triton X-100 通透液通透、3%H2O2封闭、TdT酶反应液连接、Streptavidin-HRP工作液标记,再经DAB工作液显色,苏木素染液复染,中性树脂封片晾干后在普通显微镜下观察和计数凋亡细胞。心脏切片任选5个非重叠400倍高倍镜视野,计数心肌细胞总数和凋亡数,心肌细胞凋亡率(cardiomyocyte apoptosis index,CAI)(%)=心肌细胞凋亡数/心肌细胞总数×100% ,计数并且计算后,比较每组实验大鼠的心肌细胞凋亡率。
1.7 大鼠心脏组织免疫组织化学检测
各组大鼠心脏采用HE染色相同方法固定、包埋、切片、烘片及脱蜡,再经过抗原修复,封闭,孵育单克隆小鼠抗兔p53一抗(1∶1 000 ),SABC染色剂试剂盒以及DAB显色剂显色后,镜下观察p53的分布以及表达情况;按照人工定量或者半定量的评分方法进行判定,着色范围和着色强度计数结果的乘积为评分结果,每张切片至少随机取6个100倍的视野范围[8]。
1.8 Western blot检测p53,p53-phospho-serine 15,Bax,Bcl-2等蛋白的表达
各组大鼠心肌组织分别取约50 mg用RIPA裂解液充分裂解,离心取上清液,采用BCA法,根据待测样品OD值,对应标准曲线上的蛋白含量(μg),计算各组蛋白样品的浓度。用Eppendorf ThermoStat C 100℃煮沸5 min,使蛋白变性,于-20℃冰箱中保存。随后依次进行SDS-PAGE(十二烷基硫酸钠-聚丙烯酰胺)凝胶(10%~12%分离胶,5%浓缩胶)电泳,转膜,5%脱脂牛奶封闭,再分别孵育一抗抗β-actin(1∶1 000 )、抗p53(1∶2 000 )、抗p53-phospho-serine 15(1∶1 000 )、抗Bax(1∶500 )和抗Bcl-2(1∶500 )抗体,4℃过夜,次日室温孵育山羊抗兔二抗(1∶2 000 )1 h后置于ChemiDocMP Imaging 系统显影成像。
1.9 统计学处理
2 结果
2.1 大鼠体重和血糖的变化
各组大鼠的体重在STZ造模前无明显差异,给予辛伐他汀灌胃四周后,DM组和DM+S组体重较control组的小,但无差异。血糖结果显示,各组大鼠的血糖造模前无差异,给予STZ腹腔注射制备糖尿病模型后,DM组和DM+S组血糖明显上升,且在实验过程中基本保持稳定(图1)。

Fig.1The changes of body weight (A) and blood glucose (B) in experimental rats
2.2 辛伐他汀对大鼠心肌组织SOD,MDA的影响
结果显示DM组大鼠心肌组织SOD活性较control组明显下降(P<0.01),MDA含量较control组显著升高(P<0.01),给予辛伐他汀后,SOD活性增加明显,MDA含量下降,且差异均具有统计学意义(P<0.01,表1)。证明糖尿病可增加氧化应激的发生,辛伐他汀可增加SOD活性、抑制MDA的产生。

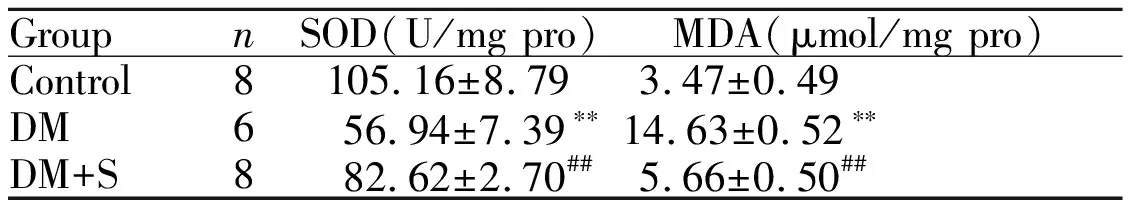
GroupnSOD(U/mg pro)MDA(μmol/mg pro)Control8105.16±8.793.47±0.49DM656.94±7.39∗∗14.63±0.52∗∗DM+S882.62±2.70##5.66±0.50##
DM: Diabetes mellitus group; DM+S: Diabetes mellitus+Simvastatin group; SOD: Superoxide dismutase; MDA: Malondialdehyde
**P<0.01vscontrol;##P<0.01vsDM
2.3 辛伐他汀对大鼠心肌形态学的影响
HE染色观察各组大鼠心肌组织病理学改变。镜下可见control组的心肌细胞排列整齐,心肌纤维完整,结构清晰,无细胞水肿,无炎性细胞浸润;DM组的心肌细胞排列紊乱,心肌纤维断裂,结构不清,细胞明显水肿、空泡变性、有大量炎性细胞浸润;和DM组相比,DM+S组的心肌细胞病变明显减轻,心肌细胞排列较整齐,结构基本清晰,无明显水肿,炎性细胞减少(图2,见彩图页Ⅳ)。证明辛伐他汀可以改善糖尿病大鼠心肌细胞的形态。
2.4 辛伐他汀对大鼠心肌细胞凋亡的影响
结果显示,与control组相比,DM组心肌组织凋亡细胞阳性率显著增加(P<0.01),给予辛伐他汀治疗后,DM+S组细胞凋亡发生率明显降低(与DM组相比较,P<0.01,图3,表2,图3见彩图页Ⅳ)
2.5 免疫组织化学结果
与control组相比,DM组大鼠心脏p53表达量显著增加(P<0.01),且p53在细胞质和细胞核中均有表达;给予辛伐他汀治疗后,p53表达量均明显下降,p53在细胞质和核中均有表达,但核内表达量减少(与DM组相比较,P<0.01,图4,表2,图4见彩图页Ⅴ)

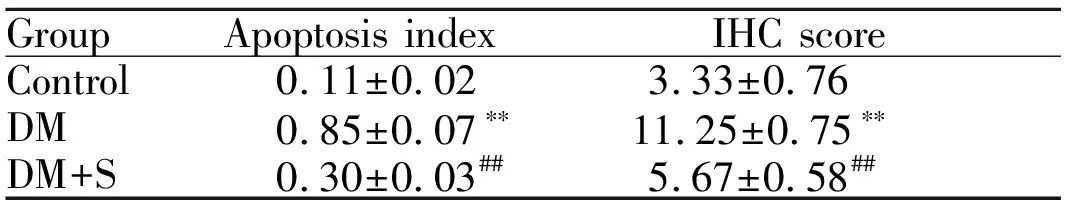
GroupApoptosis indexIHC scoreControl0.11±0.023.33±0.76DM0.85±0.07∗∗11.25±0.75∗∗DM+S0.30±0.03##5.67±0.58##
**P<0.01vscontrol;##P<0.01vsDM
2.6 Western blot检测结果
DM组大鼠p53,p53-phospho-serine15,Bax表达量明显高于control组(P<0.01),Bcl-2表达量较control组低(P<0.01);给予辛伐他汀后,p53(P<0.01),p53-phospho-serine15(P<0.01),Bax(P< 0.05)表达量明显下降,Bcl-2(P<0.05)表达量增加(图5,表3)。

Fig.5The expressions of p53, p53-phospho-serine 15, Bax and Bcl-2 in rat heart tissues tested by Western blot


GroupP53p-p53BaxBcl-2Control0.44±0.050.15±0.030.30±0.020.31±0.04DM0.72±0.09∗∗0.35±0.09∗∗0.45±0.02∗∗0.20±0.04∗∗DM+S0.49±0.05##0.23±0.07##0.40±0.04#0.25±0.02#
**P<0.01vscontrol;#P<0.05,##P<0.01vsDM
3 讨论
成熟的心肌细胞是终末分化的,缺乏再生能力。糖尿病引发的高血糖可导致心肌细胞凋亡,心肌纤维化,甚至心功能不全等[9]。因此,对糖尿病引起的心肌损伤的研究具有重要的临床意义。高糖诱导活性氧簇(ROS)大量生成,是糖尿病心肌病发生和发展的重要因素。大量ROS的产生,可作用于细胞膜脂质,产生脂质过氧化物MDA,引起细胞损伤,MDA含量可反映细胞氧化损伤程度;超氧化物歧化酶(SOD)是重要的抗氧化酶,可清除ROS,其活性反映细胞的抗氧化能力。因此,丙二醛(MDA)和超氧化物歧化酶(SOD)是评价氧化应激程度的常用标记物。他汀类药物对多种疾病的发病率和死亡率均有临床益处,尤其是糖尿病[10-12]。已有报道称,他汀类药物的多效性能降低重症糖尿病患者的死亡率[13-15],在糖尿病心肌病中,他汀类药物可以预防心血管重构的发展,同时也限制葡萄糖不耐症的进展以及炎症/纤维化细胞因子生成[16]。本研究采用SD大鼠作为观察对象,给予链脲佐菌素(STZ)腹腔注射建立糖尿病模型来观察糖尿病对大鼠心肌细胞造成的损伤。我们的结果显示DM组大鼠心肌组织SOD活性较control组明显下降(P<0.01),MDA含量较control组显著升高(P<0.01);心肌细胞明显排列紊乱,结构不清,细胞出现水肿、空泡变性、有大量炎性细胞浸润;心肌组织凋亡细胞阳性率显著增加(P<0.01),证实糖尿病引起的高血糖确实引起了大鼠心肌细胞的损伤、炎症、氧化应激和细胞凋亡的发生。给予辛伐他汀后,DM+S组大鼠心肌SOD活性明显增加,MDA含量下降,且差异均具有统计学意义(P<0.01);心肌细胞结构恢复清晰状态,病理损伤明显改善;细胞凋亡发生率明显降低(与DM组相比较,P<0.01),证实辛伐他汀可明显减轻大鼠糖尿病所致心肌损伤程度,缓解心肌的炎症反应、抑制氧化应激和心肌细胞凋亡的发生,起到对心肌的保护作用。
ROS产物的积聚和氧化应激在心肌细胞凋亡的发生和发展中有重要作用。p53作为核转录因子,激活多种基因并参与细胞周期、DNA修复、细胞凋亡,是细胞存活和死亡的关键因素[17]。p53的多个磷酸化位点中,ser-15位点的氨基末端的丝氨酸磷酸化p53磷酸化可增加p53的稳定性和细胞凋亡活性[18]。有报道称[19],高血糖引起的ROS的产生,可激活p53,p53激活后磷酸化,激活丝氨酸15位点,并从胞质向细胞核移位,随后引起凋亡的发生。p53蛋白可通过调节参与线粒体凋亡通路的多种凋亡相关转录因子的表达而诱导细胞凋亡。Bcl-2,Bax是p53和NF-κB的下游蛋白。p53能增加Bcl-2的表达,降低Bax的表达,进而促进细胞凋亡。Bcl-2阻止线粒体细胞色素C释放。Bax增强细胞色素C从线粒体向血浆的释放,诱导线粒体通透性转换[20]。本实验通过免疫组织化学方法检测了三组大鼠心肌组织中p53蛋白的分布与表达,发现p53主要表达于核内,与control组相比,糖尿病组大鼠p53表达均明显增加(P<0.01),给予辛伐他汀治疗后p53表达减少,且p53在胞核内分布明显减少(P<0.01);Western blot结果显示糖尿病组较control组p53,p53-phospho-serine15, Bax的表达增加(P<0.01),Bcl-2表达减少(P<0.01),给于辛伐他汀后p53(P<0.01),p53-phospho-serine15(P<0.01),Bax(P<0.05)表达明显减少,Bcl-2(P<0.05)表达增加,进一步验证了免疫组织化学的结果。综上所述,辛伐他汀可通过增加SOD活性、抑制MDA的产生,降低p53,p53-Phospho-Serine15,Bax,增加Bcl-2蛋白的表达来抑制糖尿病引起的心肌细胞凋亡,从而改善心肌结构异常、缓解糖尿病造成的心肌损伤。本实验通过探究辛伐他汀对糖尿病心肌病发病机制的作用,为临床预防和治疗DCM提供新思路。
