Tctex-1基因对肾癌786-O细胞生物功能影响及其机制研究
2018-02-13汪宁王荣江钟欢汤建儿陈煜高建国
汪宁 王荣江 钟欢 汤建儿 陈煜 高建国
肾癌是泌尿生殖系统最常见的恶性肿瘤之一,其发病率约占全身恶性肿瘤的3%[1]。肾癌缺乏放化疗敏感性,治疗方式以根治性手术为主,如出现远处转移则延误最佳治疗时机[2],因此寻找有效的肾癌标志物对指导疾病诊断、治疗及判断预后都具有重要的临床意义。动力蛋白轻链家族包括Tctex-1(Dynlt-1)、Dynlt-3、Dynll-1、Dynll-2、Dynrb-1、Dynrb-2。Tctex-1的编码基因位于6q25.2,分子量12 kDa,含有113AA,是由2个α螺旋和4个β链组成的二聚体。它主要富集在间质成纤维细胞的高尔基体上,同时在间期微管和核膜上也能检测到[3]。文献报道Tctex-1参与人乳头瘤病毒等感染从而影响宫颈癌的发生过程[4],然而,Tctex-1与肾细胞癌的作用机制尚不明确。本研究通过沉默Tctex-1基因观察对肾癌786-O细胞的增殖、迁移及侵袭能力的影响,并探索其下游信号通路,为肾癌的治疗提供可能的靶点。
材料与方法
一、材料
Tctex-1、Wnt和VDAC1抗体购自英国Abcam公司;786-O细胞株购自中国科学院上海细胞库;脂质体LipofectamineTM2000购自美国Invitrogen公司;细胞增殖-毒性检测试剂盒(Cell Counting Kit-8,CCK-8)购自日本同仁化学株式会社;Transwell小室购自美国Corning公司;Matrigel基质胶购自美国BD公司。
二、体外化学合成小干扰RNA(siRNA)
应用Ambion公司提供的网上在线工具设计Tctex-1特异性的siRNA。序列:5′-TCAGATGGACAGTCCGAAGG-3′(反义),5′-ATGCGTTAAAGATGGAAGACTTC-3′(正义)。
三、细胞转染与实验分组
常规消化收集细胞后,将细胞接种于6孔培养板。待细胞生长至密度为70%~80%时,按照LipofectamineTM2000说明书进行转染。实验分为Tctex-1-siRNA转染组及阴性对照组。
四、Western blot检测Tctex-1、Wnt和VDAC1蛋白表达水平
转染48 h后收集细胞,提取总蛋白,按每条泳道总蛋白30 μg加样,于SDS-PAGE凝胶电泳后转至PVDF膜,5%脱脂奶粉封闭2 h,一抗4 ℃孵育过夜,二抗室温孵育2 h,ECL化学发光试剂(美国ProteinSimple公司)检测结果。
五、CCK-8检测Tctex-1对786-O细胞增殖能力的影响
将转染48 h后的786-O细胞以200 μl/孔(约5×103个细胞)铺于96孔板,置于37 ℃、5% CO2培养箱中继续培养,并分别在细胞贴壁后的1、2、3、4 d后按照CCK-8说明书向各孔中加入CCK-8与无血清培养液(1∶10)混合物110 μl,避光孵育30 min后于酶标仪450 nm波长处检测每孔的光密度(OD)值。
六、Transwell实验检测786-O细胞迁移及侵袭能力
24孔板中先加入600 μl含20%胎牛血清的对应培养液,取200 μl(1.5×108/L)转染48 h后的细胞悬液加入Transwell小室,侵袭实验取200 μl(2.0×108/L)的转染48 h后的细胞悬液加入Transwell小室,事先将Matrigel胶与无血清培养液按1∶6比例稀释配制出混合液,取50 μl混合液平铺于Transwell小室中。将小室放入有培养液的24孔板中,继续培养12 h后取出小室吸干其中的液体,移到90%甲醇中固定30 min,用结晶紫染色30 min,用棉签擦净小室底部,然后将小室倒过来背朝上晾干,于显微镜下拍照,取5个随机视野,统计每个随机视野中的细胞个数。
七、统计学方法

结 果
一、Western blot检测786-O细胞中Tctex-1、Wnt和VDAC1蛋白的表达
转染组(Tctex-1-siRNA组)中Tctex-1蛋白的相对表达量为(0.185±0.041),对照组(NCi组)为(0.762±0.065);Tctex-1-siRNA组中Wnt蛋白的相对表达量为(0.302±0.034),NCi组为(0.819±0.049);Tctex-1-siRNA组中VDAC1蛋白的相对表达量为(0.208±0.051),NCi组为(0.688±0.050)。Western blot检测结果显示,与NCi组相比,Tctex-1-siRNA组中Tctex-1、Wnt和VDAC1蛋白表达量明显降低,差异有统计学意义(P<0.01)(图1)。
二、CCK-8法检测Tctex-1基因对786-O细胞增殖能力的影响
CCK-8实验结果显示,在2、3、4 d 3个时间点Tctex-1-siRNA组OD值与NCi组相比,差异有统计学意义(2 dP<0.05,3、4 dP<0.01)(图2)。表明沉默Tctex-1基因的表达,786-O细胞增殖能力明显降低。
三、Transwell实验检测Tctex-1基因对786-O细胞迁移及侵袭能力的影响
如图3所示,Tctex-1-siRNA组中迁移细胞数为(63±6)个,NCi组中迁移细胞数为(132±11)个,差异有统计学意义(P<0.01);而Tctex-1-siRNA组中侵袭细胞数为(45±5)个,NCi组中侵袭细胞数为(105±9)个,差异亦有统计学意义(P<0.01)。表明沉默Tctex-1基因的表达,786-O细胞迁移及侵袭能力明显降低。
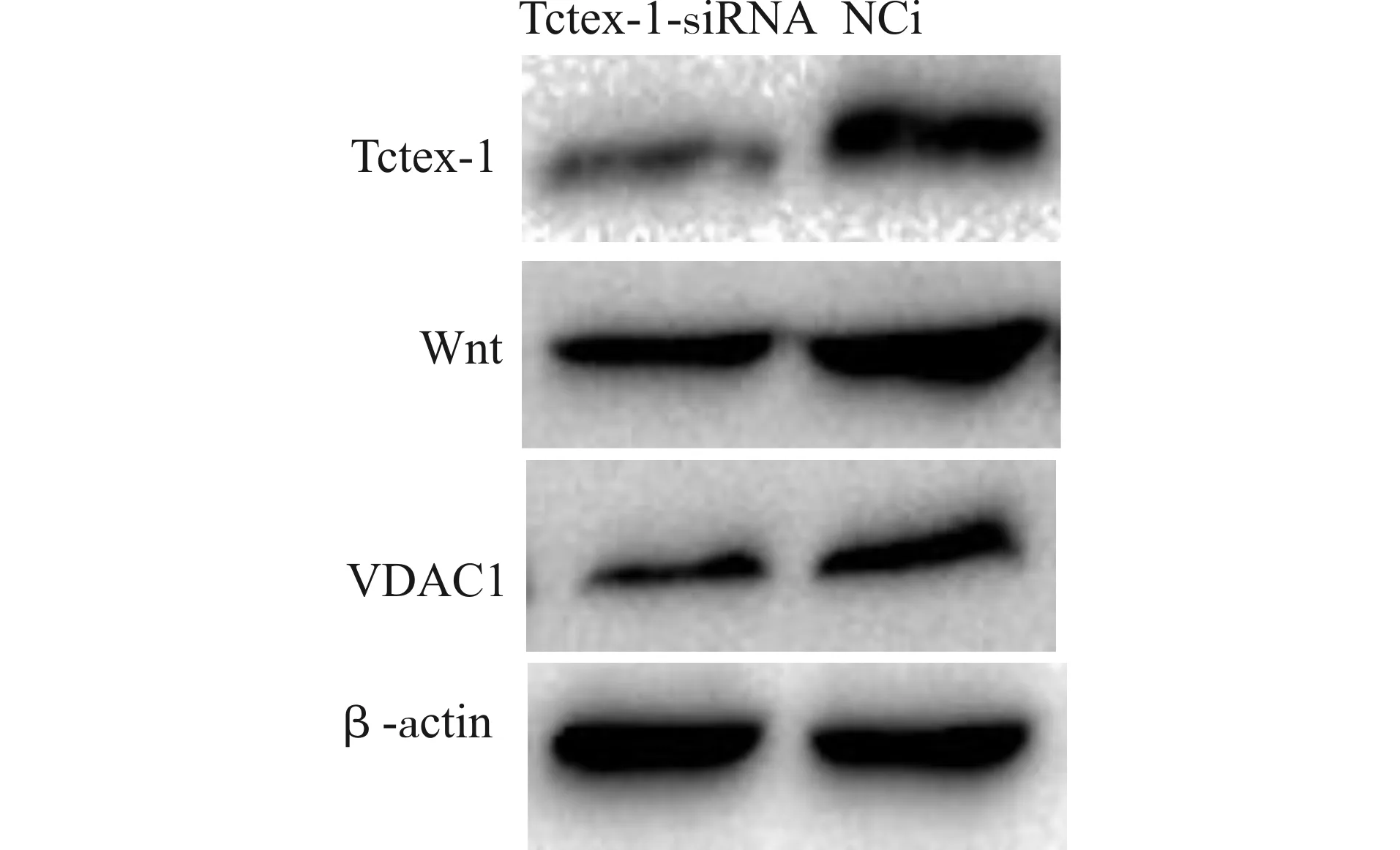
图1 Western blot检测Tctex-1-siRNA组与NCi组中Tctex-1、Wnt及VDAC1蛋白表达

图2 CCK-8法检测Tctex-1-siRNA组与对照组中细胞增殖能力情况(*P<0.05;**P<0.01)

图3 Transwell实验检测Tctex-1-siRNA组与NCi组中细胞迁移及侵袭能力情况(×400)
讨 论
胞质动力蛋白是由轻链、中间链、重链等组成的多亚基蛋白复合体,能将生物能转化为机械能,通过微管运动进行物质运输。在有丝分裂中胞质动力蛋白可促进中心体分离、核膜解体、纺锤体组装[5-6];还能与动力激活蛋白相结合,从而驱动染色体分离以及膜性细胞器运输。Tctex-1作为一种重要的细胞因子,参与多个生物学过程,如介导逆行囊泡运输、参与直接的物质运输、参与免疫功能调节、病毒感染、细胞的破骨过程等,同时也参与多种肿瘤的发生、发展及迁移过程[7]。研究发现Tctex-1在90%的乳腺癌中高表达,并作为p21活化酶1的底物,与Pak1形成复合物促进乳腺癌发生、生长及乳腺癌细胞存活[8],提示Tctex-1可能是一种促癌因子。
利用免疫共沉淀实验发现Tctex-1和VDAC1有相互作用,并且通过免疫荧光技术发现Tctex-1与VDAC1密切相关[9]。Tctex-1与VDAC1的相互作用能在缺氧的环境抑制线粒体通透性增加。而多种恶性肿瘤的VDAC1表达增加与HK结合产生抗凋亡作用,肿瘤细胞处于一种缺氧环境,这提示在肿瘤的发生、发展中可能有Tctex-1与VDAC1的相互作用使肿瘤抗凋亡。而本研究中发现Tctex-1-siRNA转染组中VDAC1蛋白表达量明显降低,这提示抑制Tctex-1表达能抑制下游通路因子VDAC1表达,从而影响肿瘤细胞凋亡与侵袭。
通过酵母双杂交实验发现Tctex-1与Dkk-3相互作用。免疫荧光实验发现Tctex-1与Dkk-3共定位于人成纤维细胞的内质网附近[10-12]。研究表明Dkk-3是Wnt信号通路的拮抗因子,Dkk-3可通过Wnt/β-catenin经典通路来抑制肿瘤发展[13]。而本研究中发现Tctex-1-siRNA转染组中Wnt蛋白表达量明显降低,这提示Tctex-1可能与Dkk-3相互作用,从而作用于下游通路信号因子Wnt,影响肿瘤细胞增殖与转移。
本研究利用脂质体瞬时转染方法干扰786-O细胞中Tctex-1蛋白表达,结果显示Tctex-1对肾癌细胞的增殖、迁移和侵袭具有调控作用。Tctex-1-siRNA转染组中Tctex-1蛋白表达低于阴性对照组,说明Tctex-1-siRNA成功抑制了786-O细胞中Tctex-1蛋白表达。在此基础上,进一步利用CCK-8法、细胞迁移及侵袭实验观察了抑制Tctex-1蛋白表达对786-O细胞增殖、迁移和侵袭能力的影响,研究发现沉默Tctex-1蛋白后786-O细胞增殖、迁移和侵袭能力受到抑制,说明Tctex-1作为促癌基因存在,这为Tctex-1成为肾癌的潜在治疗靶点提供了实验依据,也为探讨Tctex-1参与肾癌发生、发展作用机制搭建了研究基础。
本研究从生物功能上证实沉默Tctex-1基因表达可以有效抑制肾癌细胞的增殖,降低其迁移及侵袭能力,从机制上证实沉默Tctex-1基因可以有效抑制下游信号通路因子Wnt、VDAC1基因表达。由此可见Tctex-1基因与肾癌具有相关性,干扰Tctex-1基因的表达可能成为治疗肾癌的一个新靶点,下一步工作将从肾癌的组织表达以及动物实验做进一步深入探讨。
