H9N2亚型禽流感可疑病料的病毒分离及初步鉴定
2018-02-13刘宇卓刘青涛赵冬敏黄欣梅韩凯凯毕可然
杨 婧, 刘宇卓, 刘青涛, 赵冬敏, 黄欣梅, 韩凯凯, 毕可然, 李 银
(江苏省农业科学院兽医研究所,江苏南京 210014)
禽流感(avian influenza,简称AI)是由正黏病毒科(Orthomyxoviridae)A型流感病毒属A型流感病毒中任一亚型引起的家禽、野鸟和部分哺乳动物发病的一种传染病[1-2]。高致病性禽流感会引起家禽高发病率及死亡率,而低致病性禽流感则会导致家禽出现呼吸道症状、生长发育受阻及产蛋下降等,严重危害养禽业的健康发展[3]。根据A型流感病毒表面糖蛋白血凝素蛋白(hemagglutinin,简称HA)和神经氨基酸酶(neuraminidase,简称NA)的抗原性不同,可分为不同的亚型,目前已发现18种HA亚型、11种NA亚型,其中H17N10、H18N11仅在蝙蝠中被分离鉴定[4-5]。根据禽流感的致病性不同又可分为高致病性禽流感(HPAI)、低致病性禽流感和无致病性禽流感[6]。由H5、H7亚型毒株引起的禽流感一般称为高致病性禽流感,其发病率和病死率都很高,危害极大[7-8],被世界动物卫生组织(Office International Des Epizooties,简称OIE)列为必须报告的动物传染病,我国将其列为一类传染病,可见其对生物界的危害。而禽类中暴发的低致病性禽流感亚型主要为H5N2、H9N2亚型。
H9N2禽流感病毒呈世界性分布,按地区可分为北美和欧亚2个种系[9]。我国于1994年首次从鸡体内分离出H9N2亚型禽流感病毒[10],近些年来,我国每年均可分离到大量H9亚型禽流感病毒,临床上感染鸡的症状,常可见蛋鸡产蛋下降、肉鸡生长发育迟缓甚至死亡的现象,给养禽业造成较大的经济损失。
自2004年以来,以H5N1亚型禽流感为代表的高致病性禽流感的暴发引起了我国政府和相关行政主管部门的高度重视,但与此同时,对低致病性禽流感主要是H9亚型的预防及控制却被忽视了,养禽场(户)对H9亚型低致病性禽流感疏于防范,对其认知程度和免疫接种理念较差,造成了H9亚型在全国范围内的普遍流行及持续性危害。目前,H9亚型逐渐成为影响我国养禽业的主要禽流感病毒亚型,且对禽的危害越来越严重,可感染家禽并导致家禽产蛋量下降、免疫抑制病,与其他病原共感染时会导致家禽较高的死亡率,给我国养禽业造成了巨大的经济损失。同时H9亚型禽流感病毒(AIV)可以感染人、猪等哺乳动物,在公共卫生上具有重要意义。
1998年在广东省韶关市和汕头市分别发现4例和5例H9N2禽流感病毒感染的病例[11],为全球首次发现的人H9N2禽流感病毒感染病例。2013年2月在上海市出现了第1例人感染H7N9禽流感病毒的病例[12],随后该H7N9禽流感病毒席卷了我国大部分地区,对这次暴发的H7N9禽流感病毒进行溯源发现,它主要由4个不同来源的流感病毒重配而成,其内部基因则来源于存在于我国家禽中的H9N2亚型的流感病毒[13]。截至2017年1月31日,我国已确诊的H7N9感染病例为1 069例,有410人死亡[14]。由此可见,H9N2亚型禽流感具有重要的公共卫生意义,值得引起公众的注意。
本研究旨在初步分离并鉴定来自江苏省某地区的可疑病料,用易感动物回归试验为禽类生产提供有效的诊断意见,以便及时诊断及免疫防控,从而减少禽流感H9亚型发生时所带来的巨大经济损失。
1 材料与方法
1.1 材料与仪器
病鸡来源于江苏省某地区养殖场。0.22 μm微孔滤膜过滤器(默克密理博有限公司);生理盐水,由笔者所在实验室自制,pH值为6.8~7.0;1%鸡红细胞溶液,笔者所在实验室自制,现用现配;9~11日龄无特定病原体(specific pathogen free,简称SPF)鸡胚(南京天邦生物科技有限公司);反转录酶(M-MLV)、RNase Out、10 mmol/L dNTP、5×buffer、10×PCR buffer、2.5 mmol/L dNTP、25 mmol/L MgCl2、聚合酶(E×Taq)等(TaKaRa公司);琼脂糖(上海吉玛制药有限公司);RNA/DNA提取试剂盒和胶回收试剂盒(康宁生命科学有限公司);PCR仪、离心机(TaKaRa公司);电泳仪(南京普阳科学仪器研究所);全自动凝胶成像分析仪(JS-680B,上海培清科技有限公司);高压锅(SY-450,徐州圣业医疗器械有限责任公司);剪刀、镊子、研钵(南京源奇顿生物科技有限公司);打孔器、注射器(通州市张芝山镇丰泰实验器材经营部);超净工作台(广州佰伦超净工作台制造有限公司);-70 ℃ 冰箱、-20 ℃冰箱(青岛海尔股份有限公司)。
1.2 试验方法
1.2.1 病理剖检 主诉病鸡症状:该养殖企业采用标准化鸡舍饲养,使用全价料和自配料饲喂,近期陆续出现产蛋率下降、蛋壳褪色与变薄、少数病鸡眼角分泌物增多、脸面肿胀、有轻度的呼吸啰音、精神沉郁、下痢、采食量下降等症状,个别病禽出现腹泻,严重者食欲废绝,饮水量增加,嗉囊中积有液体,鸡群逐渐出现营养不良、消瘦等症状。发病初期饲养员以为是传染性支气管炎,采用磺胺类药物治疗,效果不明显。
将病鸡置于解剖台,用75%乙醇消毒体表,分别用高压后的手术剪、镊子解剖,记录各个脏器的眼观症状。
1.2.2 病料处理 分别用高压后的手术剪解剖,无菌采集3份病鸡的心脏、肝脏、肺脏、小肠、喉头、气管、脾脏、肾脏等脏器,每份鸡的上述脏器混合在一起研磨作为1个病料。置于高压灭菌后的研钵中进行研磨,充分研磨后按体积比1 ∶3加无菌生理盐水,置于-20 ℃冰箱中反复冻融3次。再次研磨后,8 000g离心5 min,取上清,用0.22 μm滤器过滤后,保存备用。
1.2.3 病毒RNA的提取 分别无菌取出“1.2.2”节中提到的样品200 μL,置于高压灭菌后的1.5 mL离心管中,按照RNA/DNA提取试剂盒说明书,加入200 μL蛋白去除液 V-L 试剂后,在涡旋振荡仪上混匀,静置5 min;加入75 μL V-N试剂,用涡旋振荡仪混匀,12 000g离心5 min;取上清加在新的2 mL离心管中,再加入300 μL异丙醇(含无水乙醇),上下倒置混匀,转移至新的含有吸附柱的2 mL离心管中,6 000g离心 1 min;弃滤液,加入500 μL buffer W1(含无水乙醇),12 000g离心1 min;弃滤液,加入800 μL buffer W2(含无水乙醇),12 000g离心1 min;弃滤液,12 000g离心 1 min;将吸附柱置于新的1.5 mL离心管中,加入15 μL洗脱液TE试剂后,静置1 min,12 000g离心1 min,即得到提取的总RNA和DNA。
1.2.4 病毒RNA的反转录(RT)和PCR扩增 反转录体系:12 μL RNA、2 μL 10 mmol/L dNTP、4 μL 5×buffer、1 μL Unit 12、1 μL M-MLV、0.5 μL RNase Out。反转录程序:65 ℃ 5 min,42 ℃ 60 min,98 ℃ 5 min。
PCR扩增体系:2.75 μL cDNA、2.00 μL 2.50 mmol/L dNTP、2.50 μL 10×Buffer、14.00 μL ddH2O、1.50 μL 25 mmol/L MgCl2、0.25 μL E×Taq、1.00 μL上游引物P1、1.00 μL下游引物P2。PCR扩增引物:禽白血病(ALV)特异引物、鸡传染性贫血(CAV)特异引物、鸡网状内皮组织增殖病(REV)特异引物、H9 AIV特异引物、H5 AIV特异引物、新城疫(ND)特异引物、鸡传染性支气管炎(IB)特异引物。PCR扩增程序:95 ℃ 3 min;95 ℃ 30 s,52 ℃ 30 s,72 ℃ 1 min,30个循环;-72 ℃ 10 min。
1.2.5 电泳和核酸胶纯化及测序 配制1%琼脂糖凝胶,进行电泳。调节电泳仪为稳压模式,于80 V下电泳30 min。将阳性条带切下后,用胶回收试剂盒纯化阳性条带,并送公司测序。
在紫外灯下切下含有目的DNA的琼脂糖凝胶,称质量后作为1个凝胶体积,加入3倍凝胶体积的buffer DE-A,混合均匀后于75 ℃加热,2~3 min混合1次,直至凝胶块完全熔化;加入0.5倍buffer DE-A体积的buffer DE-B,混合均匀;将此混合液转移到放置了DNA制备管的2 mL离心管中,12 000g离心1 min,弃滤液;将制备管重新置于2 mL离心管中,加入500 μL buffer W1(含无水乙醇),12 000g离心30 s,弃滤液;将制备管重新置于2 mL离心管中,加入700 μL buffer W2(含无水乙醇),12 000g离心30 s,弃滤液;用 700 μL buffer W2(含无水乙醇)于12 000g离心1 min,弃滤液;将制备管重新置于2 mL离心管中,12 000g离心1 min;将制备管置于洁净的1.5 mL离心管中,在制备膜中央加 25 μL ddH2O,室温静置1 min,12 000g离心1 min洗脱DNA。
1.2.6 基因的序列拼接及Blast 用DNAStar软件中的Seqman拼接得到基因序列,然后用美国国立生物技术信息中心(NCBI)的在线Blast系统比对序列。
1.2.7 病毒扩增 取用经0.22 μm滤器过滤后的病毒上清,每个鸡胚接种0.2 mL,尿囊腔接种9~11日龄无特定病原体动物(SPF)鸡胚,收集24 h后自然死亡的鸡的胚尿囊液,放置于-70 ℃保存备用。
1.2.8 易感动物回归试验 将扩增后的病毒尿囊液用无菌生理盐水稀释1 000倍,接种健康1月龄SPF鸡5羽,每羽滴鼻注射100 μL,同时以3羽同批次的健康SPF鸡作为空白对照,每羽滴鼻注射100 μL无菌生理盐水,观察并记录鸡的发病情况。于攻毒后3 d采集喉头、泄殖腔拭子,攻毒后7 d采集翅静脉鲜血,并于鸡发病后解剖,观察其病理变化。
1.2.9 血凝试验(HA试验)和血凝抑制试验(HI试验) 将攻毒后3 d采集的喉头、泄殖腔拭子,于-20 ℃反复冻融2次后取出,室温融化后,用吸水纸擦干拭子管壁,用涡旋振荡器混匀后,于4 ℃、3 000g离心5 min。将离心后的拭子置于冰盒中保存备用。
分别取喉头、泄殖腔拭子的上清接种9~11日龄SPF鸡胚,0.2 mL/胚,每个样品接种3枚SPF鸡胚,尿囊腔接种,收集24~72 h后自然死亡的鸡胚尿囊液,并用血凝试验检测其血凝价,收取最高血凝价鸡胚的尿囊液作为后续测序用的病毒液。
将攻毒后7 d采集的翅静脉鲜血于5 000g离心5 min,取上清,并将笔者所在实验室已有标准抗原H5、H9、ND按照国标GB/T 14926.54—2001《实验动物 血凝抑制试验》配制成4单位抗原,进行血凝抑制试验。
1.2.10 再次测序及进行序列比对分析 将收取最高血凝价鸡胚的尿囊液作为后续测序的病毒液,按照“2.3~2.6”节方法进行病毒的测序及序列比对分析。
2 结果与分析
2.1 病理剖检
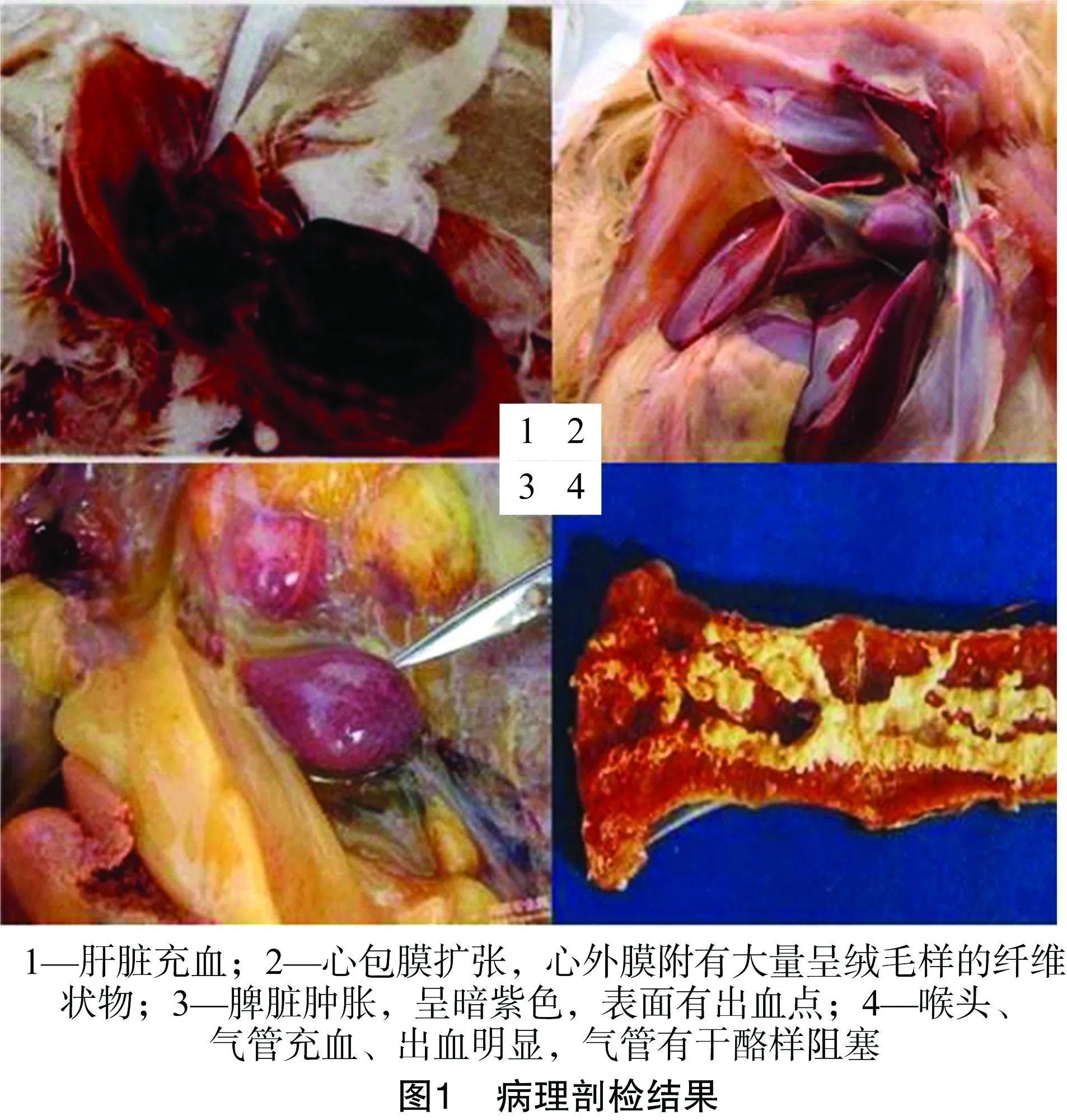
剖检前可见病鸡尸体消瘦,脸部苍白,羽毛松乱,腿爪干燥缺乏弹性,皮下瘀血,肌肉呈紫色。脸部肿胀者见皮下有白色或淡黄色胶冻样物浸润。剖检时发现病鸡肝脏充血;心包膜扩张,心包液混浊,心外膜附有大量呈绒毛样的纤维状物;脾脏肿胀,呈暗紫色,表面有出血点;喉头、气管充血、出血明显,气管有干酪样阻塞,腹膜混浊。具体剖检结果见图1。
2.2 病毒PCR扩增后电泳结果
3个样品分别用ALV特异引物、CAV特异引物、REV特异引物、H9特异引物、H5特异引物、ND特异引物、IB特异引物进行PCR扩增后,在1%琼脂糖凝胶上进行电泳。
由图2可知,病料2、3的H9扩增结果均为阳性,其中病料3的阳性带稍亮,对其切胶回收进行测序。病毒的易感动物回归试验均以病料3作为病毒来源。
2.3 基因序列拼接及Blast结果
用DNAStar软件中的Seqman拼接所得基因序列见图3,然后用NCBI的在线Blast系统比对序列,结果见图4。由序列分析及Blast分析结果可知,该病毒为H9N2亚型禽流感病毒。
2.4 易感动物回归试验
将扩增后的病毒尿囊液,用无菌生理盐水稀释1 000倍,接种健康1月龄SPF鸡,每羽鸡滴鼻注射100 μL。攻毒后鸡精神沉郁,攻毒后3 d时有稀便排出,偶有血丝;有轻度的呼吸急促症状。攻毒后5 d时没再发现稀便,饮水量增加,未见明显的采食量下降和体质量减轻。攻毒后7 d时基本未见其他临床症状。本次动物试验均无鸡死亡。
2.5 血凝试验和血凝抑制试验结果
把攻毒后3 d采集的攻毒组5只鸡和对照组3只鸡的喉头、泄殖腔拭子分别接种9~11日龄SPF鸡胚,每个样品各接种3枚SPF鸡胚,收取尿囊液后得出的血凝试验,血凝结果见表1。


用笔者所在实验室已有的标准抗原H5亚型禽流感病毒、H9亚型禽流感病毒、新城疫ND病毒对攻毒后7 d采集的血清按照GB/T 18936—2003《高致病性禽流感诊断技术》进行血凝抑制试验,血凝抑制结果见表2。
2.6 再次测序及序列比对分析
将收取最高血凝价(29)鸡胚的尿囊液作为后续测序的病毒液, 按照“2.3~2.6”节方法进行病毒的测序及序列比对分析,测序结果见图5。

表1 攻毒后3 d喉头、泄殖腔拭子接胚后的HA试验结果

表2 攻毒后7 d血清的HI试验结果
前后2次的测序结果用DNAStar软件中的MegAlign进行对比,分析结果见图6。由比对结果可知,前后2个病毒的同源性为99.9%,表明在易感动物回归试验中,该病毒未发生变化,前后一致。
3 讨论
H9N2亚型禽流感病毒可引起鸡群的呼吸道症状、产蛋下降并可提高其他病原的易感性。由于其致病性低,鸡感染后往往不易察觉。当存在不同的禽流感病毒共感染时,H9N2亚型禽流感病毒可以作为流感病毒基因传播的载体,提高禽流感病毒持续存在和发生变异的概率[15]。Guo于1998年7—8月从有类似流感症状的病人体内分离了5株H9N2,于1999年11月从另一名广东儿童体内分离到了H9N2病毒,由此可见其对公共卫生安全的影响不容小觑[16]。在本研究中,通过对H9N2亚型禽流感可疑病料的病毒分离、RNA提取和PCR基因扩增及基因测序等,证明出该可疑病料中确实含有H9N2亚型禽流感病毒,该方法操作简单,特异性较高,灵敏性较强,能快速检测出H9N2亚型禽流感病毒,是鉴定或检测流感病毒较为推荐的检测方法。


家禽感染H9N2亚型禽流感病毒一般有咳嗽、打喷嚏、啰音、喘鸣等呼吸系统症状,下痢和产蛋突然下降,轻微病变可见鼻的卡他性、纤维素性、浆液性或干酪样炎症,气管黏膜水肿,且有浆液性到干酪样的渗出物,气囊可能增厚,有纤维素性或干酪样渗出物,或者卡他性到纤维性腹膜炎和蛋性腹膜炎。在火鸡上多能见到盲肠炎和/或肠道的卡他性到纤维素性肠炎,产蛋禽的输卵管可能有渗出物[17]。在本研究中,将所研磨的病料用0.22 μm滤器过滤后,接种9~11日龄SPF鸡胚,收集尿囊液,进行易感动物回归试验时发现,攻毒后鸡虽有精神沉郁,排出稀便,间杂着血丝及有轻度的呼吸急促症状,但未见明显的采食量下降和体质量减轻,而且本动物回归试验中均无鸡死亡。这与临床生产不符,可能是因为生产中的鸡还感染了其他病原,与H9N2亚型禽流感病毒共感染时,加剧降低机体免疫力,同时增强其他病原的致病性[18],从而导致实际生产中发生鸡死亡现象。
禽流感的早期诊断对于控制疫情具有重要的意义,一般通过病禽的流行病学、临床症状、病理变化可作出禽流感的初步判断[19],但若须准确诊断,则须要检测禽流感病毒的抗原、基因或者分离鉴定病毒。目前对于禽流感的诊断主要有检测禽流感抗原,方法有血凝试验和血凝抑制试验、抗原捕捉酶联免疫吸附测定(enzyme linked immunosorbent assay,简称ELISA)、荧光抗体和免疫酶组化法等[20],检测禽流感基因的方法主要有逆转录PCR(RT-PCR)法和标记核酸探针原位杂交法,其中,尤以RT-PCR法较为敏感和特异。
此外,在生产中,应加强饲养管理,这是最根本的措施,是预防传染病的最好方式。应提供营养全价平衡的饲料,以增强禽体的体质。另外,应做好管理工作,每个禽场根据自己的具体情况来制定管理方案。认真执行各项隔离制度,防止传染源的传入与传播;定期消毒,降低环境中病毒的含量。一般对禽舍内外环境1周进行2次消毒。家禽场实施全进全出的饲养管理制度,避免各种日龄的家禽混养。建立有效的监测系统,及早发现有异常表现的禽类。一旦发生应立即通报,并果断采取隔离、封锁、扑杀等迅速切断传播途径的方法防止病毒的扩散。
