果糖补料与真菌诱导对南方红豆杉细胞悬浮培养的协同效应
2018-02-13徐志荣魏赛金
徐志荣, 魏赛金
(江西农业大学生物科学与工程学院/江西省农业微生物资源开发与利用工程实验室,江西南昌 330045)
南方红豆杉(Taxuschinensisvar.mairer)别称紫杉,为红豆杉科(Taxaceae)红豆杉属(Taxus)植物,其树皮中含有的紫杉醇是一种二萜类物质,对治疗肺癌、卵巢癌等有特定效果[1]。紫杉醇是一种植物次生代谢产物,以其高效、低毒及独特的抗癌机制得到了人们的青睐。紫杉醇主要是从红豆杉科红豆杉属植物的树皮中分离、纯化得到的,然而其天然资源极其有限,药源严重短缺[2]。
红豆杉细胞悬浮培养法是解决紫杉醇药源紧缺的一种很有前途的方法。培养过程中利用生物或非生物诱导处理细胞株,可以有效地促进红豆杉细胞合成紫杉醇。目前,诱导已经成为植物细胞和组织培养中提高次生代谢产物生产量的最有效的方法之一[3],不仅是植物细胞培养生产次生代谢物的重要手段,而且在缩短工艺时间、提高容器最大利用率方面的作用也非常明显[4]。然而,细胞次生代谢强度受到多种环境因素的影响,其中碳源是重要的一方面。培养基中的蔗糖大部分被降解成葡萄糖和果糖,蔗糖、葡萄糖和果糖的消耗和吸收呈现波动性,其中葡萄糖有利于细胞的前期生长以获得大量的生物量,果糖有利于细胞培养后期紫杉烷类化合物的合成[5]。前期研究表明,真菌诱导子在悬浮培养南方红豆杉细胞生产紫杉醇中具有良好的诱导效果。为了在反应器中提高外源真菌诱导子的诱导效应,本试验通过果糖补料对南方红豆杉细胞悬浮培养体系中生理状态变化的研究,探索红豆杉细胞放大培养的有效调控手段。
1 材料与方法
1.1 试验材料
红豆杉愈伤组织:以南方红豆杉一年生枝条为外植体诱导获得,传至5代以上。真菌DF:为笔者所在实验室自行分离保存的真菌。
1.2 试验方法
1.2.1 细胞种子液的制备 将愈伤组织接种于含有新鲜B5液体培养基[6]的三角瓶中,细胞接种量为5 g/瓶,装液量为50 mL/500 mL,接种量为10%(质量分数),于(24±1) ℃、120 r/min、黑暗条件下振荡培养7 d,作为细胞种子液。
1.2.2 真菌诱导子的制备 参照兰文智等的酸解法制备真菌诱导子[7]。收集真菌DF菌体于研钵中,充分研磨,加适量水并调节pH值至2.0,于121 ℃高压灭菌1 h,过滤收集滤液并调节pH值至5.8,即为诱导子。诱导子浓度以总糖含量计算,总糖含量以葡萄糖为标准,采用蒽酮-硫酸比色法[8]测定。
1.2.3 5 L反应器培养体系 采用5 L机械搅拌气升式玻璃反应器(上海百仑生物科技有限公司),装2.0 L B5液体培养基(含0.8 mL/L泡敌),接入细胞种子液,接种量为10%(体积分数),反应器培养温度条件为(24±1) ℃,搅拌转速为 60 r/min,通气量为1 L/min。在细胞培养8 d时加入10%果糖培养基(体积分数,将蔗糖换成等质量果糖,其他成分与B5液体培养基相同)和质量浓度为100 μg/mL的真菌诱导子,以只添加质量浓度为100 μg/mL的真菌诱导子为对照,每天取样检测。
1.3 项目测定
1.3.1 细胞活力的测定 用2,3,5-三苯基氯化四氮唑(TTC)法[9]测定细胞活力。抽滤除去培养基,取0.1 g红豆杉细胞,加5.0 mL 0.2%TTC溶液(用0.1 mol/L pH值=7.0的磷酸缓冲液配制),于24 ℃黑暗放置24 h,离心去上清,加入5 mL蒸馏水洗涤细胞2次后加入5 mL 95%乙醇,置于 60 ℃ 水浴中30 min,静置于室温下至细胞完全无色。取上清液,于485 nm处测吸光度,用吸光度表示细胞活力。
1.3.2 培养液pH值的测定 取滤液,用PHS-2型精密酸度计测定pH值。
1.3.3 胞外蛋白含量的测定 采用考马斯亮蓝法[10]测定。取1 mL滤液,加入5 mL考马斯亮蓝G-250溶液,混匀,放置2 min后,在595 nm下检测吸光度。以牛血清白蛋白为标准品绘制标准曲线:y=1.119 9x-0.079 2,r2=0.996 7。
1.3.4 胞外总酚含量的检测 参照文献[11-12]测定胞外总酚含量。取5 mL滤液,加入10 mL乙酸乙酯萃取2 h,烘干后加1 mL 95%乙醇重新溶解,与1 mL Folin-Ciocalteu试剂(使用时稀释10倍)混合,于40 ℃下水浴10 min,再加入 0.4 mL 7.5% Na2CO3溶液和5 mL蒸馏水,充分混匀,于 765 nm 下检测吸光度。以没食子酸为标准品绘制标准曲线:y=0.087 6x+0.000 6,r2=0.997 1
1.3.5 多酚氧化酶(PPO)样品制备及活性(鲜质量)测定 参照张月玲等的方法[13],取0.1 g固体细胞于预冷的研钵中,加5 mL 0.05mol/L磷酸缓冲液(pH值为6.8),在冰浴下研磨成匀浆,于4 ℃、4 000 r/min离心5 min,上清液即为粗酶液。在反应管中加入3.8 mL 0.05 mol/L pH值为6.8的磷酸缓冲液、1 mL 0.1 mol/L邻苯二酚、0.2 mL粗酶液,于35 ℃恒温水浴保温20 min,迅速冰浴,以磷酸缓冲液作为对照,在 398 nm 处测定吸光度。以1 min内398 nm处的吸光度变化0.01定义为1个PPO活性单位(U)。
1.3.6 紫杉醇的提取及测定 紫杉醇的提取及测定参照赵继鹏等的方法[6]。将固体细胞于45 ℃烘干至恒质量,充分研磨。准确称取100 mg干燥后的细胞,加2 mL甲醇,超声提取30 min,5 000 r/min离心5 min,取上清液,重复提取2次。合并上清液,于45 ℃烘干,浸膏加入4 mL双蒸水后用4 mL二氯甲烷萃取2次,合并二氯甲烷层,于25 ℃烘干,用3 mL甲醇溶解,在228 nm下测定样品吸光度。用紫杉醇标准品绘制标准曲线:y=20.83x+1.06,r2=0.997。
1.4 数据分析
用Excel进行数据整理,用Origin 8.5.1绘制图表。
2 结果与分析
2.1 细胞活力的变化
由图1可知,在细胞培养8 d后,加入真菌诱导子后的细胞活力下降得较快,在后续培养中,细胞活力上升平缓,且始终低于初始细胞活力;而在真菌诱导结合果糖补料的条件下,细胞活力下降较为平缓,在培养的11 d后,细胞活力开始逐步上升,在培养的14 d后,细胞活力高于初始细胞活力,增幅为9.34%。

2.2 培养液pH值的变化
由图2可知,在培养的8 d后,加入真菌诱导子后,培养液pH值降低。其中,只添加真菌诱导子的处理,pH值下降得更快,最大降幅为14.29%;加入真菌诱导子后进行果糖补料,pH值的下降较平缓。

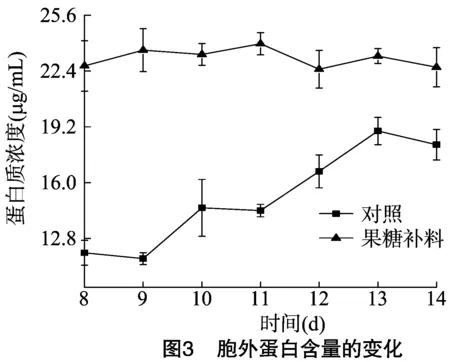
2.3 胞外蛋白质含量的变化
在培养的8 d后,只添加真菌诱导子,胞外蛋白质含量呈上升趋势,由诱导初期的11.98 μg/mL上升为培养后期的18.17 μg/mL,增幅为51.67%;在真菌诱导后进行果糖补料,胞外蛋白质含量培养在过程中基本保持不变(图3)。
2.4 胞外总酚含量的变化
由图4可知,加入诱导子后,胞外总酚含量在培养的9 d后开始上升,在培养后的11 d含量到达峰值,为 17.92 μg/mL,随后下降,最后趋于平稳。添加真菌诱导和果糖补料后,胞外总酚含量上升,在培养后的10 d达到峰值,为 26.27 μg/mL,随后下降,最后趋于平稳。

2.5 多酚氧化酶活性的变化
加入诱导子后,PPO活性在培养后的9 d达到峰值,为62.50 U/g,随后酶活性下降,在培养的13 d开始,酶活性趋于平稳;真菌诱导和果糖补料后,酶活性同样在9 d达到峰值,为106.17 U/g,随后酶活性下降,在培养的10 d后酶活性趋于平稳(图5)。

2.6 紫杉醇含量(干质量)
由表1可知,只加入诱导子时,紫杉醇含量首先逐渐下降,在培养10 d时为最低值,随后含量逐渐升高,在培养的 12 d 达到峰值26.38 μg/g,与培养8 d的初始值相比,增幅为 24.85%,12 d后,紫杉醇含量逐渐下降。而在加入诱导子的同时加果糖补料,紫杉醇的含量首先逐步升高,在培养12 d时到达峰值,为20.40 μg/g,与初始值相比紫杉醇含量增幅为170.56%,从培养13 d开始时紫杉醇含量逐渐下降。
3 结论与讨论
细胞活力与细胞线粒体活性成正比,线粒体活性越强,细胞代谢能力越强。在本试验中,加入真菌诱导子后,细胞活力下降,可能是由于诱导子对细胞的损伤使得细胞活力下降,细胞活力维持较低水平不变,而添加果糖后,细胞活力在后期逐步上升,说明悬浮培养后期果糖作为合适碳源,有利于保持细胞活力,提高代谢能力[14]。

表1 紫杉醇含量(干质量)
植物细胞对pH值具有较强的自我调控能力,而在本试验中加入诱导子,培养基pH值持续下降,这有可能是由于诱导子使胞内质子大量释放,从而导致培养基酸化;进行果糖补料后,可以减缓pH值的下降速率,这有可能是由于果糖可以减缓质子释放速率或者使质子内流而减缓pH值下降[15]。
用真菌诱导后,胞外蛋白含量逐渐升高,原因可能有2个方面:一方面可能因为细胞代谢增强,蛋白分泌增加,另一方面,可能是细胞膜通透性改变,其胞内蛋白被释放出来[16]。而细胞活力与代谢强度成正比,加入真菌诱导子后细胞活力持续下降,代谢强度较低,因此可见胞外蛋白含量上升不是由于分泌增加而是由细胞膜通透性改变引起的。细胞膜通透性改变可能是外源真菌诱导子处理的红豆杉细胞在显著提高紫杉醇产量的同时,也导致细胞中氧自由基含量的提高而发生细胞氧损伤,从而引起植物的过敏反应[17]。而加入真菌诱导子后进行果糖补料,胞外蛋白含量基本保持不变,这有可能是由于果糖可以减弱这种过敏反应。
诱导红豆杉细胞时,维持适当浓度的酚类化合物有利于紫杉醇产量的提高[18]。所以当培养体系中加入真菌诱导子后,胞外总酚含量上升,可能是细胞感受到真菌诱导子侵入而增加酚类化合物的合成以减少伤害;加入真菌诱导子后进行果糖补料能使酚类物质迅速积累,同时也能增加紫杉醇的含量。当酚类物质含量过高时,细胞通过提高PPO活性来降解酚类物质。
研究表明,在南方红豆杉细胞培养后期添加果糖能够解除细胞合成紫杉醇的碳源限制,从而有效地提高真菌诱导子的诱导效能[18]。Ketchum等研究发现,在培养周期的中期添加1%果糖,可以提高紫杉醇产量,缩短培养周期[19-20]。在本试验中,加入诱导子后,紫杉醇含量先下降后上升,上升到峰值后逐步下降,可能是诱导子在诱导初期对细胞的损伤而使紫杉醇合成受影响,细胞适应后,诱导子诱导细胞合成紫杉醇而使其含量上升。加入诱导子后进行果糖补料,紫杉醇含量上升没有受到诱导子的损伤而下降,可进一步说明果糖可以减弱诱导子对细胞的损伤或者可能是果糖在培养后期更适合用于合成紫杉醇。
因此可见,在用真菌诱导子诱导红豆杉细胞时,加入一定量的果糖可以缓解真菌诱导子诱导所引起的红豆杉细胞膜脂过氧化等不良反应,从而有利于细胞的生长和紫杉醇产量的提高。
