早期乳腺癌患者腋窝淋巴结转移因素的临床分析
2018-02-06单美惠马斌林
乔 雷, 董 朝, 单美惠, 马斌林
(新疆医科大学附属肿瘤医院乳腺头颈外科, 乌鲁木齐 830011)
乳腺癌是世界范围内女性发病率最高的恶性肿瘤[1]。腋窝淋巴结(axillary lymph node, ALN)状态对明确分期至关重要,腋窝分期是指导后续治疗的重要指标之一。腋窝淋巴结清扫术(ALN dissection,ALND)是评价ALN状态的金标准。20世纪90年代前哨淋巴结活检术(sentinel lymph node biopsy,SLNB)及Z0011试验的出现使前哨淋巴结活检阴性患者避免腋窝淋巴结清扫成为可能。2010年NCCN乳腺癌临床指南提出对Ⅰ、Ⅱ期cN0乳癌患者必须行SLNB,不能直接行腋窝淋巴结清扫数(ALND)[2]。随着对乳腺癌淋巴结转移方式的深入研究,腋窝淋巴结跳跃式转移(癌细胞能跳过低水平淋巴结而直接转移至高水平淋巴结)的现象逐渐受到重视。Kim等[3]研究发现腋窝淋巴结跳跃转移发生率约29.9%。若出现跳跃式转移,患者将被错误分期,可能接受不恰当的后续治疗,从而增加腋窝复发的机率。SLNB能否客观反映N分期是临床医师关注的问题。本研究通过分析cN0乳癌ALN状态和临床病理学资料间的关系,明确ALN阳性患者临床病理学特征,为外科医师对具有上述病理特点的患者在选择腋窝手术方式时提供理论依据。
1 资料与方法
1.1一般资料回顾性分析2016年1月-2016年7月于疆医科大学附属肿瘤医院乳腺头颈外科诊治的原发性乳腺癌患者190例。入组标准:(1)均为原发性乳腺癌,未接受新辅助放化疗及内分泌治疗,首次于我科手术;(2)术后病理诊断为浸润性导管癌;(3)腋窝触诊由高年资医师完成,完善乳腺及腋窝B超;以腋窝触诊及B超阴性定为cN0乳腺癌;(4)若患者SLNB阳性,进一步接受同侧ALND;(5)所有病例均有完善的临床及病理资料;依据以上标准最终纳入本研究的患者均接受SLNB,其中53例因SLNB阳性进一步接受ALND。收集患者的临床病理学资料:年龄、绝经状态、癌灶部位、大小、分子分型、脉管状态、激素受体及Her-2状态、Ki-67、组织学分级。
1.2病理诊断标准雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)、人类表皮生长因子受体2(human epidermal growth factor receptor-2,Her-2)及Ki-67(nuclcar-associated antigen,Ki-67)由免疫组织化学法判定,将ER或PR染色细胞数≥ 1%定为阳性;Ki-67以14%界定,染色细胞数<14%为低表达,≥14%为高表达;Her-2(+)及(++)经免疫荧光原位杂交法(fluorescence in situ hybridization, FISH)判读,若无Her-2基因扩增定义为Her-2阴性。
1.3超声诊断标准(1)腋窝淋巴结阴性:图像多为肾形,皮质薄,回声均匀;淋巴结门凹陷呈脂肪样高回声,淋巴结长短径比一般为2.0左右,最大长度<2.0 cm。(2)腋窝淋巴结阳性:图像多为圆形低回声;淋巴结门处脂肪图像模糊或缺失;周边存在环状血流信号[4]。
1.4统计学处理采用SPSS17.0统计软件进行数据分析,用χ2检验分析ALN状态与临床病理学资料之间的关系,明确ALN阳性患者的临床病理学特点;Logistic回归分析病理学特征对腋窝淋巴结发生转移的风险,以P<0.05为差异有统计学意义。
2 结果
2.1ALN转移的单因素分析单因素分析发现乳腺癌ALN转移分别与患者的绝经状态、ER状态、组织学分级、癌灶的位置、乳腺癌分子分型、肿瘤大小、合并脉管癌栓有关,差异有统计学意义(P<0.05);与年龄、Ki-67、孕激素状态3项临床病理治疗无明显相关性(表1)。进一步对年龄≥50岁组分析发现未绝经组ALN阳性率明显高于绝经组(P<0.05)(表2)。
2.2腋窝淋巴结(ALN)转移的多因素分析Logistic回归发现未绝经、ER阳性、 Her-2阳性、Ki-67≥14%、乳晕区癌灶、肿瘤大小、脉管内癌栓是预测ALN阳性的独立危险因子(P<0.05)(表3)。

表1 cN0乳腺癌患者腋窝淋巴结转移与临床病理特征的关系/例(%)

表2 ≥50女性患者绝经状态与乳腺癌腋窝淋巴结转移之间的关系/例(%)
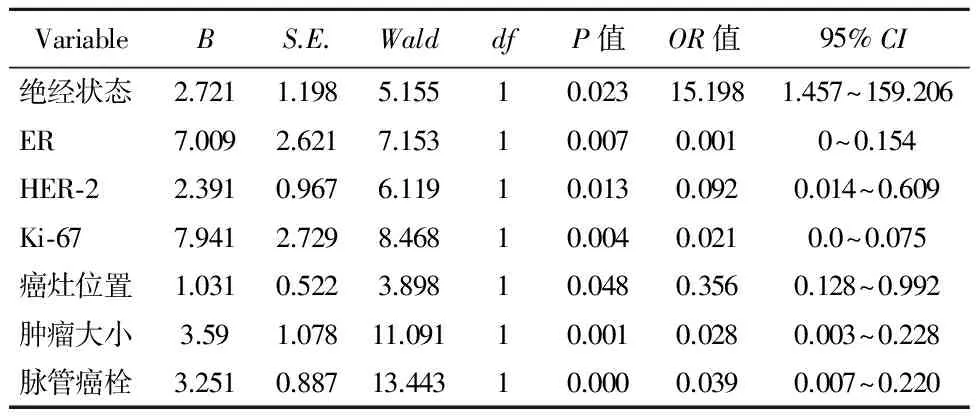
表3 多因素Logistic回归分析
3 讨论
国内研究发现超声对早期乳癌cN0 诊断准确率为51.5%~85.2%[5]。当肿瘤直径>2 cm时B超对ALN阳性的检出率明显降低,可能是由于随着肿瘤体积的增大,淋巴管被肿瘤或脱落的癌栓堵塞,引起腋窝淋巴回流改道;其次因无法区分肿大的淋巴结是恶性转移还是反应性增生,使得B超对腋窝淋巴结判断的灵敏度较低[6]。陈玉敏等[5]发现超声、钼靶X摄片、乳腺MRI三者联合检查时其准确率显著高于单一检测手段(P<0.05)。故对早期乳癌,建议多种方法检查联合,以减少术前ALN假阴性。
绝经状态是影响乳腺癌预后的重要指标。作为性激素依赖器官,乳腺的生长、发育受激素调控。绝经前女性高水平的雌激素可促进乳腺细胞过度增生易出现癌变;该研究中未绝经组ALN阳性率明显高于绝经组(54% vs 32%P<0.05)。说明绝经状态与早期乳腺癌ALN转移密切相关。
年龄与女性绝经状态有关,Schoenaker 等[7]通过荟萃分析发现亚洲女绝经年龄为48.0~52.0岁,欧洲女性为50.0~51.1岁。故本研究以50岁为界点,单因素分析发现年龄<50岁组与≥50岁组ALN阳性率无统计学意义(P>0.05);但进一步对年龄≥50岁组分析发现未绝经组ALN阳性率明显高于绝经组(P<0.05),绝经期推迟的的女性常与多次妊娠有关,研究发现妊娠2次以上的患者腋窝淋巴结阳性率明显高于1次的患者(P<0.05)[8]。妊娠期女性雌激素水平明显增高,而乳腺是性激素作用的靶器官,乳腺长期暴露于高激素水平的环境多次发育,淋巴管增生明显,淋巴管内皮细胞表面黏附分子暴露,若乳腺细胞发生癌变则更易出现淋巴结转移。另外妊娠期女性外周血T细胞数量下降使机体免疫功能降低,也可促进肿瘤扩散。
ER对雌激素有高度亲和力,其阳性表达能反映乳腺癌对雌激素的敏感性和依赖性,通常ER阳性的乳腺癌预后好,对内分泌治疗有效[9]。本研究与此相反,发现ER阳性组乳腺癌ALN阳性率明显高于其他组(P<0.05)。相关文献报道[10],LuminalB型乳腺癌最易发生腋窝淋巴结转移。由于该类型乳腺癌激素受体为阳性,提示ER的表达可能与腋窝淋巴结转移存在一定的联系,但目前不同分子分型乳腺癌与腋窝淋巴结转移关系仍存在争议,有待进一步扩充样本进行研究。
本研究中Her-2阳性表达率为25.2%,表达阳性组与阴性组ALN阳性率组差异有统计学意义(63% vs 37%P<0.01)。Her-2在细胞的生长,分化过程中发挥重要的调节作用。相关研究证实Her-2阳性通常是乳腺癌不良预后的指标[11-12]。
恶性肿瘤的组织学分级取决于其实质细胞的分化程度。分级越高,提示肿瘤分化越差,侵袭性越强。Unlu等[13]发现组织学分级高的乳腺癌多见于35岁以下的女性,并且与SLN转移、脉管侵犯、三阴性乳腺癌的发生密切相关。本研究发现Ⅱ级乳腺癌占总数的51%,腋窝淋巴结阳性率(49%)明显高于组织学Ⅰ级、Ⅲ级组,组间比较差异有统计学意义(P<0.01),其中Ⅱ级、Ⅲ级组Her-2过表达率明分别为24%,28%,明显高于组织学Ⅰ级组,与Her-2组腋窝阳性率趋势相似,这提示随着恶性肿瘤组织学分级的增高,肿瘤的侵袭性及腋窝淋巴结转移的几率也明显增加,故对于组织学分级较高的乳腺癌恶性肿瘤术中需仔细探查腋窝淋巴结状态,避免对阳性淋巴结的遗漏。
乳腺癌癌灶部位与ALN转移的关系目前尚无定论。Lim等[14]发现乳腺内下方的癌灶与ALN转移相关(P<0.05);乳腺外上象限出现癌灶为SLN转移的危险因素(P<0.05)。本研究中癌灶位于乳晕区的患者ALN转移率最高,其次为外上象限,组间比较差异具有统学意义(P<0.05)。乳腺淋巴管主要分布于皮下浅表组织,乳晕,乳头区最为丰富。乳腺内有两条主要的淋巴回流途径: 大部分淋巴液经胸大肌外侧缘淋巴管回流至腋窝淋巴结再流至锁骨下淋巴结;部分内乳区的淋巴结通过肋间淋巴管流向胸骨旁淋巴结。浸润性导管癌有向导管周边组织浸润的特点;而直径较大的癌灶易突破基底膜形成浸润灶,因乳晕区及外上象限的淋巴管丰富,故该区域的癌细胞沿淋巴管转移至腋窝淋巴结的几率较大。因样本量限制,其中位于乳腺内侧的癌灶例数相对较少,且均为我院2016年首诊的患者,对于不同部位的癌灶与ALN阳性率及术后复发率的关系,有待随访进一步分析。
脉管浸润是恶性肿瘤突破基底膜向周围组织转移的重要表现。在肿瘤生长早期其周边无滋养血管,当瘤体生长到1~2 mm时滋养血管开始生成,肿瘤一旦进入血管期,可获得加速生长的能力,易出现局部浸润和远处转移。本研究中脉管癌栓阳性组ALN阳性率为76%,明显高于脉管阴性组(P<0.05),而多因素分析中也发现脉管癌栓阳性与ALN转移密切相关,当患者常规病理结果提示脉管癌栓阳性时,即使SLNB阴性,腋窝淋巴结也存在较大转移风险,故对于该类型患者本作者建议将高水平的腋窝淋巴结纳入SLNB范围,避免转移阳性淋巴结的遗漏。
2011年St.Gallen国际乳腺癌大会根据免疫组化结果,将乳腺癌分为LuminalA、LuminalB、HER-2阳性、三阴型[15]。而LuminalB 型根据Her-2是否过表达又分为B1型(Her-2阴性),B2型(Her-2过表达)。不同亚型乳腺癌其SLN转移率存在差异。本研究发现Luminal B2型SLN转移率较高(75%),组间比较差异具有统计学意义(P<0.05)。与Her-2组SLN转移率趋势相同,提示Her-2能增加Luminal B型乳腺癌SLN转移风险。
综上所述,B超对于判断乳腺癌腋窝淋巴结转移精确度较低;通过卡方检验与Logistic回归分析,发现未绝经、ER高表达、HER-2过表达、Ki-67≥14%、乳晕区癌灶、肿瘤大小、脉管癌栓是乳腺癌腋窝淋巴结转移的独立危险因素。其中脉管癌栓最为重要。因本实验为回顾性分析,遵照乳腺癌临床指南,并未对前哨淋巴结活检阴性的患者进一步行腋窝淋巴结清扫术。基于乳腺癌腋窝淋巴结存在一定的跳跃转移几率,那么对于具有上述危险因素,尤其是LuminalB2型cT2N0乳腺癌,因其腋窝淋巴结转移风险高,在行全乳切除时,建议将高水平淋巴结纳入活检范围或考虑行ALND术,精确评估腋窝分期,为后续辅助化疗及内分泌治疗提供依据。
[1] 单美辉,木扎帕尔·阿不都克热木,姚雪梅.磷酸化mTOR及其下游分子4EBP1和S6K1在浸润性乳腺癌细胞中的定位表达研究[J].新疆医科大学学报,2014,3(3):280-283.
[2] 杨振林. 乳腺癌前哨淋巴结研究的状况与评价[J].中华临床医师杂志(电子版),2015,9(6):893-897.
[3] KIM W G, LEE J. Axillary skip metastases and the false-negative rate of sentinel lymph node biopsy in patients with breast cancer are related to negative ALDH-1 expression and Ki-67 expression[J].Surg Pathol, 2017,25(5):397-405.
[4] IBRHIM Z, GRANT C S, GLAZEBROOK K N, et al. Preoperative axillary ultrasound in breast cancer: safely avoiding frozen section of sentinel lymph nodes in breast-conserving surgery[J]. Am Coll Surgeons,2013,217(1):7-15.
[5] 陈玉敏 , 张江宇, 师锁江.高频彩超. 钼靶X线和乳腺MRI三者联合诊断早期乳腺癌[J].影像与介入,2013,10(13):93-94.
[6] 单美惠, 冷晓玲,姚雪梅, 等.触诊,B超和钼靶检查判断浸润性乳腺癌原发病灶准确性研究[J].新疆医科大学学报,2014,37(1):61-62.
[7] SCHOENAKER D A, JACKSON C A, ROWLANDS J V, et al. Socioeconomicposition.lifestyle factors and age at natural menopause:a systematic review and meta-analyses of studies across six continents[J].Int J Epidemid,2014,43(5):1542-1562.
[8] 秦双, 王雷, 王建国. 乳腺癌患者妊娠次数与腋窝淋巴结转移的关系研究[J].医学信息手术学分册,2008,21(7):594-604.
[9] 董朝,贺家勇,杨乐,等.乳腺浸润性导管癌肿PS2的表达及其与ER、PR的关系研究[J].新疆医科大学学报,2015,38(3):343-344.
[10] VAN B, Vanden I, DRIJKONINGEN M, et al. Axillary lymph node status of operable breast cancer by combined steroid receptor and HER-2 status :triple positive tumors are more likely lymph node positive[J].Breast Cancer Res Treat,2009,113(1):181-187.
[11] ONO M, TSUDA H, YOSHIDA M, et al. Prognostic significance of progesterone receptor expression in estrogen receptor positive , Her2-negative, node-negative invasive breast cancer with a low Ki-67 labeling index[J].Clinical Breast Cancer,2017,17(1):41-47.
[12] EHINGER A, MALMSTROM P, BENDAHL P O, et al. Histological grade provides Significant prognostic information in addition to breast cancer subtypes defined according to St Gallen 2013[J].Acta Oncologica,2017,56(1):68-74.
[13] UNLU O, KIYAK D, CAKA C, et al. Risk factors and histopathological feature of breast cancer among women with different menopausal status age at diagnosis[J]. J Buon,2007,22(1):184-191.
[14] LIM S T, CHOI J E, KIM S J, et al. Prognostic implication of the tumor location according to molecular subtypes in axillary lymph node-positve invasive ductal in korean population[J]. Breast Cancer Res Treat,2016,156(3):473-483.
[15] GOLDHIRSCH A, WOOD W C, COATES A S, et al. Highlights of the St. Gallen international expert consensus on the primary therapy of early breast cancer 2011[J]. Ann Oncol ,2011,22(8):1736-1747.
