氧化苦参碱对神经病理性疼痛大鼠实时步态行为学的影响*
2018-02-05王鑫蕊徐榕雪
王鑫蕊 杨 丽,2△ 徐榕雪
(1.辽宁中医药大学省部共建中医脏象理论及应用教育部重点实验室,辽宁 沈阳 110847;2.大连理工大学化工与环境生命学部制药科学与技术学院,辽宁 大连 116024;3.辽宁省本溪市金山医院药学部,辽宁 本溪 117000)
神经病理性疼痛是指因末梢神经至中枢神经系统的损害或疾病导致的痛觉过敏、痛觉异常,如坐骨神经痛、糖尿病性神经病变等引起的疼痛。这种疼痛在损伤痊愈后的数月至数年仍可持续存在[1-4]。近年来的研究表明,疼痛信号先激活外周感受器,引起动作电位进入DRG感觉神经元,从而引起膜去极化,激活电压依赖性钙通道(VGCCs)[5]。 VGCCs 分为低电压依赖性钙通道和高电压依赖性钙通道(HVDCCs)[6]。 其中 HVDCCs分为 L-型、N-型、P/Q-型及 R-型。
近年来有研究发现,氧化苦参碱可以显著提高经过部分坐骨神经结扎且鞘内注射L-型钙通道阻断剂硝苯地平的小鼠模型的机械缩足反应阈值ED50[7],且Nowycky等[8]研究发现在小鸡的背根神经节感觉神经元中,3种钙通道共存,L-型钙通道能持久强力的去极化。因此本研究选择L-型钙通道阻断剂硝苯地平,利用Cat Walk步态分析操作系统考察氧化苦参碱及L-型钙通道阻滞药对神经病理性疼痛大鼠模型步态行为的影响。Cat Walk步态分析操作系统是定量分析啮齿类动物模型脚步和步态的完整系统,该系统可用于评估神经性疼痛、脊髓损伤及恢复情况等,可直接检测到坐骨神经功能指数以及步态、足印等指标,借助计算机分析,阐明神经病理性疼痛大鼠行进行为的改变及硝苯地平对氧化苦参碱改善神经病理性疼痛大鼠的影响。同时,本研究将为拓展神经病理性疼痛大鼠的行为评价指标提供可靠依据。现报告如下。
1 材料与方法
1.1 实验动物 50只SD大鼠,体质量为(200±20)g,雌性。由辽宁长生生物技术有限公司提供,动物合格证号:SCXK(辽)2015-0001。所有动物实验均按照辽宁中医药大学实验动物管理条例施行。
1.2 试药与仪器 氧化苦参碱(纯度为99.01%,批号:150416,成都普菲德生物技术有限公司),称取0.105 g氧化苦参碱溶于10 mL的0.9%氯化钠注射液中,配成质量浓度为10.5 mg/mL的氧化苦参碱;硝苯地平(SLBD7789V,Sigma公司),称取 0.008 g硝苯地平溶于10 mL的乙醇中,配成质量浓度为0.8 mg/mL的硝苯地平。水合氯醛(批号:20110401,国药集团化学试剂有限公司);0.9%氯化钠注射液(批号:12082104,沈阳志鹰制药厂);乙醇(批号:20141224,天津市富宇精细化工有限公司)。CatWalk XT 10.6动物步态采集分析系统(Noldus公司,荷兰)。
1.3 分组与造模 将50只大鼠按随机数字表法分为假手术组、模型组、氧化苦参碱组、硝苯地平组和联合
给药组各10只,分笼饲养。参照Kim等[9]造模方法,建立脊神经结扎(SNL)模型。大鼠称体质量后,经10%水合氯醛(3.5 mL/kg)腹腔麻醉,置于俯卧位,腰部备皮,钝性分离左侧椎旁肌肉,暴露L5和L6神经,用6号丝线紧紧结扎神经后止血、缝合,并肌肉注射青霉素预防感染。 参照姜静、吴世星等[7,10]前期研究中实验动物给药剂量换算关系,氧化苦参碱按照150 mg/kg体质量的给药剂量、硝苯地平按照11.5 mg/kg体质量的给药剂量对部分坐骨神经结扎小鼠的神经病理性疼痛模型具有较强的抑制疼痛效果,因此本实验中各给药组大鼠按照1 mL/100 g体质量分别注射相应药物。氧化苦参碱组腹腔注射质量浓度为10.5 mg/mL的氧化苦参碱,硝苯地平组腹腔注射质量浓度为0.8 mg/mL的硝苯地平,假手术组和模型组分别腹腔注射等剂量的生理盐水作为对照。联合给药组腹腔注射氧化苦参碱、硝苯地平,质量浓度同前。
1.4 步态检测方法 训练方法:参照关亚兰等[11]方法,对大鼠进行为期3 d,每日3次的训练。将饲养的大鼠置于空鼠盒内并置于步态仪末端的鼠盒托架中,以建立熟悉的环境。大鼠置于仪器步行台跑道起始端,并从大鼠后方给予一定吹风刺激直至大鼠跑至末端暗盒中,并于其中适应30 s,如果该大鼠适应暗盒环境且未从暗盒的出口跳入下方的饲养鼠盒内,可人为将动物置于鼠盒中,认为完成了一次训练。按照此法对所有大鼠进行训练,直至所有的大鼠在无刺激的条件下能够不停顿地走过完整跑道。检测方法:训练后利用CatWalk XT步态分析系统分别采集各组大鼠步态行为数据,各动物分别进行3次实时自然步态行为录像,合格的录像须含有7~8个连续步数。氧化苦参碱组、硝苯地平组和联合给药组于训练后第7天给药,45 min后进行数据采集,采集指标如下:正常步序比、摆动时间、坐骨神经功能指数、足印长度、足印宽度、最大接触时间的最大强度、站立时间,利用CatWalk XT Version 10.6分析软件进行数据分析,取各指标均值。
1.5 统计学处理 应用SPSS17.0统计软件。计量资料以(±s)表示,组间比较采用方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1 大鼠身体协调性相关指标与坐骨神经功能指数比较 见表1,表2。身体协调性相关指标正常步序比、摆动时间中,假手术组与模型组相比,无显著变化;与模型组相比,氧化苦参碱组、硝苯地平组、联合给药组均未见明显差异(P>0.05)。与假手术组比较,模型组大鼠的坐骨神经功能指数显著下调(P<0.01);氧化苦参碱、硝苯地平、氧化苦参碱与硝苯地平联合给药分别使SNL大鼠的坐骨神经功能指数显著改善(P<0.01),且各组与模型组相比,差异均有统计学意义(P<0.01)。提示氧化苦参碱及硝苯地平对SNL神经功能病理性疼痛大鼠的坐骨神经功能指数有改善作用。
表1 各组大鼠正常步序比与坐骨神经功能指数比较(±s)

表1 各组大鼠正常步序比与坐骨神经功能指数比较(±s)
与假手术组比较,*P<0.05,**P<0.01;与模型组比较,△P<0.05,△△P<0.01。下同。
组 别 n 正常步序比 坐骨神经功能指数假手术组 10 92.78±12.96 -19.63±5.13模型组 10 87.39±13.06 -69.09±15.19**氧化苦参碱组 10 88.89±19.25 -35.50±4.35△△硝苯地平组 10 76.07±10.88 -45.46±7.24△△联合给药组 10 85.93±15.56 -35.29±5.83△△
表2 各组大鼠摆动时间比较(s,±s)
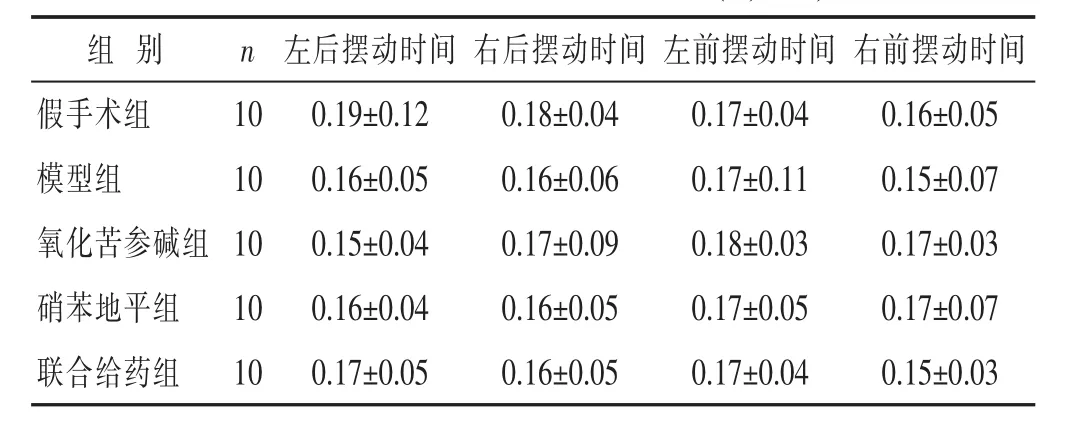
表2 各组大鼠摆动时间比较(s,±s)
组 别 n假手术组 10模型组 10氧化苦参碱组 10左后摆动时间 右后摆动时间 左前摆动时间 右前摆动时间0.19±0.12 0.18±0.04 0.17±0.04 0.16±0.05 0.16±0.05 0.16±0.06 0.17±0.11 0.15±0.07 0.15±0.04 0.17±0.09 0.18±0.03 0.17±0.03硝苯地平组 10 0.16±0.04 0.16±0.05 0.17±0.05 0.17±0.07联合给药组 10 0.17±0.05 0.16±0.05 0.17±0.04 0.15±0.03
2.2 大鼠足印压力的变化 见图1~图5。假手术组大鼠正常状态下四足分别接触跑道时,每足的足印大小及压力分布均匀(图1)。而SNL的神经病理性疼痛大鼠在行进过程中,结扎侧左后足(LH)足印明显变小,而结扎对侧的右前足(RF)足印变亮(图2),而未结扎侧右后足(RH)及结扎侧左前足(LF)的足印压力未见到明显变化,说明脊神经结扎使得SNL大鼠的结扎侧后足即LH足印压力变小,结扎对侧前足即RF足印压力增大,因此推断该SNL大鼠因单侧脊神经结扎而重心向对侧前移;给予氧化苦参碱、硝苯地平及联合给药后的SNL大鼠与模型组相比,行进时的LH足印增大,RF足印变小变暗(图3~图5),说明氧化苦参碱及硝苯地平使得SNL疼痛引起的足印及压力变化情况得到改善。实验结果提示氧化苦参碱及硝苯地平能够纠正SNL疼痛造成结扎侧LH足的压力变化及整体重心偏移。

图1 假手术组大鼠正常状态下四足的足印

图2 模型组大鼠行进时足印
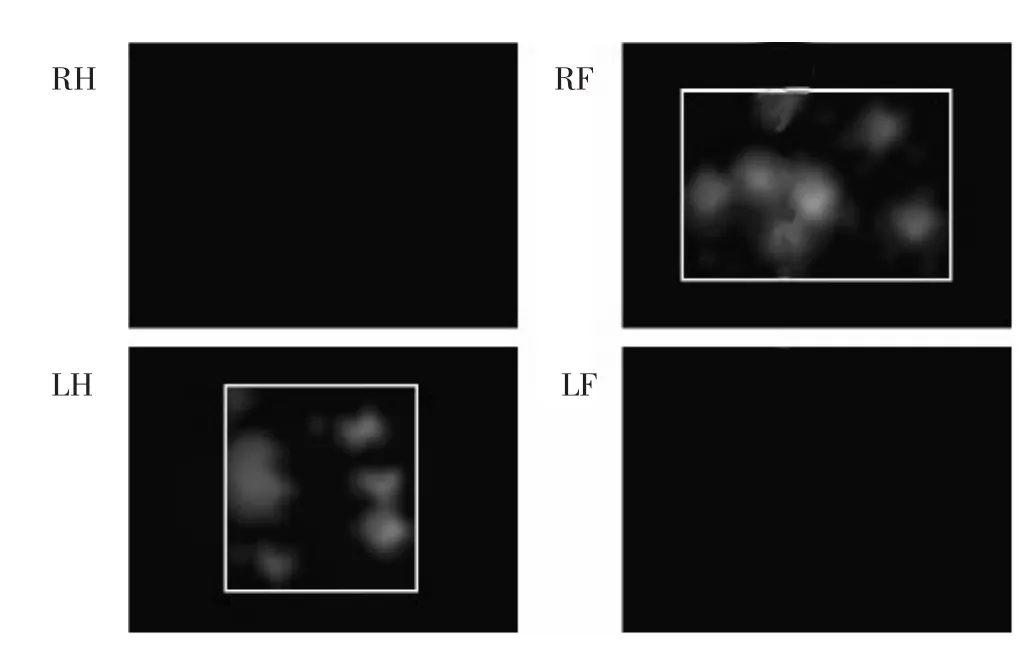
图3 联合给药组大鼠行进时足印

图4 硝苯地平组大鼠行进时足印
2.3 大鼠四足足印参数的改变 如表3~表6。与假手术组比较,模型组的LH足印长度、足印宽度、最大接触时间的最大强度、站立时间4项指标均显著下调,RF足印宽度显著上调(P<0.05);氧化苦参碱与硝苯地平联合给药使SNL大鼠足印长度指标在LH足显著上调,RF足显著下调(P<0.05);氧化苦参碱、硝苯地平、氧化苦参碱与硝苯地平联合给药使SNL大鼠LH足的足印宽度、最大接触时间的最大强度、站立时间 3项指标显著上调(P<0.05);同时可见氧化苦参碱与硝苯地平对SNL神经病理性疼痛大鼠LH足及RF足的足印长度呈现出部分加和作用(P<0.05)。

图5 氧化苦参碱组大鼠行进时足印
表3 各组大鼠足印长度比较(cm,±s)

表3 各组大鼠足印长度比较(cm,±s)
组 别 n假手术组 10模型组 10氧化苦参碱组 10 LH足印长度 RH足印长度 LF足印长度 RF足印长度2.12±0.17 2.13±0.21 1.40±0.28 1.28±0.30 1.64±0.16** 2.01±0.16 1.39±0.19 1.46±0.22 1.84±0.30 2.02±0.47 1.36±0.16 1.31±0.15硝苯地平组 10 1.69±0.18 1.83±0.18 1.44±0.33 1.35±0.17联合给药组 10 1.91±0.28△ 2.02±0.10 1.41±0.25 1.27±0.20△
表4 各组大鼠足印宽度比较(cm,±s)

表4 各组大鼠足印宽度比较(cm,±s)
组 别 n假手术组 10模型组 10氧化苦参碱组 10 LH足印宽度 RH足印宽度 LF足印宽度 RF足印宽度1.61±0.20 1.49±0.27 1.13±0.24 1.04±0.20 1.22±0.18** 1.38±0.28 1.13±0.18 1.20±0.22△1.45±0.13△ 1.43±0.20 1.14±0.13 1.05±0.12硝苯地平组 10 1.43±0.10△ 1.39±0.09 1.07±0.15 1.09±0.22联合给药组 10 1.48±0.26△△ 1.30±0.14 1.14±0.10 1.03±0.16
表5 各组大鼠最大接触时间的最大强度比较(±s)

表5 各组大鼠最大接触时间的最大强度比较(±s)
RF最大接触时间的最大强度103.95±13.73 96.34±18.15 95.44±9.60 90.16±16.97 68.26±18.40** 92.29±20.21 94.50±14.95 93.38±17.03 90.40±15.61△ 87.55±14.43 93.60±14.10 91.57±7.20硝苯地平组 10 92.33±11.72△ 82.43±9.58 86.20±12.56 90.69±7.50联合给药组 10 94.83±14.19△△ 85.30±11.33 96.87±11.20 91.83±11.29组 别 n LH最大接触时间的最大强度RH最大接触时间的最大强度LF最大接触时间的最大强度假手术组 10模型组 10氧化苦参碱组 10
表6 各组大鼠站立时间比较(s,±s)

表6 各组大鼠站立时间比较(s,±s)
组 别 n假手术组 10模型组 10氧化苦参碱组 10左后站立时间 左后站立时间 左后站立时间 左后站立时间0.27±0.03 0.24±0.06 0.18±0.06 0.19±0.06 0.01±0.01** 0.20±0.07 0.16±0.04 0.15±0.08 0.18±0.03△△ 0.22±0.03 0.18±0.01 0.20±0.05硝苯地平组 10 0.19±0.02△△ 0.25±0.01 0.18±0.08 0.15±0.08联合给药组 10 0.19±0.01△△ 0.24±0.09 0.19±0.05 0.21±0.07
3 讨 论
CatWalk全自动步态分析仪是一个包含软件及硬件的完整系统,它使用脚印光亮折射技术,利用高速摄像机从步行台下方捕获每一个脚步的细节,且能探测到四足的压力差异,从而检测动物重心的分配情况。并且能对运动失调、疼痛、神经损伤等研究领域进行步态行为评估[12-14]。步态分析中与神经病理性疼痛相关的指标主要有:坐骨神经功能指数、最大接触时间的最大强度、足印长度等,同时,有文献报道正常步序比、站立时间、摆动时间等参数可能与大鼠坐骨神经慢性压迫模型相关[15]。
本实验利用脊神经结扎的大鼠神经病理性疼痛模型(SNL模型),结合CatWalk全自动步态分析仪,采集大鼠足印并进行软件自动定量分析,评价药物对SNL神经病理性疼痛大鼠步态的影响,比啮齿类动物疼痛行为学研究中的面部表情疼痛量表及连续后足使用评分等方法[16-18]更客观更精确,是对啮齿类动物疼痛评估方法[18]的补充。
本实验利用CatWalk全自动步态分析仪采集大鼠的自然步态及足印,并自动定量分析大鼠的多项步态及足印参数指标,考察SNL神经病理性疼痛大鼠在自然行走中的步态参数变化。实验中的大鼠源于同一批次,且各组大鼠均经过随机挑选产生。经实验结果显示,假手术组大鼠的LH足与RH足相比,LF足与RF足相比,各参数均无显著性差异,因此我们认为其步态基数处于同一水平。模型组与假手术组比较,坐骨神经功能指数显著降低,与文献报道的SFI值越负,坐骨神经损伤越严重[19]相一致,说明 L5、L6脊神经结扎的SNL神经病理性疼痛模型成功建立,已使SNL大鼠的坐骨神经功能发生障碍,并影响到大鼠正常的步态行为。
HVDCCs钙通道阻断剂能选择性阻滞细胞膜钙离子通道,延迟失活态钙通道的恢复,减少钙离子内流,降低细胞内游离钙,阻碍敏感细胞的钙依赖性活动而产生相应药理作用[20]。其中L-型钙通道阻断剂Nimodipine可对抗糖尿病大鼠痛觉过敏反应[21-22],N-型钙通道阻断剂Ziconotide[23]已在美国上市用于神经病理性疼痛治疗,并有神经病理性疼痛一线治疗药物的钙通道调节剂加巴喷丁通过结合HVDCCs的辅助亚基而发挥镇痛作用。
近年来,本课题组通过系列研究证明[24-25]氧化苦参碱对神经病理性疼痛具有抑制作用并且发现该镇痛作用机制与HVDCCs有关。本实验中氧化苦参碱及L-型钙通道阻断剂硝苯地平均使SNL大鼠的SFI显著升高,表明氧化苦参碱及L-型钙通道阻断剂硝苯地平对神经病理性疼痛模型大鼠步态有明显改善作用。氧化苦参碱与硝苯地平联合给药能使SNL大鼠LH的足印长度显著增长,而氧化苦参碱、硝苯地平单独给药则未能呈现显著变化;氧化苦参碱与硝苯地平联合给药使SNL大鼠LH的足印的足印宽度、最大接触时间的最大强度等指标的改善情况比氧化苦参碱、硝苯地平单独给药更显著,提示硝苯地平可能对氧化苦参碱的镇痛作用具有增补作用。
此外,模型组与假手术组比较,LH侧的站立时间减少,正常步序比不变,这与文献报道的炎性和慢性压迫损伤(CCI)大鼠疼痛模型的实验结果相一致[15,26-27]。
本研究利用CatWalk步态分析仪,初步考察了氧化苦参碱及L-型钙通道阻断剂硝苯地平对神经病理性疼痛模型大鼠步态行为的改善作用,肯定了氧化苦参碱及硝苯地平对神经病理性疼痛的镇痛作用,拓展了神经病理性疼痛大鼠的行为评价方法和指标,同时也为深入研究氧化苦参碱镇痛作用的钙通道相关机制提供了可靠依据。
[1] 王超,刘春芳,林娜.中药干预神经病理性疼痛作用机制研究进展[J].中国实验方剂学杂志,2015,22(21):34-39.
[2] 王世端.实用临床疼痛诊疗学[M].青岛:中国海洋大学出版社,2009:39.
[3] 刘俐,吴琳娜.疼痛护理手册[M].成都:四川大学出版社,2013:7.
[4] Seltzer Z,Dubner R,Shir Y.A novel behavioral model of neuropathic pain disorders produced in rats by partial sciatic nerve injury[J].Pain,1990,43(2):205-218.
[5] Park J,Luo ZD.Calcium channel functions in pain processing[J].Channels,2010,4(6):510-517.
[6] 吕楠,肖波.T型钙离子通道在癫痫发生中的作用研究进展[J].中国神经精神疾病杂志,2013,39(7):447-448.
[7] 吴世星.氧化苦参碱抑制神经病理性疼痛作用与HVGCCs介导的信号通路相关性研究[D].沈阳:辽宁中医药大学,2016.
[8] Nowycky MC,Fox AP,Tsien RW.Three types of neuronal calcium channel with different calcium agonist sensitivity[J].Nature,1985,316(6027):440-443.
[9] Kim SH,Chung JM.An experimental model for peripheral neuropathy produced by segmental spinal nerve ligation in the rat[J].Pain,1992,50(3):355-363.
[10]姜静,冯建伟,陈靖,等.氧化苦参碱的镇痛作用[J].中药药理与临床,2012,28(6):50-52.
[11]关亚兰,董世芬,张胜威,等.实验性血管性痴呆大鼠模型的实时步态行为分析[J].中国比较医学杂志,2015,25(1):59-65.
[12] Kyriakou EI,van der Kieft JG,de Heer RC, et al.Automated quantitative analysis to assess motor function in different rat models of impaired coordination and ataxia[J].Journal of NeuroscienceMethods,2016,268:171-181.
[13]Deumens R,Jaken RJP,Marcus MAE,et al.The CatWalk gait analysis in assessment of both dynamic and static gait changes after adult rat sciatic nerve resection[J].Journal of NeuroscienceMethods,2007,164(1):120-130.
[14]Ferdinandusse S,Zomer AWM,Komen JC,et al.Ataxia with loss of purkinje cells in a mouse model for refsum disease[J].Proceedings of the National Academy of Scienc es,2008,105(46):17712-17717.
[15]Gabriel AF,Marcus MAE,Walenkamp GHIM,et al.The Cat-Walk method:assessment of mechanical allodynia in experimental chronic pain[J].Behavioural brain research,2009,198(2):477-480.
[16] Langford DJ,Bailey AL,Chanda ML,et al.Coding of facial expressions of pain in the laboratory mouse[J].NatureMethods,2010,7(6):447.
[17]刘志云,沈玲,邱海波,等.面部表情疼痛量表和行为学评估慢性胰腺炎大鼠的疼痛[J].临床麻醉学杂志,2016,32(4):380-382.
[18]彭皓,黄东.啮齿类动物疼痛评估方法的研究进展[J].中国疼痛医学杂志,2014,20(7):505-508.
[19]Varej觔o ASP,Meek MF,Ferreira AJA,et al.Functional evaluation of peripheral nerve regeneration in the rat:walking track analysis[J].Journal of NeuroscienceMethods,2001,108(1):1-9.
[20]李淑媛,王公望.现代治疗学[M].北京:华夏出版社,2000:137.
[21]Gupta M,Singh J,Sood S,et al.Mechanism of antinociceptive effect of nimodipine in experimental diabetic neuropathic pain[J].Methodsand Findings in Experimental and Clinical Pharmacology,2003,25(1):49-52.
[22]李廷荃,刘薇,陈瑞华.老药新用[M].太原:山西科学技术出版社,2012:197-198.
[23]Voirin J,Darie I,Fischer D,et al.Ziconotide intrathecal delivery as treatment for secondary therapeutic failure of motor cortex stimulation after 6 years[J].Neurochirurgie,2016,62(5):284-288.
[24]吴世星,杨丽,吕晓强,等.氧化苦参碱镇痛作用与钙离子通道相关性的研究[J].中国中西医结合杂志,2015,35(4):461-465.
[25]徐榕雪,杨丽,邓扬鸥,等.氧化苦参碱对高电压依赖性钙通道辅助亚基的影响[J].中药药理与临床,2016,32(3):49-53.
[26]Gabriel AF,Marcus MAE,Honig WMM,et al.The CatWalk method:a detailed analysis of behavioral changes after acute inflammatory pain in the rat[J].Journal of NeuroscienceMethods,2007,163(1):9-16.
[27]Bozkurt A,Scheffel J,Brook GA,et al.Aspects of static and dynamic motor function in peripheral nerve regeneration:SSI and CatWalk gait analysis[J].Behavioural brain research,2011,219(1):55-62.
