细胞外Ba2+对大鼠心肌细胞L型钙通道的影响*
2018-08-29孟红旭姚明江任钧国刘建勋
孟红旭, 姚明江, 任钧国, 刘建勋
(中国中医科学院西苑医院基础医学研究所, 中药药理北京市重点实验室, 北京, 100091)
在使用膜片钳技术记录心肌细胞钙通道的实验中,钙通道电流会发生随时间经过的衰减现象,被称为“rundown”现象。实验中,如在细胞内液中加入ATP、钙螯合剂EGTA以及低浓度的Mg2+能部分减少“rundown”现象[1], 穿孔膜片钳技术几乎完全解决了记录通道电流时发生“rundown”的现象。但是,由于电极内液中的其他大分子无法与胞内物质进行交换,从而限制了穿孔膜片钳技术的应用[2,3]。由于钙通道对Ba2+具有通透性,Ba2+常常作为钙通道的载流离子应用于钙通道电流的记录中,如采用Ba2+替代细胞外Ca2+记录L型钙通道电流,虽然可产生一定的增幅效应,但也会造成通道失活特性的明显改变,对观察药物的钙通道作用产生一定影响[4]。在记录L型钙通道电流时,于细胞外加入一定浓度的Ba2+是否对L型钙通道的失活特性和电流衰减产生影响尚不清楚。为此,本研究观察了细胞外Ba2+对记录大鼠心肌细胞L-型钙通道的影响。
1 材料与方法
1.1 动物
清洁级雄性SD大鼠,体重(180±10)g,购自北京维通利华实验动物技术有限公司,许可证:SCXK(京2007-0001)。
1.2 药物及配制液体
丹酚酸A(纯度>95%)由北京本草天源药物研究院提供。其他药品除特别注明外,皆购自美国Alfa Aesar。无钙台式液(mmol/L):NaCl 140, KCl 5.4, NaH2PO40.33, MgCl21, Glucose 10, Hepes 10 (用NaOH调节pH值至7.4)。KB液:KOH 70, KCl 40, KH2PO420, Glutamic acid 50, MgCl23, Taurine 20, EGTA 0.5, Hepes 10, Glucose 10 (用KOH调节pH值至7.4)。记录钙通道细胞外液(mmol/L): 台式液(无钙台式液+CaCl21.8);记录钙通道电极内液(mmol/L):CsCl 140, MgCl22, CaCl21, EGTA 11, MgATP 5, Hepes 10 (用CsOH调节pH值至7.2)。
1.3 心室肌细胞的分离
腹腔注射10%乌拉坦麻醉SD大鼠,迅速开胸取出心脏,在零度无钙台式液中剥离出主动脉,悬挂于Langendorff心脏灌流装置上,确保管口不超过主动脉的心脏入口,棉线固定,行主动脉逆行灌流,流量为7~8 ml/min。先用无钙台氏液灌流5 min,接着用含酶低钙台氏液[0.4 mg/ml胶原酶Ⅱ(Worthington)+0.03 mg/ml蛋白酶ⅩⅣ(Sigma)+0.9 mg/ml牛血清白蛋白(Sigma)+CaCl20.05 mmol/L]灌流19~24 min,最后用低钙台式液(CaCl20.4 mmol/L)灌流5 min,剪取心室组织置KB液中剪碎,吹打,用100目筛网过滤,最后将细胞保存于KB液中,4 ℃低温可保存36 h。整个操作过程中,维持灌流液温度在(37±1)℃,灌流液中充纯氧气至饱和[5,6]。
1.4 膜片钳技术
使用电极拉制仪(PULL-100,美国)拉制电极,在玻璃电极中充电极内液后使阻抗达到2~4 MΩ。吸几滴细胞悬液加入细胞池中,细胞贴壁后选择杆状、表面光滑、纹理清晰的心肌细胞,利用三维操纵器移动电极贴近目标细胞并轻压在细胞表面,稍加负压即可形成1 GΩ 水平以上的高阻抗封接,再用较大负压吸破细胞膜,形成全细胞记录形式。由刺激采集软件Pulse控制实验过程,使用膜片钳放大器(EPC10,德国)通过模数转换采集数据,存放于计算机硬盘。将细胞钳制在-40 mV使钠通道和T型钙通道失活, 用CsCl代替电极内液中的KCl,阻断K+电流外流。给予从-40 mV至0 mV持续250 ms的除极电压,可以得到迅速活化、缓慢失活的内向电流,该电流可被盐酸地尔硫卓(10 μmol/L)阻断,确定为L型钙通道电流。给予上述除极电压,以0.3 Hz的频率连续记录15 min,L型钙电流峰值幅度为电流活化峰值与稳定失活后电流幅度之差。
1.5 实验设计
实验以Ba2+(1.8 mmol/L)完全替换台式液中的Ca2+(1.8 mmol/L),观察L型钙通道电流失活特征变化;直接向台式液中加入Ba2+(0~8 mmol/L),观察电流失活特征变化和峰值电流15 min内的变化。每个数据采用5个以上细胞进行重复检测。
1.6 统计学分析
2 结果
2.1 细胞外不同浓度Ba2+对L-型钙通道电流的影响
通过灌流装置使Ba2+逐渐替代细胞外液中的Ca2+,连续记录L-型钙通道电流(ICa,L)轨迹。通道电流的失活速率逐渐减慢,在Ba2+全部替换Ca2+后,电流峰值及失活变化速率保持稳定(图1A)。失活速率变化适合采用单指数方程描述,失活速率时间常数由替换前的(88.6±5.3) ms (n=5) 变化至(246.4±26.6) ms (n=6) (P<0.01)。将Ba2+(0.2,0.4,0.8 mmol/L)加入至细胞外液中,通道电流的失活速率略变慢(图1B),其中0.2 mmol/L Ba2+和0.4 mmol/L Ba2+的时间常数分别为(89.4±6.3) ms (n=5)和(93.6±7.6) ms (n=6),与未加入Ba2+([Ba2+]=0)细胞组的时间常数无明显差异(P>0.05);加入0.8 mmol/L Ba2+,电流失活速率时间常数为(96.1±6.6) ms (n=6),与未加入Ba2+([Ba2+]=0)细胞组电流失活速率时间常数差异显著(P<0.05)。
2.2 细胞外 Ba2+浓度对不同时程的L-型钙通道电流峰值电流的影响
与细胞外未加Ba2+([Ba2+]=0)的细胞组比较,细胞外分别加入0.2,0.4 mmol/L Ba2+的两组细胞的L-型钙通道电流峰值随时程变化衰减程度明显减弱。图2显示3个细胞分别在细胞外液0 mmol/L Ba2+、0.2 mmol/L Ba2+、0.4 mmol/L Ba2+的条件下,钙通道电流峰值随时间变化的衰减状况。在3种实验条件下的前5 min左右,通道电流峰值均呈现加速衰减的过程,此后的衰减缓慢。我们比较了三种实验条件下5 min、10 min、15 min 3个时间点通道电流峰值的衰减率(表1),细胞外液中加入Ba2+(0.2,0.4 mmol/L)的两组细胞,在10 min和15 min 2个时间点L-型钙通道电流峰值电流的衰减明显减弱,虽然两组之间无统计学差异,但是0.4 mmol/L Ba2+组减缓电流峰值随时间衰减的变化趋势更明显。

Fig.1Effects of extracellular Ba2+on inactivation rate of ICa,L
A: Ba2+instead of Ca2+gradually in extracellular solution; B: Ba2+(0.2, 0.4, 0.8 mmol/L) added in the extracellular solution

Fig.2Effect of extracellular Ba2+concentration (0, 0.2, 0.4 mmol/L) on the peak current rate at different time points
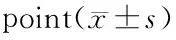

ConditionsBa2+(mmol/L)nRecording time (min)510150614.1±8.427.7±7.336.6±7.70.255.5±4.615.0±13.2*19.5±13.4*0.457.6±5.612.5±10.3*13.9±8.5**
*P<0.05,**P<0.01vsBa2+0 group
2.3 细胞外Ba2+浓度对电流电压曲线的影响
在细胞外液Ba2+浓度为0、0.4 mmol/L的条件下,成功破膜后等待5 min至电流衰减的平台期,钳制电位设为-40 mV,给予时长250 ms,阶跃为10 mv, 从-40至+70 mV的系列去极化脉冲,可得到一组电流轨迹(图3A)。以刺激电压和与电压对应的电流峰值绘制电流电压曲线(图3B)。从曲线中可以看出,当Ba2+浓度为0.4 mmol/L时电流电压曲线下移,峰值电流密度增大[由9.86±2.77 pA/pF (n=6)增至12.97±1.38 pA/pF(n=5)],翻转电位增大(由50 mV增至70 mV),而不改变峰值电压和I-V曲线的形状。
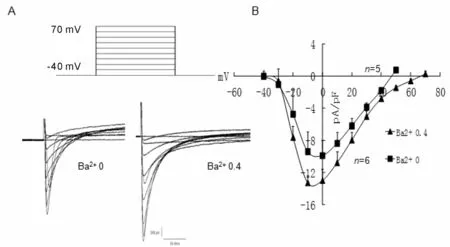
Fig.3Effect of extracellular Ba2+concentration on current-voltage relationship of ICa,L
A: Currents recorded from holding voltage -40 mV to test potential; B: Current-voltage curve from the peak current of ICa,L
2.4 细胞外 Ba2+浓度对记录丹酚酸A抑制L-型钙通道作用的影响
最近本实验室报道,丹参的一种有效成分-丹酚酸A(salvianolic acid A,Sal A)具有浓度依赖性的抑制大鼠心室肌细胞L-型钙通道电流的作用[7]。我们观察了在细胞外液Ba2+浓度为0和0.4 mmol/L两种条件下,100 μmol/L Sal A的抑制效应(图4A)。在0.4 mmol/L Ba2+的条件下,检测6个细胞Ba2+细胞外液条件下,100 μmol/L Sal A对钙通道的抑制强度明显弱于细胞外液0 mmol/L Ba2+条件下(检测8个细胞)的抑制效应(抑制率分别为37.8%±8.4%和53.4%±3%,P<0.01),而且药物洗脱后下峰值电流回复较0 mmol/L Ba2+条件下更彻底。在两种细胞外液下条件,Sal A都显示了浓度依赖性的抑制L-型钙通道电流(0 mmol/L Ba2+条件下,检测10个细胞;0.4 mmol/L Ba2+条件下,检测12个细胞),其量效曲线均适合以logistic公式进行拟合(图4B)。在0.4 mmol/L Ba2+细胞外液条件下,量效曲线右移,统计后显示在两种细胞外液(0,0.4mmol/L)条件下,Sal A的IC50分别为和38 μmol/L和55 μmol/L。
3 讨论
采用膜片钳技术记录离子通道电流时出现的“rundown”现象,对细胞药理学研究产生了很大影响。一些方法在抑制“rundown”现象方面已经取得了明显效果,特别是1988年Horn等建立的穿孔膜片钳技术(perforated patch clamp technique)。这种膜片钳技术通过向细胞内液中加入制霉菌素(nystatin)或两性霉素(amphotericin)等抗生素,在细胞膜上穿孔形成特定孔道,选择性地允许一些离子和大分子物质进出,既保持了电极内与细胞内液之间电学的连续性,又避免对胞内重要物质的渗析产生影响,使细胞内环境保持相对稳定,几乎完全避免了记录通道电流时发生“rundown”现象。但是,由于穿孔膜片钳形成后,电极内液向胞内的渗析作用几乎丧失,某些通过电极内液向细胞内加入活性物质的研究无法进行,而且实验中常出现特定孔道“再封口”和自发性转变为传统的全细胞模式等现象[8,9]。因此,仍然需要进一步探索解决“rundown”现象的方法。
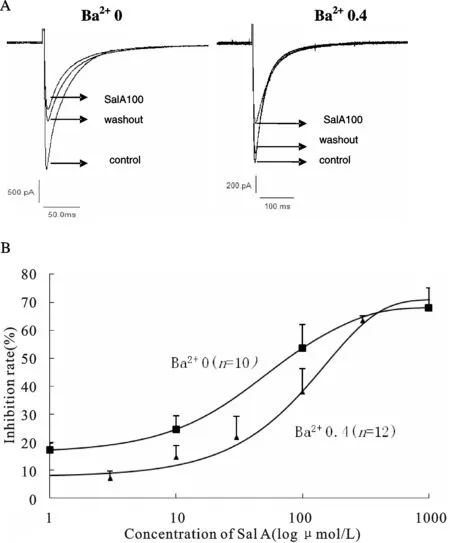
Fig.4Effect of extracellular Ba2+concentration on ICa,Linhibition induced by Salvianolic acid A
A: Current peak weakened by Sal A (100 μmol/L) in extracellular 0.4 mmol/L Ba2+; B: Concentration-response curve from the current peak in extracellular 0.4 mmol/L Ba2+
由于钙通道对Ba2+具有通透性,因此Ba2+常常作为钙通道的载流离子应用于钙通道电流的记录中。本实验首先观察了以Ba2+替代台式液中的Ca2+,观察其对大鼠心肌细胞L型钙通道电流的影响。结果显示,L型钙通道峰值电流的幅度未见明显增大,通道电流的失活随着Ca2+逐渐被替换而逐渐减缓,完全替换后失活速率时间常数增加约2倍,这个现象证实钙通道失活具有明显的Ca2+依赖性。若在细胞外液中加入低浓度的Ba2+(0.2,0.4 mmol/L),对钙通道失活速率的影响不明显,但是将Ba2+浓度提高至0.8 mmol/L时,失活速率常数差异显著,表明低浓度的Ba2+对钙通道失活特性的影响较小。此后,连续观察了低浓度Ba2+对钙通道电流峰值衰减的影响。结果显示,无论是否加入Ba2+,钙通道电流峰值均在5 min呈现较快的衰减,在5~12 min出现衰减平台,之后再次出现较快的衰减,与未加入Ba2+时比较,加入Ba2+后电流衰减程度明显降低,其中10 min和15 min时间点衰减差异明显,提示在细胞外液中加入适当的Ba2+可以减弱“rundown”现象。
“rundown”现象的形成机制目前仍有争议,但是认为钙依赖性的蛋白水解和PKA介导的磷酸化的逆转是“rundown”形成的主要原因,而且一些未知的细胞内因子也参与了这个过程中钙通道的调控[10,11]。目前已知,Ca2+依赖性的Ca2+/CaM复合体不仅能使L型钙通道失活,而且直接减慢钙通道从失活状态的恢复。钙通道的这种失活作用主要源于Ca2+/CaM复合体结合到L型钙通道α亚单位羧基端IQ基序,这种结合与钙通道周围Ca2+的饱和性有关[12]。因此认为,加入钙通道的载流离子Ba2+后记录到的钙电流应为Ca2+和Ba2+的混合电流,这样可使钙通道周围Ca2+延迟达到饱和,这可能是细胞外Ba2+减弱“rundown”现象的原因。在细胞外Ba2+对钙通道电压依赖性的影响实验中,作者发现在细胞外液中加入Ba2+可下移电流电压曲线,改变翻转电位,但是不改变峰值电压和I-V曲线的形状,这种改变可能系由于“rundown”现象减弱,使钙通道在不同电压刺激下一直能够保持较高的电流密度所致。作者观察了在细胞外液中加入Ba2+的条件下,药物药理作用的变化。一种已知具有钙抑制作用的中药单体化合物丹酚酸A,在使用正常台式液和含Ba2+台式液过程中,药物的抑制效应出现明显差异,这可能是由于Ba2+有效地减少了电流衰减,能更加准确地反映药物的量效关系。
综上所述,本研究显示在细胞外液中加入一定浓度的Ba2+,可使采用全细胞膜片钳技术记录L-型钙通道时出现的“rundown”现象减弱,并减少观察药物效应时因出现“rundown”现象引起的实验误差。
