伏立康唑血药浓度监测及临床应用分析
2018-02-02刘加涛杨春兰孙国平
刘加涛 宋 帅 苏 涌 杨春兰 夏 泉 孙国平
近年来,由于器官移植的快速发展以及肿瘤放化疗、免疫抑制剂和广谱抗菌药物的大量使用,真菌感染的发病率呈逐年上升趋势[1]。伏立康唑是氟康唑的衍生物,具有广谱抗真菌作用,是治疗或预防侵袭性真菌感染的首选药物[2]。此外,伏立康唑还是血液系统疾病[3-4]、免疫功能低下[5]和器官移植[6]患者治疗或预防用药的首选。但在临床应用中却发现,即使以同样的方式给药,仍有15%~28%的患者治疗后无效,而12.5%左右的患者发生严重的不良反应(adverse reactions,ADR),表明伏立康唑个体差异较大,应加强监
测,以保证安全、有效用药[7-8]。研究[9]表明,伏立康唑的代谢受患者年龄、肝脏功能及CYP2C19基因多态性等多种因素影响,且易与其他药物或食物发生相互作用,其在人体内的药代动力学特征呈现非线性,具有明显的药动学个体差异。此外,伏立康唑的血药浓度与其治疗效果和肝功能异常、视觉障碍等不良反应的发生率具有明显的相关性[10-11]。因此,日本和英国先后于2013年和2014年发布了伏立康唑治疗药物监测(therapeutic drug monitoring,TDM)指南和抗真菌药物TDM指南,用于指导临床医师安全、有效地使用伏立康唑[12-13]。本研究对安徽医科大学第一附属医院使用伏立康唑并检测血药浓度的患者的用药情况进行分析,讨论血药浓度监测在伏立康唑个体化用药中的作用,为伏立康唑合理使用提供科学依据。
1 资料与方法
1.1 一般资料 选取安徽医科大学第一附属医院2016年10月至2017年8月收治的使用伏立康唑抗真菌治疗并且开展血药浓度监测的60例患者的131次监测结果,通过电子病历系统回顾性收集患者的基本资料、诊治过程和合并用药情况。
1.2 治疗方法 55例患者起始时使用伏立康唑静滴给药,5例患者口服给药,除1例87岁慢性阻塞性肺疾病患者使用150 mg,每12小时1次外,其他患者均每12小时给药200 mg,首日给药剂量加倍,平均用药时间(14.4±11.9)d。
1.3 血药浓度测定方法 患者血清伏立康唑浓度的检测采用高效液相色谱法,使用Waters2695 高效液相色谱仪工作站(Waters2489紫外检测器,美国),色谱柱为Hypersil ODS2 C18(4.6 mm×250 mm,5 μm),流动相为乙腈∶水=36∶64,流速为1.0 mL/min,检测波长为254 nm,柱温为30℃,进样量20 μL,以艾司唑仑为内标。详细分析条件及相关方法学结果见文献[14]。
1.4 疗效判断 ①治愈:治疗后患者的临床症状与体征均消失,实验室和病原学检查指标均恢复正常;②好转:临床症状和/或体征有所好转,实验室和/或病原学检查指标未完全恢复正常;③无效:病情无明显好转或出现加重的情况。有效率=(治愈+好转)/总例数×100%。
1.5 不良反应 通过电子病历系统回顾性调查并记录患者在住院过程中发生的可能与使用伏立康唑相关的所有不良反应,包括实验室检查指标的异常。
2 结果
2.1 基本资料 本研究共纳入60例患者的131次血药浓度测定结果,其中,男性50例,女性10例;年龄 20~87岁,平均(47.6±16.1)岁。体质量35.5~88.0 kg(6例患者长期卧床),平均(62.9±15.6)kg。原患疾病中以肾移植患者最多,共30例,其次是肺部疾患12例,血液系统疾病9例,肝胆疾病3例,恶性肿瘤2例,发热性疾病3例,脑出血继发感染1例。
2.2 高效液相色谱法测定血清伏立康唑浓度 使用高效液相色谱法测定血清中伏立康唑的药物浓度,以艾司唑仑作为内标物,在当前的色谱条件下无内源性物质干扰,二者分离度良好。艾司唑仑的出峰时间为11.31 min,伏立康唑的出峰时间为13.60 min。详见图1。
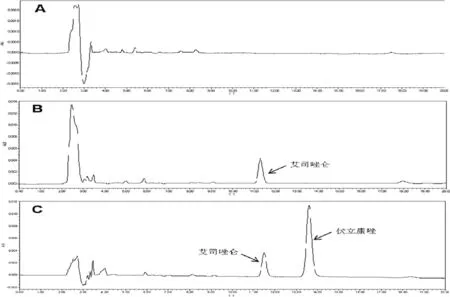
图1 血伏立康唑高效液相色谱图
注:A为空白血浆,B为空白血浆+艾司唑仑,C为患者血浆+艾司唑仑
2.3 伏立康唑血药浓度分布情况 对60例患者共计131次的伏立康唑血药浓度监测结果进行分析,55次(41.98%)伏立康唑血药浓度<1.0 μg/mL,平均(0.42±0.30)μg/mL;67次(51.15%)伏立康唑血药浓度1.0~5.0 μg/mL,平均(2.37±1.06)μg/mL;此外,9次(6.87%)血伏立康唑血药浓度>5.0 μg/mL,平均(6.50±1.24)μg/mL。约半数患者在正常使用的情况下,其血药浓度未能达到有效治疗浓度,另有少部分患者血药浓度超过有效血药浓度范围上限。
2.4 免疫抑制剂对伏立康唑血药浓度的影响 本研究中,有53.33%(32/60)的患者合并使用免疫抑制剂,其中12例(20.00%)合并使用他克莫司,19例(31.67%)联合使用他克莫司和吗替麦考酚酯,1例(1.67%)合并使用环孢素。联合使用免疫抑制剂患者的血伏立康唑浓度为(1.35±1.55) μg/mL,低于未联合使用免疫抑制剂患者的(3.37±2.39) μg/mL,差异有统计学意义(t=3.493,P<0.001)。
2.5 临床治疗效果 本研究纳入的60例患者经伏立康唑治疗后,有15例(25.00%)达到治愈,42例(70.00%)好转,总有效率为95.00%(57/60),治愈和好转患者的血药浓度分别为(4.78±2.28)μg/mL和(1.52±1.47)μg/mL,3例对治疗无效患者的平均血药浓度为(1.17±0.81)μg/mL,三者间血药浓度比较,差异有统计学意义(F=21.243,P<0.05)。进一步两两比较显示,治愈组患者血清伏立康唑浓度高于好转组(P<0.05)和无效组(P=0.001)患者,好转组患者血清伏立康唑浓度虽高于无效组,但差异无统计学意义(P=0.729)。
2.6 不良反应 本研究中纳入的60例患者中,不良反应发生率为41.67%(25/60),其中,肝功能损害10例(16.67%)、神经系统症状6例(10.00%)、电解质紊乱13例(21.67%)、皮疹1例(1.67%)、胃肠道反应2例(3.33%)和视觉障碍1例(1.67%)。25例发生不良反应的患者的血伏立康唑浓度为(3.37±2.37)μg/mL,未发生不良反应的患者的血药浓度为(1.73±1.75)μg/mL,差异有统计学意义(t=2.383,P=0.020)。
3 讨论
伏立康唑是由氟康唑衍生而来的新一代三唑类抗真菌药物,与其他抗真菌药物相比,具有口服生物利用度高、抗菌活性强、抗菌谱广和能透过血脑屏障等特点,临床上广泛用于多种真菌感染,是侵袭性曲霉菌和耐氟康唑的念珠菌感染的首选药物。但其药动学特征呈现非线性,代谢过程容易受到肝功能、细胞色素P450酶及合并使用的其他药物的影响,导致患者在接受标准剂量的药物后血药浓度差异较大,且有文献[15-16]报道,伏立康唑的血药浓度与其治疗效果和不良反应显著相关。因此,国内外学者均推荐在使用伏立康唑的过程中监测血药浓度,并根据血药浓度情况调整治疗方案。本研究分别从血药浓度分布情况、联合使用免疫抑制剂对血药浓度的影响、血药浓度与患者疗效和不良反应发生率间的关系进行分析,发现伏立康唑在常规治疗剂量下血药浓度差异较大,最高者可达8.57 μg/mL,而低者甚至低于仪器的检测限0.1 μg/mL。虽然,目前伏立康唑最佳的治疗窗范围尚不明确,但1.0~5.0 μg/mL可能是最佳谷浓度范围[17]。本研究监测的131次血药浓度测定结果中,仅有67次(51.15%)在治疗范围内,约有40.0%的患者血药浓度未达到有效治疗范围,表明伏立康唑血药浓度个体差异大,在临床治疗中应加强药物浓度监测。
环孢素、吗替麦考酚酯和他克莫司等免疫抑制剂是器官移植后患者必须长期使用的药物,而这些患者普遍存在免疫力低下,易发生真菌感染,因此,伏立康唑联合免疫抑制剂使用在临床上常见[18]。有文献[19]报道,伏立康唑影响合并使用的免疫抑制剂如他克莫司和环孢素的代谢过程,但合并使用的免疫抑制剂是否能影响伏立康唑的代谢过程,升高或降低其血药浓度尚不清楚。本研究中,53.33%(32/60)的患者为移植后真菌感染,存在联合使用免疫抑制剂如他克莫司和伏立康唑的情况。而他克莫司等免疫抑制剂是CYP3A4的底物,文献[20-21]报道,二者相互作用能显著升高免疫抑制剂的血药浓度,进而增加患者发生不良反应的风险。本研究发现,联合伏立康唑的他克莫司浓度较单独他克莫司浓度高。免疫抑制剂对联合使用的伏立康唑的代谢过程的具体影响尚不清楚。本研究还发现,联合使用他克莫司、环孢素等免疫抑制剂的患者,其血中伏立康唑浓度明显低于单独使用伏立康唑的患者血中伏立康唑浓度,表明伏立康唑联合免疫抑制剂时不仅需要监测伏立康唑血药浓度,对合并使用的免疫抑制剂的血药浓度也应进行监测。
大量文献研究[16-17,22-23]表明,伏立康唑治疗效果和不良反应与其血药浓度显著相关。如Dolton等[22]对201例使用伏立康唑抗真菌治疗并进行血药浓度测定的患者进行回顾性研究发现,当谷浓度<1.7 μg/mL时,患者的治疗失败率为25.68% (19/74),明显高于谷浓度≥1.7 μg/mL的患者的失败率6.74%(6/89),差异有统计学意义(P<0.05)。而Park等[23]研究发现,通过调整伏立康唑的剂量将其浓度控制在1.0~5.5 μg/mL的范围内,其治疗成功率明显高于给予固定剂量治疗。与上述研究结果相似,本研究中也发现,治愈患者的血伏立康唑浓度明显高于好转和无效患者,但好转和无效患者的浓度无显著差异。此外,比较发生不良反应与未发生不良反应的患者血中伏立康唑的浓度可见,发生不良反应的患者血伏立康唑浓度明显高于未发生不良反应的患者,与文献[17,23]报道的结果相一致。
综上所述,伏立康唑的血药浓度个体差异较大,影响其血药浓度的因素较多,其临床疗效和肝毒性等不良反应与血药浓度直接相关。因此,在临床使用过程中应进行血药浓度监测,并根据监测结果及时调整治疗方案,以保证患者安全、有效用药,提高治疗效果。本研究由于样本量有限,所得结论与真实情况可能有所偏差,课题组后期将扩大样本量继续研究。
[1] 曾贤铭,孙青阳,于婷婷,等. 颅脑外伤合并泌尿道感
染患者的病原菌分布及耐药性分析[J].中华全科医学,2015,13(4):638-640.
[2] PATTERSON T F,THOMPSON G R,DENNING D W,et al.Practice guidelines for the diagnosis and management of aspergillosis:2016 update by the Infectious Diseases Society of America[J].Clin Infect Dis,2016,63(4):e1-e60.
[3] BARRETO J N,BEACH C L,WOLF R C,et al. The incidence of invasive fungal infections in neutropenic patients with acute leukemia and myelodysplastic syndromes receiving primary antifungal prophylaxis with voriconazole[J].Am J Hematol,2013,88(4):283-288.
[4] 李志敏,夏瑞祥. 急性白血病患者侵袭性真菌病的临床研究与分析[J].安徽医学,2015,36(3):284-288.
[5] CONSIGNY S,DHEDIN N,DATRY A,et al. Successsful voriconazole treatment of disseminated fusarium infection in an immunocompromised patient[J].Clin Infect Dis,2003,37(2):311-313.
[6] KLONT R R,EGGINK C A,RIJS A J,et al. Successful treatment of Fusarium keratitis with cornea transplantation and topical and systemic voriconazole[J].Clin Infect Dis,2005,40(12):e110-e112.
[7] 汤明. 氟康唑与伏立康唑治疗真菌感染性肺炎的疗效比较[J].西北药学杂志,2014,29(3):283-285.
[8] 黄耕,于永祥,王思力,等. 伏立康唑对血液肿瘤合并侵袭性真菌病患者的病原学及疗效分析[J].中国生化药物杂志,2014,34(9):146-148.
[9] JIN H,WANG T,FALCIO B A,et al. Trough concentration of voriconazole and its relationship with efficacy and safety:a systematic review and meta-analysis[J].J Antimicrob Chemother,2016,71(7):1772-1785.
[10]JAGER N G,VAN HEST R M,LIPMAN J,et al. Therapeutic drug monitoring of anti-infective agents in critically ill patients[J].Expert Rev Clin Pharmacol,2016,9(7):961-979.
[11]KANG H M,LEE H J,CHO E Y,et al. The clinical sig-
nificance of voriconazole therapeutic drug monitoring in children with invasive fungal infections[J].Pediatr Hematol Oncol,2015,32(8):557-567.
[12]HAMADA Y,TOKIMATSU I,MIKAMO H,et al. Practice guidelines for therapeutic drug monitoring of voriconazole:a consensus review of the Japanese Society of Chemotherapy and the Japanese Society of Therapeutic Drug Monitoring[J].J Infect Chemother,2013,19(3):381-392.
[13]ASHBEE H R,BARNES R A,JOHNSON E M,et al. Therapeutic drug monitoring (TDM) of antifungal agents:guidelines from the British Society for Medical Mycology[J].J Antimicrob Chemother,2014,69(5):1162-1176.
[14]苏涌,杨春兰,黄燕,等. 高效液相色谱法测定血浆中伏立康唑的浓度[J].安徽医药,2017,21(2):244-247.
[15]PASCUAL A,CALANDRA T,BOLAY S,et al. Voriconazole therapeutic drug monitoring in patients with invasive mycoses improves efficacy and safety outcomes[J].Clin Infect Dis,2008,46(2):201-211.
[16]MITSANI D,NGUYEN M H,SHIELDS R K,et al. Pro-
spective,observational study of voriconazole therapeutic drug monitoring among lung transplant recipients receiving prophylaxis:factors impacting levels of and associations between serum troughs,efficacy,and toxicity[J].Antimicrob Agents Chemother,2012,56(5):2371-2377.
[17]MATSUMOTO K,ABEMATSU K,SHIGEMI A,et al.Therapeutic drug monitoring of voriconazole in Japanese patients:analysis based on clinical practice data[J].J Chemother,2016,28(3):198-202.
[18]BODRO M,SABE N,GOMILA A,et al. Risk factors,clinical characteristics,and outcomes of invasive fungal infections in solid organ transplant recipients[J].Transplant Proc,2012,44(9):2682-2685.
[19]LEMPERS V J,MARTIAL L C,SCHREUDER M F,et al. Drug-interactions of azole antifungals with selected immunosuppressants in transplant patients:strategies for optimal management in clinical practice[J].Curr Opin Pharmacol,2015,24:38-44.
[20]SAAD A H,DEPESTEL D D,CARVER P L. Factors influencing the magnitude and clinical significance of drug interactions between azole antifungals and select immunosuppressants[J].Pharmacotherapy,2006,26(12):1730-1744.
[21]DRESSER G K,SPENCE J D,BAILEY D G. Pharmacokinetic-pharmacodynamic consequences and clinical relevance of cytochrome P450 3A4 inhibition[J].Clin pharmacokinet,2000,38(1):41-57.
[22]DOLTON M J,RAY J E,CHEN S C,et al. Multicenter study of voriconazole pharmacokinetics and therapeutic drug monitoring[J].Antimicrob Agents Chemother,2012,56(9):4793-4799.
[23]PARK W B,KIM N H,KIM K H,et al. The effect of therapeutic drug monitoring on safety and efficacy of voriconazole in invasive fungal infections:a randomized controlled trial[J].Clin Infect Dis,2012,55(8):1080-1087.
