米糠中产γ-氨基丁酸细菌分离及其接种发酵研究
2018-01-31姚英政李治华
董 玲,姚英政,梁 强,李治华,朱 宇*
(1.四川省农业科学院 农产品加工研究所,四川 成都 610066;2.四川省农业科学院 生物技术核技术研究所,四川 成都 610061)
γ-氨基丁酸(gamma-aminobutyric acid,GABA)是一种抑制性神经递质[1],对人具有治疗高血压[2-3]、糖尿病[4]、失眠和抑郁[5-6],激活肝脏[5]和保护肾脏[7]等功能;对畜禽具有促进采食、抗应激、镇静和提高生产性能等生理功能[8-9]。此外,长期食用富含GABA的食物有利于抑制癌细胞增殖、预防糖尿病和维持身体健康[1,5]。获得GABA的方法主要有化学合成法、植物富集法和微生物发酵法[10]。与前两者比起来,通过微生物发酵来提高食品中GABA含量是一种安全有效的途径[1,5,11]。乳酸菌具有安全性高、在食品工业应用广泛、高产GABA菌种种类丰富的特点[1,5,12],因此,利用乳酸菌发酵获得富含GABA食品已成为近年来食品发酵领域的研究热点。如KO C Y等[6,13-14]分别利用产GABA的乳酸乳球菌(Lactococcuslactis)、鼠李糖乳杆菌(Lactobacillus rhamnosus)和短乳杆菌(Lactobacillus brevis)发酵来提高豆奶的GABA含量;SHAN Y等[15-17]分别利用植物乳杆菌(Lactobacillus plantarum)、短乳杆菌(L.brevis)和乳酸乳球菌(L.lactis)发酵来制作富含GABA乳制品;CODA R等[18-20]分别用产GABA的植物乳杆菌(L.plantarum)和乳酸乳球菌乳酸亚种(Lactococcus lactissubsp.lactis)、乳酸乳球菌(L.lactis)、短乳杆菌(L.brevis)发酵面团来制作富含GABA面包;WORAHARN S等[21]利用短乳杆菌(L.brevis)和发酵乳杆菌(Lactobacillus fermentum)发酵有效提高了猴头菇中GABA含量等。
米糠是稻谷加工过程中产生的主要副产物,约占稻谷质量的6%~8%,近年来我国稻谷产量均>2亿t[22],按照2亿t稻谷产量计算,则每年至少产生1 200万t米糠。米糠营养丰富,含有蛋白质约15%,脂肪16%~22%,以及多种生物活性物质,如生育酚、生育三烯酚、脂多糖、谷维素等,但对米糠的深加工研究还集中在单一成分的提取[23]。本研究通过分离米糠中具有高产GABA能力的菌株,将其用于米糠发酵,将米糠中丰富的谷氨酸[23-24]转化成GABA,以期获得富含GABA的发酵产品,有利于提高米糠附加值,延伸米糠加工产业链。
1 材料与方法
1.1 材料与试剂
地衣芽孢杆菌(Bacillus licheniformis)DY:本课题组分离自南充冬菜;菌株L-44A:分离自泸州立石镇陈米糠样品(L);新鲜米糠(-20℃保存):四川航粒香米业有限公司;在室温条件下存放3个月的新米糠样品(X1)、在室温条件下存放12个月的陈米糠样品(X2):南充市西充县;在室温条件下存放12个月的陈米糠样品(L):泸州市立石镇。
GABA标准品:美国Sigma公司;水解蛋白酶(0.6AU/g)、风味蛋白酶(500 LAPU/g),诺维信(中国)投资有限公司;A液体培养基参考文献[25]配制;MRS培养基:青岛高科园海博生物技术有限公司;KF肉汤培养基、M17肉汤培养基:上海哈灵生物科技有限公司;薄层硅胶板:青岛海浪硅胶干燥剂有限公司;琼脂粉、谷氨酸钠(均为生化试剂):成都市科龙化工试剂厂;细菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒、2×Taq聚合酶链式反应(polymerase chain reaction,PCR)Master Mix:天根生化科技(北京)有限公司;引物27F(5′-3′):AGAGTTTGATCMTGGCTCAG、引物1492R(5′-3′):GGYTACCTTGTTACGACTT:上海生工生物工程(上海)股份有限公司。
1.2 仪器与设备
AC2-6S1二级生物安全柜:新加坡Esco公司;YXQ-LS-50SII立式压力蒸汽灭菌器:上海迅博实业有限公司;5810R台式冷冻离心机:德国Eppendorf公司;FlexCycle PCR仪:德国耶拿分析仪器有限公司;ZHWY-211B恒温振荡培养箱:上海智城分析仪器制造有限公司;SUP-250生化培养箱:上海精宏实验设备有限公司;HBM-400B拍击式均质器:天津恒奥科技发展有限公司。
1.3 方法
1.3.1 产GABA菌株分离
分别在50 mL A液体培养基、MRS液体培养基、KF液体培养基和M17液体培养基中添加0.5 g谷氨酸钠和2.5 g新鲜米糠,121℃灭菌15 min。将2 g待分离米糠样品分别加入上述4种培养基,在35℃条件下静置培养72 h。取培养物1mL接种到相应液体培养基中,重复培养两次,获得富集培养物。用薄层层析法检测富集培养物中GABA产量,对GABA斑点明显的样品进行梯度稀释,取1 mL 10-6、10-7、10-8稀释度的液体于培养皿中,倾倒相应固体培养基混匀,30℃培养48 h,挑取单菌落到液体培养基(含谷氨酸钠1 g/100 mL)中,30℃静置培养72 h,用薄层层析法对发酵液GABA进行检测,初步筛选出产GABA菌落。对产GABA菌落进行进一步划线纯化得到纯菌株,筛选菌落形态不同的菌株。将纯菌株接种到含谷氨酸钠(1 g/100 mL)的相应培养基中,30℃静置培养72 h,通过薄层层析筛选出产量比较高的菌株,然后用氨基酸自动分析仪测定其发酵液中GABA含量。
1.3.2 产GABA菌株16 S rDNA序列分析
将11株GABA产量较高的菌株接种到相应液体培养基中,30℃、120 r/min,振荡培养48 h,取1 mL菌液按照DNA提取试剂盒说明进行DNA提取。参照何培新等[26]的方法进行PCR扩增,PCR产物由上海生工生物工程股份有限公司进行纯化和测序。去掉序列首尾40个碱基,利用BLAST(https://blast.ncbi.nlm.nih.gov/Blast.cgi)进行相似性分析。
1.3.3 发酵米糠产GABA试验
(1)种子菌液培养
将1.3.1分离得到的发酵液体培养基GABA产量高于500 mg/100 mL的菌株接种到20 mL MRS液体培养基中,30℃、120 r/min振荡培养18 h,然后以1%(V/V)接种量接种到经121℃、15 min灭菌处理的米糠水混合物(新鲜米糠添加量为5 g/100 mL)中,30℃、120 r/min振荡培养24 h作为种子发酵剂。
(2)单菌种发酵试验
将种子发酵剂以1%(V/V)接种量接种到米糠水混合物(新鲜米糠添加量为5 g/100 mL)中,分别在30℃、37℃培养72 h,用MRS固体培养基检测菌落总数,采用薄层层析法检测发酵液中GABA。
(3)混合发酵试验
尽管与宋内志贺杆菌(Shigella sonnei)相似性最高的菌株L-12A在液体培养基中GABA产量最高,与短乳杆菌(Lactobacillus brevis)相似性最高的菌株L-44A次之,但从安全性方面考虑,选取与短乳杆菌(L.brevis)相似的菌株L-44A为代表进行混合菌种米糠发酵试验。地衣芽孢杆菌产酶丰富,且菌株DY分离自传统发酵食品冬菜,安全性高,因此选择该菌株与菌株L-44A混合发酵。
菌株L-44A与地衣芽孢杆菌DY种子菌液(1∶1,V/V)以1%(V/V)接种量接种到米糠水混合物(米糠添加量为5 g/100 mL)中,分别在30℃、37℃条件下静置发酵72 h、120h、168h。采用薄层层析法初步检测发酵液,选出GABA含量最高的发酵液,采用氨基酸自动分析仪检测其GABA含量。
(4)酶解处理米糠发酵试验
将15 g米糠加入150 mL蒸馏水中,用2 mol/L NaOH水溶液调节pH值为8.0,分别加入0.30 g水解蛋白酶和0.30 g风味蛋白酶混匀后,55℃水浴8 h,每隔2 h搅拌一次,酶解结束后加入150 mL蒸馏水,使米糠终含量为5 g/100 mL,121℃灭菌15 min,将菌株L-44A种子菌液以1%(V/V)接种量接种到该米糠中,30℃静置发酵72 h、120 h、168 h,采用薄层层析法初步检测发酵液,选出GABA含量最高的发酵液,采用氨基酸自动分析仪检测其GABA含量。
1.3.4 发酵液GABA检测
薄层层析检测参考文献[27]方法,发酵液于6 000×g离心10 min,取1 μL上清液在硅胶薄层层析板上点样,展层剂组成为正丁醇∶冰醋酸∶蒸馏水(4∶1∶3,V/V),展层剂中茚三酮含量为0.4 g/100 mL,以含量为0.2%的γ-氨基丁酸标准溶液和谷氨酸钠标准溶液为对照,展开后于105℃显色5 min,拍照。GABA含量送四川省农业科学院分析测试中心采用氨基酸自动分析仪测定。检测条件:阳离子树脂(150 mm×4.6 mm),检测波长570 nm、440 nm,柱温为57~74℃梯度温度,洗脱液流速为0.45 mL/min,反应温度为130℃。培养基发酵液于6 000×g离心10 min后取上清进行测定;米糠发酵物在-20℃冷冻24 h,再冷冻干燥48 h后进行测定。冻干样品用6 mol/L HCl水解后进行测定。
2 结果与分析
2.1 产GABA菌种分离与鉴定
米糠富集液GABA薄层层析检测结果见图1。由图1可知,X1样品的4种培养基富集液样品中GABA斑点均不明显;X2样品采用A培养基、M17培养基、KF培养基富集有斑点,A培养基斑点最明显;L样品的4种培养基富集液都有明显斑点。由此可以推断陈米糠中产GABA菌株比新米糠多或者产GABA能力强,从陈米糠中更容易分离得到产GABA菌株。由于X1样品的4种富集液均未检测出明显GABA条带,所以不对X1样品的富集液进行GABA菌株分离;X2样品MRS液体培养基富集液未检测到明显的GABA条带,后续试验中对X2样品的A、M17和KF培养基富集液中产GABA菌株进行分离;L样品的4种培养基富集液均检测出较明显的GABA条带,对其4种培养基富集液均进行产GABA菌株分离。
从富集液的稀释液培养平板上挑取单菌落,接种到液体培养基(含谷氨酸钠1 g/100 mL)中,30℃静置培养72 h,经薄层层析检测,所挑取菌落中产GABA的菌株数见表1。由表1可知,L样品富集液中分离到产GABA菌株最多,与图1显示的L样品富集液GABA斑点最明显相吻合。通过薄层层析检测米糠富集液中GABA含量,从有目标条带的富集液中分离,减少了分离盲目性。
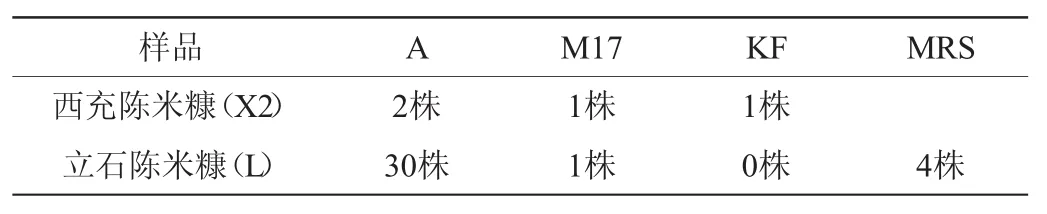
表1 米糠富集液分离产GABA菌株数Table 1 Numbers of GABA-producing strains isolated from enrichment culture of rice bran
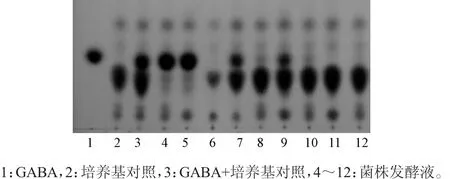
图2 菌株发酵液中GABA检测薄层层析图Fig.2 Thin-layer chromatogram of GABA in strains fermentation solution
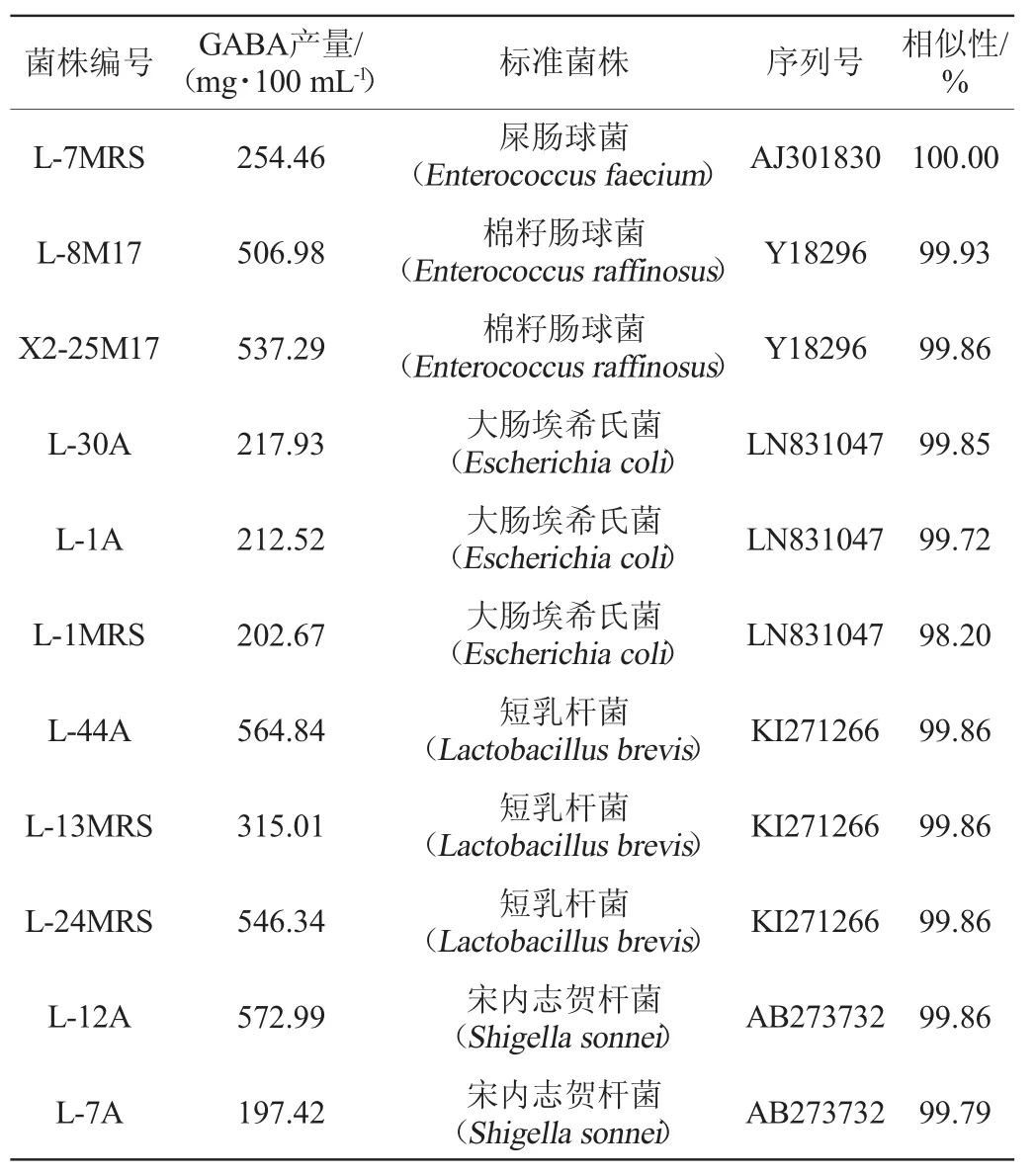
表2 菌株发酵液中GABA含量及菌株16S rDNA相似性Table 2 GABA content in strains fermentation broth and 16S rDNA similarity of strains
由图2可知,泳道4、5、7和9发酵液GABA浓度较高,泳道8、10有微弱条带,泳道6、11、12没有检测出GABA。通过薄层层析,筛选出11株GABA含量较高的菌株,编号分别为:L-1A、L-7A、L-12A、L-30A、L-44A、L-1MRS、L-7MRS、L-13MRS、L-24MRS、L-8M17、X2-25M17。筛选出的11株菌的发酵液GABA检测结果和菌株16S rDNA序列相似性比对结果见表2。由表2可知,通过16S rDNA比对,菌株L-7MRS、L-8M17、X2-25M17与肠球菌属(Enterococcus)相似性最高(99.86%~100.00%);菌株L-30A、L-1A、L-1MRS与埃希氏菌属(Escherichia)相似性最高(99.20%~99.85%);菌株L-44A、L-13MRS、L-24MRS与乳酸杆菌属(Lactobacillus)相似性最高(99.86%);菌株L-12A、L-7A与志贺氏菌属(Shigella)相似性最高(99.79%~99.86%),据此推断米糠中可培养产GABA的菌株主要属于肠球菌属(Enterococcus)、埃希氏菌属(Escherichia)、乳酸杆菌属(Lactobacillus)和志贺氏菌属(Shigella)。菌株L-8M17、X2-25M17、L-12A、L-44A、L-24MRS的GABA产量均>500mg/100mL,它们分别与棉籽肠球菌(Enterococcus raffinosus)、宋内志贺杆菌(Shigella sonnei)、短乳杆菌(Lactobacillus brevis)相似性最高(99.86%~99.93%),其中与宋内志贺杆菌(Shigella sonnei)相似的菌株L-12A的GABA产量最高,为572.99mg/100mL。GABA产量>500mg/100mL的菌种中有4株从泸州市立石镇陈米糠分离,仅1株从南充市陈米糠分离。
2.2 发酵米糠产GABA试验
2.2.1 单菌种米糠发酵试验
选择液体培养基发酵液中GABA产量高于500mg/100mL的菌株L-8M17、X-25M17、L-12A、L-44A、L-24MRS,接种到5%米糠中进行发酵,菌落数测定结果见表3。由表3可知,5株菌在米糠中均有生长。将所有菌株的米糠发酵液进行薄层层析,检测结果见图3。由图3可知,所有产GABA菌株接种在米糠中,于30℃、37℃发酵72 h,通过薄层层析均未检测到GABA斑点,说明尽管菌株能够在米糠中生长,但其在30℃、37℃发酵72 h不能明显提高GABA含量。

表3 发酵米糠中菌落计数结果Table 3 Colony count results in fermented rice bran

图3 单菌种米糠发酵液中GABA检测薄层层析图Fig.3 Thin-layer chromatogram of GABA in rice bran fermented by single species
2.2.2 混合菌种米糠发酵试验
通过薄层层析检测单独接种地衣芽孢杆菌DY、混合接种地衣芽孢杆菌DY和乳酸菌L-44A分别在30℃、37℃条件下发酵72 h、120 h、168 h的发酵液,检测结果见图4。由图4可知,仅接种地衣芽孢杆菌DY的米糠在30℃、37℃发酵72 h、120 h、168 h均没有检测到GABA斑点,说明地衣芽孢杆菌DY没有发酵米糠产GABA的能力。混合接种地衣芽孢杆菌DY和乳酸菌L-44A的米糠在30℃条件下发酵72 h和120 h都没有检测到GABA斑点,发酵168 h检测出微弱的斑点;其在37℃条件下发酵72 h没有检测到GABA斑点,发酵120 h检测出微弱斑点,发酵168 h检测出明显斑点,GABA含量随着时间的延长在逐渐增加。用氨基酸自动分析仪检测混合接种地衣芽孢杆菌DY和乳酸菌L-44A在37℃下发酵168 h的米糠中GABA含量为184.6 mg/100 g(干质量)。试验结果表明,混合接种地衣芽孢杆菌和乳酸菌L-44A的米糠经过发酵可以提高其GABA含量,但其需要的发酵时间比较长;相对而言,37℃条件下更适合混合接种发酵。
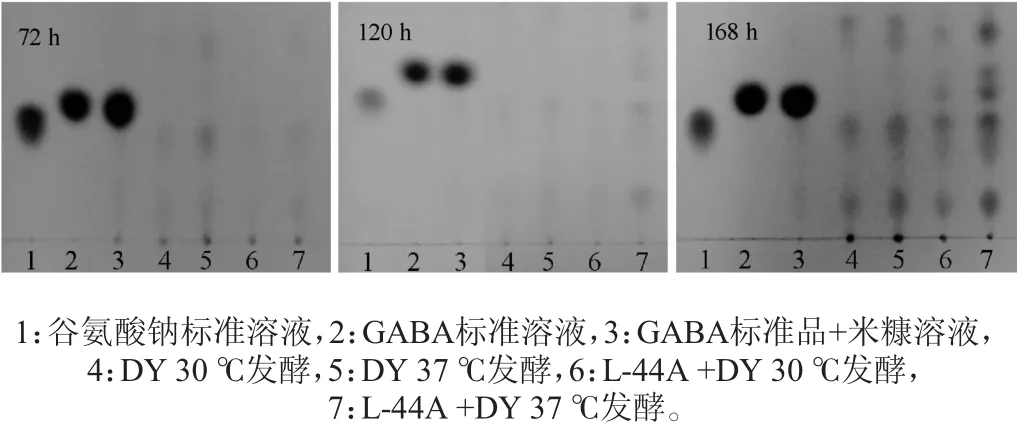
图4 米糠接种混合菌种发酵液中GABA检测薄层层析图Fig.4 Thin-layer chromatogram of GABA in rice bran fermented by multi-strains
2.2.3 酶解处理米糠发酵试验
酶解米糠接种菌株L-44A在30℃发酵72h、120h、168h,薄层层析检测结果见图5。由图5可知,酶解米糠接种菌株L-44A在30℃发酵72 h、120 h、168 h均产生了GABA,发酵72 h的GABA斑点与发酵120 h的相比差异不大,发酵时间延长到168 h,GABA含量有所提高。氨基酸自动分析仪检测结果表明,发酵168 h的酶解米糠发酵液中GABA含量为245.8 mg/100 g(干质量)。
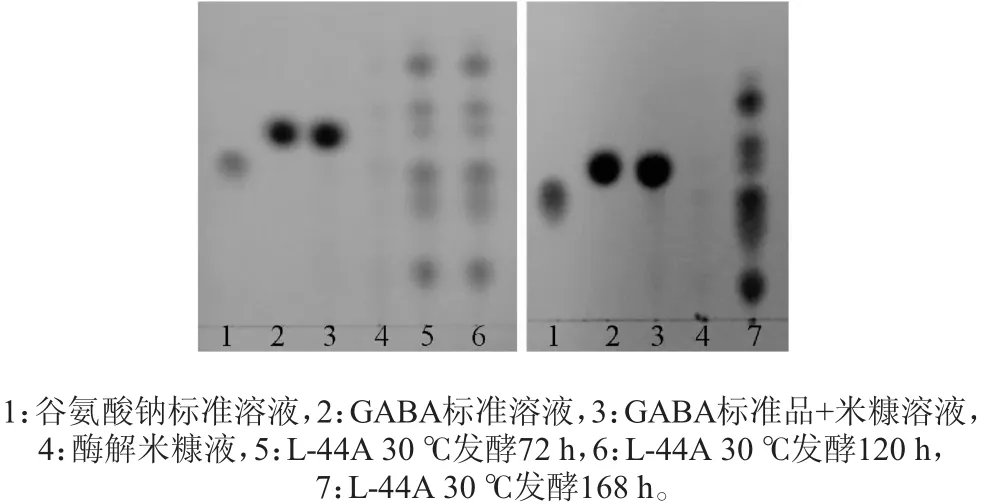
图5 酶解米糠发酵液中GABA检测薄层层析图Fig.5 Thin-layer chromatogram of GABA in enzymatic rice bran fermentation solution
2.3 讨论
通过对米糠中产GABA菌株进行分离,得到了11株GABA产量较高的菌株,通过16S rDNA相似性比对,它们分别与屎肠球菌(Enterococcus faecium)、棉子肠球菌(Enterococcus raffinosus)、大肠埃希氏菌(Escherichia coli)短乳杆菌(Lactobacillus brevis)和宋内志贺杆菌(Shigella sonnei)相似性最高,表明米糠中产GABA菌株比较丰富。对于安全性比较高的粪肠球菌、棉子肠球菌和短乳杆菌可以用于进一步进行发酵研究,开发富含GABA产品。
当分离自米糠的产GABA乳酸菌或其他细菌接种到未添加谷氨酸的米糠中进行发酵,未检测到GABA斑点,以此推断此次分离的产GABA菌株无法单独利用米糠中丰富的谷氨酸[23-24]转化成GABA。然而,通过蛋白酶水解米糠后再接种产GABA乳酸菌或者未经处理的米糠接种具有蛋白酶活力的地衣芽孢杆菌和产GABA乳酸菌混合发酵,米糠发酵液中能检测出GABA斑点,且经过氨基酸自动分析仪分析,其GABA含量分别达到245.8 mg/100 g(干质量)和184.6 mg/100 g(干质量)。根据YANG T等[28-30]的报道,乳酸菌需要利用添加的谷氨酸合成GABA,试验中经蛋白酶酶解或接种具有产蛋白酶能力的地衣芽孢杆菌处理,再接种产GABA菌株获得了富含GABA发酵产物,可能与米糠蛋白被酶分解,产生了可被产GABA菌株利用的谷氨酸底物有关。因此可通过添加蛋白酶或者接种具有很强产蛋白酶能力的菌株对米糠进行处理,再结合高产GABA菌株发酵来提高米糠中GABA含量。
3 结论
米糠中含有多种产GABA细菌。通过添加蛋白酶处理米糠后接种产GABA乳酸菌L-44A在30℃条件下发酵168 h使米糠中GABA含量达到245.8 mg/100 g(干质量),混合接种地衣芽孢杆菌和产GABA乳酸菌在37℃条件下发酵168 h的米糠中GABA含量为184.6 mg/100 g(干质量),说明酶处理效果比混合接种效果好。虽然通过发酵使米糠中GABA含量增加了很多,但二者发酵时间都比较长。
发酵的pH值、温度、时间、磷酸吡哆醛(pyridoxal phosphate,PLP)和钙离子的添加量等因素会影响GABA的产量[1,12]。对比混合接种地衣芽孢杆菌和乳酸菌在30℃和37℃发酵的薄层层析图,37℃发酵液明显比30℃的GABA含量高;在37℃条件下发酵72 h、120 h、168 h,薄层层析检测到的GABA斑点颜色有由浅到深的变化,说明温度、发酵时间对GABA产量影响较大。在后续工作中可以对发酵的pH值、PLP和钙离子添加量等因素对发酵的效果进行研究,进一步提高发酵米糠中GABA含量。
[1]DHAKALR,BAJPAI V K,BAEK K H.Production of GABA(γ-aminobutyric acid)by microorganisms:a review[J].Braz J Microbiol,2012,43(4):1230-1241.
[2]YOSHIMURA M,TOYOSHI T,SANO A,et al.Antihypertensive effect of a γ-aminobutyric acid rich tomato cultivar'DG03-9'in spontaneously hypertensive rats[J].J Agr Food Chem,2010,58(1):615-619.
[3]BECERRA-TOMÁS N,GUASCH-FERRÉ M,QUILEZ J,et al.Effect of functional bread rich in potassium,γ-aminobutyric acid and angiotensinconverting enzyme inhibitors on blood pressure,glucose metabolism and endothelial function:a double-blind randomized crossover clinical trial[J].Medicine,2015,94(46):1807-1817.
[4]SOLTANI N,QIU H,ALEKSIC M,et al.GABA exerts protective and regenerative effects on islet beta cells and reverses diabetes[J].P Natl Acad Sci,2011,108(28):11692-11697.
[5]DIANA M,QUÍLEZ J,RAFECAS M.Gamma-aminobutyric acid as a bioactive compound in foods:a review[J].J Funct Food,2014,10(3):407-420.
[6]KO C Y,LIN H T V,TSAI G J.Gamma-aminobutyric acid production in black soybean milk byLactobacillus brevisFPA 3709 and the antidepressant effect of the fermented product on a forced swimming rat model[J].Process Biochem,2013,48(4):559-568.
[7]DUNN K,PEPPIATT-WILDMAN C M,KELLEY S P,et al.Current perspective on the location and function of gamma-aminobutyric acid(GABA)and its metabolic partners in the kidney[J].J Nephrol Urol Res,2014,2(2):47-57.
[8]施忠秋,齐智利.γ-氨基丁酸调控采食量和缓解热应激的机制[J].动物营养学报,2014,26(1):49-53.
[9]袁志平,罗军荣.γ-氨基丁酸在动物生产中抗热应激研究进展[J].畜牧与兽医,2016,48(6):137-141.
[10]王志超,杨平平,王 燕,等.微生物发酵法生产γ-氨基丁酸的研究进展[J].中国调味品,2015,40(11):115-119.
[11]HUDEC J,KOBIDA L’,CˇANIGOVÁ M,et al.Production of γ-aminobutyric acid by microorganisms from different food sources[J].J Sci Food Agr,2015,95(6):1190-1198.
[12]XU N,WEI L,LIU J.Biotechnological advances and perspectives of gamma-aminobutyric acid production[J].World J Microbiol Biotechnol,2017,33(3):64-75.
[13]SONG H Y,YU R C.Optimization of culture conditions for gammaaminobutyric acid production in fermented adzuki bean milk[J].J Food Drug Anal,2017.https://doi.org/10.1016/j.jfda.2016.11.024
[14]LIAO W C,WANG C Y,SHYU Y T,et al.Influence of preprocessing methods and fermentation of adzuki beans on γ-aminobutyric acid(GABA)accumulation by lactic acid bacteria[J].J Functional Food,2013,5(3):1108-1115.
[15]SHAN Y,MAN C X,HAN X,et al.Evaluation of improved γ-aminobutyricacidproductionin yogurt usingLactobacillusplantarumNDC75017[J].J Dairy Sci,2015,98(4):2138-2149.
[16]WU Q,SHAH N P.High γ-aminobutyric acid production from lactic acid bacteria:emphasis onLactobacillus brevisas a functional dairy starter[J].Crit Rev Food Sci Nutr,2016,57(17):3661-3672.
[17]HAGI T,KOBAYASHI M,NOMURA M.Metabolome analysis of milk fermented by γ-aminobutyric acid-producingLactococcus lactis[J].J Dairy Sci,2016,99(2):994-1001.
[18]CODA R,RIZZELLO C G,GOBBETTI M.Use of sourdough fermentation and pseudo-cereals and leguminous flours for the making of a functional bread enriched of γ-aminobutyric acid(GABA)[J].Int J Food Microbiol,2010,137(2):236-245.
[19]BHANWAR S,BAMNIA M,GHOSH M,et al.Use ofLactococcus lactis to enrich sourdough bread with γ-aminobutyric acid[J].Int J Food Sci Nutr,2013,64(1):77-81.
[20]DIANA M,RAFECAS M,QUÍLEZ J.Sourdough bread enriched with γ-aminobutyricacid(GABA).Acomparison offree amino acid,biogenic amine and acrylamide content in GABA-enriched sourdough and commercial breads[J].J Cereal Sci,2014,60(3):639-644.
[21]WORAHARN S,LAILERD N,SIVAMARUTHI B S,et al.Evaluation of factors that influence the L-glutamic and γ-aminobutyric acid production duringHericium erinaceusfermentation by lactic acid bacteria[J].CyTA-J Food,2016,14(1):47-54.
[22]吴 伟,蔡勇建,林亲录,等.米糠贮藏时间对米糠清蛋白功能性质的影响[J].中国油脂,2015,40(10):15-19.
[23]周显青,杨继红,张玉荣.国内外米糠资源利用现状与发展[J].粮食加工,2014(5):24-29.
[24]严 聃.发酵法从米糠中提取高浓度γ-氨基丁酸粉末的工艺研究[J].湖南科技学院学报,2009,30(4):89-90.
[25]林亲录,李丽辉,王 婧,等.从米糠发酵液中筛选产γ-氨基丁酸的菌株[J].食品与机械,2008,24(3):6-9.
[26]何培新,李芳莉,郑 燕,等.浓香型白酒窖泥梭菌的分离及其挥发性代谢产物分析[J].中国酿造,2017,36(4):45-49.
[27]董 玲,姚英政,朱 宇.短乳杆菌发酵提高糙米中γ-氨基丁酸含量的研究[J].粮食与饲料工业,2016,12(3):19-22.
[28]YANG T,RAO Z,KIMANI B G,et al.Two-step production of gamma-aminobutyric acid from cassava powder usingCorynebacterium glutamicumandLactobacillus plantarum[J].J Ind Microbiol Biotechnol,2015,42(8):1157-1165.
[29]JORGE J M P,LEGGEWIE C,WENDISCH V F.A new metabolic route for the production of gamma-aminobutyric acid byCorynebacteriumglutamicumfromglucose[J].Amino Acids,2016,48(11):2519-2531.
[30]蒋冬花,高爱同,毕 珂,等.乳酸菌发酵小米糠生产γ-氨基丁酸的配方和条件优化[J].浙江师范大学学报:自然科学版,2013,36(1):6-10.
