黄酒中高级醇含量控制与检测研究进展
2018-01-31黄桂东吴子蓥唐素婷冯结铧钟先锋
黄桂东,吴子蓥,唐素婷,冯结铧,钟先锋*
(1.佛山科学技术学院 食品与科学工程学院,广东 佛山 528200;2.广东省传统发酵食品工程技术研究中心,广东 佛山 528200;3.广东省食品流通安全控制工程技术研究中心,广东 佛山 528200;4.佛山市酿造工程技术研究中心,广东 佛山 528200)
黄酒作为中华民族的瑰宝,经过几千年的发展,已经成为具有中国特色的酒类和具有发展潜力的酒种。黄酒是以大米、黍米为主要原料,利用酒药、麦曲或米曲所含的多种微生物共同作用酿制而成的发酵酒,与啤酒、葡萄酒并称世界三大古酒[1-3]。作为一种传统的酒精饮料,黄酒以其独特的风味和较高的营养价值而广受欢迎[4],被誉为“液体蛋糕”,其保健功能以及营养价值被人们渐渐熟知。研究表明[5],黄酒具有增强记忆能力、增强免疫能力、预防骨质疏松等多种保健功能,为人们所喜爱,因此,黄酒的消费群体正在逐渐扩大。
高级醇是指含3个以上碳原子醇类的总称,俗称杂醇油,是酒类发酵过程中产生的主要副产物,也是酒类主要香味和口味物质之一。黄酒中的高级醇主要有异丙醇、烯丙醇、正丙醇、异丁醇、正丁醇、叔丁醇、异戊醇、正戊醇、苯甲醇、β-苯乙醇等[6]。适量的高级醇赋予黄酒特有的醇香、丰满圆润和协调的口感,但高级醇的含量过高,就会产生异杂味和较强的致醉性,俗称“上头”[7]。因此,解决黄酒较强的致醉性、赋予黄酒丰满的口感、增加酒体的协调性等问题迫在眉睫。而这些问题均与黄酒中的高级醇有着不同程度上的联系,故而研究黄酒中高级醇的代谢途径、控制黄酒高级醇含量的策略、影响因素和检测方法是十分必要的。因此,本文对黄酒酿造过程中高级醇的主要代谢途径、酿造工艺对高级醇的影响及其含量的检测方法进行了探讨,以期为控制黄酒中高级醇含量提供参考。
1 黄酒中高级醇的代谢途径
发酵过程中酵母产生的高级醇是影响黄酒品质的重要因素之一[6]。高级醇主要来自于氨基酸的降解代谢和葡萄糖的合成代谢。在黄酒发酵过程中,随着酒精浓度的逐渐升高,部分酵母菌和部分乳酸杆菌自溶,伴随着大量氨基酸和多肽产生[8]。同时,氨基酸也是酵母发酵代谢的产物之一。因此,在黄酒的发酵过程中,氨基酸量多且种类丰富,从而间接导致高级醇的量大大增加,这就是黄酒高级醇含量比其他酿造酒中高级醇含量高的主要原因。
1.1 氨基酸降解途径产生高级醇
1907年,德国化学家艾利希尔提出高级醇是氨基酸脱氨氧化形成的。他认为亮氨酸和异亮氨酸通过水合酶的作用生成异戊醇和活性戊醇[9]。在其后的50年中,经过人们的不断探索发现:酒精发酵过程中,在微生物内通过Ehrlich途径代谢氨基酸,形成高级醇[10-11],氨基酸先经过转氨作用生成酮酸,再被还原脱羧生成比原氨基酸少一个碳原子的相应的高级醇,即Ehrlich途径[5](见图1)。常见的氨基酸对应的高级醇如图2所示。
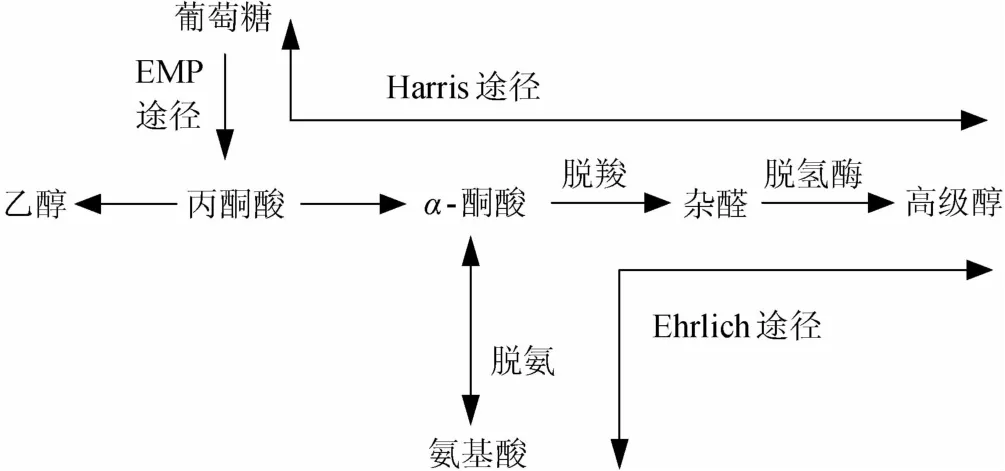
图1 氨基酸和葡萄糖降解代谢高级醇的Ehrlich途径和Harris途径Fig.1 Ehrlich pathway and Harris pathway of amino acids and glucose degradation and metabolism of higher alcohols
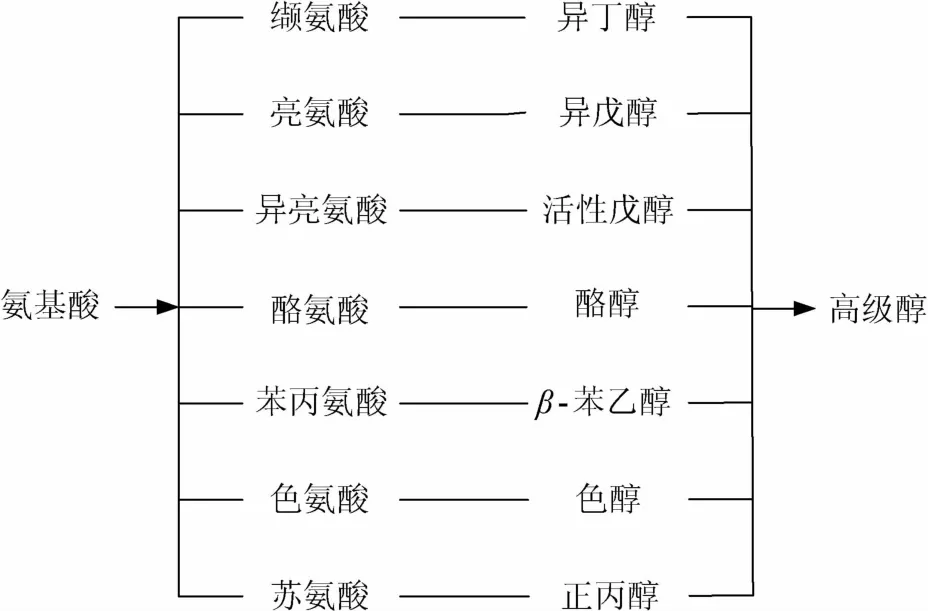
图2 常见氨基酸代谢的高级醇Fig.2 Higher alcohols of common amino acid metabolism
1.2 葡萄糖合成途径产生高级醇
1953年,HARRIS提出的高级醇的合成通过丙酮酸代谢途径[12]。1958年,THOUKI也提出了高级醇可以直接从葡萄糖的形成[5]。近年来,也有学者研究了高级醇由糖代谢通过丙酮酸脱羧后氧化而成的合成途径。该说法认为:在发酵过程中,由糖类提供氨基酸的生物合成骨架,在反应的中间阶段生成α-酮酸,并由此还原脱羧形成相应的高级醇[5](见图1)。该途径与发酵过程中酵母的糖代谢息息相关(见图3)。可见氨基酸是高级醇的主要前体物。因此,在发酵期间,氨基酸含量的多少是影响黄酒高级醇含量的主要因素之一。

图3 糖-氨基酸-高级醇代谢过程Fig.3 Metabolic process of glucose-amino acids-higher alcohols
2 影响黄酒高级醇含量的工艺因素
研究表明[13],在黄酒发酵过程中,生产原料、糖化剂、酵母和发酵温度等是影响高级醇含量的主要工艺因素。浙江工商大学蒋予箭教授团队主要是通过提高大米精白度[12]、改良酵母[5]、新旧工艺的实施[14]、先糖化后发酵工艺[15]、糖化剂的应用[16]来降低黄酒高级醇含量,取得了一定效果,经各改良策略实施后,降低了高级醇含量。
2.1 生产原料
黄酒生产原料有糯米、粳米、小麦、玉米、高粱等,不同品种的原料,其蛋白质含量各不相同,从而氨基酸由Ehrlich途径所生成的高级醇含量不同[5]。选用蛋白质含量低的原料,可减少黄酒中高级醇的含量。陈双等[17]研究表明,高粱、玉米发酵液中β-苯乙醇含量要高出糯米发酵液2倍多,这与其研究的高粱、玉米原料中的苯丙氨酸含量明显高于糯米原料的结果相吻合。荣智兴等[12]研究了不同精白度大米对黄酒主发酵阶段高级醇含量的影响,采用精米率分别为100%、90%、86%和80%的4种不同精白度大米酿造黄酒,主发酵结束后,样品高级醇总量分别为311.0 mg/L、391.1 mg/L、311.4 mg/L和259.9 mg/L,高级醇与乙醇的比值分别为5.20×10-5、4.43×10-5、3.89×10-5和3.60×10-5。表明精白度越高,黄酒的高级醇与乙醇的比值越低。经不同品种原料发酵酿造的黄酒,其高级醇含量不同,以高粱和玉米为原料酿制的黄酒高级醇含量比以糯米为原料的高;另外,以大米为原料时,大米精白度越高,黄酒的高级醇与乙醇的比值越低。
2.2 糖化剂
黄酒酿造的糖化剂主要是麦曲,在现代机械化生产黄酒中常采用生麦曲与熟麦曲混合使用的方式。酿酒酵母不产胞外酸性蛋白酶和酸性羧肽酶,故蛋白质主要被曲中的酸性蛋白酶和酸性羧肽酶降解,形成氨基酸,因此曲中这两种酶的多少对黄酒中高级醇的含量影响很大[18]。张兴亚等[14]研究了不同浓度的麦曲糖化发酵剂对黄酒中高级醇含量的影响,结果表明,当麦曲浓度从8%降至4%时,高级醇含量从489.1 mg/L降低至230.4 mg/L。龚耀平[19]研究了不同麦曲对黄酒中高级醇含量的影响,结果表明,生麦曲添加量从0增加到20 kg时,高级醇的含量从518.25 mg/L降至338.82 mg/L;熟麦曲添加量从3 kg增至25 kg时,高级醇含量在5 kg时最低,为301.32 mg/L。因此,降低麦曲糖化剂浓度和选用适当量的生、熟麦曲可以降低黄酒中高级醇的含量。
2.3 发酵温度
高品质黄酒的生产在很大程度上取决于发酵温度[20]。温度是酒酿造过程中酵母参与生化反应的重要外界因素,是诸多因素中最重要的条件之一。在发酵过程中,温度是决定黄酒质量的关键参数[21]。改变发酵温度会对酵母的生命活动造成一定程度的影响,从而影响酒中高级醇种类和含量及各高级醇之间的平衡。毛青钟[22]研究了不同发酵温度对黄酒质量的影响,结果表明,后酵温度低,有利于酵母的发酵作用,高级醇生成量较多;后发酵温度高,有利于细菌(如乳酸杆菌)的发酵作用,高级醇生成量较少。根据张兴亚[23]研究的不同发酵温度对黄酒中高级醇含量的影响表明,对于前发酵温度,当温度低于30℃时,高级醇含量随着温度的升高而升高,当温度高于30℃时,高级醇含量随着温度的升高而降低,但是高于34℃时黄酒有酸败现象;对于后发酵温度,高级醇含量随着温度升高而升高。
2.4 酵母的种类
高级醇是酵母合成细胞蛋白质时的副产物,而不同的酵母菌株有着各自不同的生理特性,因此在相同条件下生成的高级醇含量也存在差异。不同的酵母菌种生成高级醇的差别是很大的,可通过选育高级醇产量低的菌株、修饰氨基酸的不同透性酶基因等方法来降低发酵过程中高级醇的产量[24]。方维明等[25]研究了低含量高级醇啤酒酵母菌株的选育,将酵母经紫外灯照射诱变后,依次通过乳酸、麦芽汁-碳酸钙和氯化三苯基四氮唑(triphenyltetrazolium chloride,TTC)上层平板筛选,分离获得一株高级醇产量与未经紫外灯照射处理的酵母相比下降28.7%的目标菌株,使啤酒中高级醇含量由98.4 mg/L降至70.2 mg/L。杨鲁君等[26]研究了不同的黄酒酵母菌株对黄酒发酵过程中高级醇含量的影响,结果表明,不同的黄酒酵母菌株酿造成的黄酒中,其高级醇含量存在差异。YOSHIMOTO H等[27]对α-丙酮酸脱羧酶基因PDC1进行了研究,构建了相应的缺失突变株,结果显示异戊醇的浓度下降了31%。
除了生产原料、糖化剂、发酵温度和酵母的种类这4种因素之外,不同的酿造工艺、料水比、浸米时间、酵母接种量及增值倍数、酵母菌种同化氨基酸的能力等因素均在不同程度上影响着黄酒中的高级醇含量。龚耀平等[15]研究了先糖化后发酵的工艺对黄酒高级醇含量的影响,结果表明,在糖化后发酵工艺酒样中,后酵结束时高级醇含量为329.3 mg/L,低于双边发酵工艺(399.5 mg/L),因此,先糖化后发酵有利于降低高级醇的含量。
3 控制黄酒高级醇含量的策略
在酿酒酵母细胞中,高级醇合成受发酵体系中氮素营养状况调控[28]。氮素营养充足时,氨基酸经细胞质支链氨基酸转氨酶(cytosolicbranched-chainaminoacidaminotransferase,BCAT)作用脱氨生成α-酮酸,进一步在α-酮酸脱羧酶和乙醇脱氢酶作用下,生成高级醇[29]。该反应过程需要三羧酸循环(tricarboxylic acid cycle,TCA)提供氨基受体α-酮戊二酸(α-ketoglutarate,α-KG);氮素营养缺乏时,高级醇生成受酮酸溢出机制调控。氮源的耗尽触发糖酵解途径(又称EMP途径)关键酶(如磷酸果糖激酶、己糖激酶等)诱导表达,葡萄糖代谢活跃,生成大量的丙酮酸,丙酮酸经异构、脱氢、脱羧等反应生成α-酮酸,最后生成高级醇[30]。
根据高级醇与氮素营养的关系,并结合其合成途径,研究人员试图通过氮素补偿或氮素缺失策略降低酒中高级醇含量[12,31]。氮素是酵母细胞生长和代谢必不可少的元素,但并非所有的含氮物质都能被酵母用于细胞代谢途径。能被酵母利用的含氮物质称为酵母菌可同化氮(yeast assimilable nitrogen,YAN),主要包括:α-氨基酸(脯氨酸除外)、小分子的多肽和铵态氮[32]。研究表明[33],不同氮源的同化代谢是有序的,当培养基中同时存在多种氮源时,酿酒酵母通过氮代谢阻遏机制(nitrogencatabolite repression,NCR)优先选择更好的氮源[34]。酿酒酵母对不同氮源利用的先后顺序为:天冬氨酸、谷氨酰胺>铵盐>谷氨酸>缬氨酸、亮氨酸、异亮氨酸>脯氨酸、精氨酸[35]。氨基酸是高级醇的前体物质,降低氨基酸的含量势必会导致高级醇含量的降低。因此,大量研究侧重于氮素缺失策略,试图通过降低氨基酸的含量或阻断氨基酸代谢,进而降低高级醇含量。但对于复杂的黄酒发酵体系而言,在发酵初期(约1~2 d),YAN相对充足,其被快速利用,细胞经过氨基酸分解途径(Ehrlich途径)产生高级醇,这时产生的高级醇约占总高级醇含量的25%。而在发酵中后期(约2~20 d),尽管酿酒体系含有丰富的蛋白质和多肽,但由于酵母细胞几乎不向胞外分泌蛋白酶,故而酵母利用大分子有机氮源的能力很弱,导致了发酵过程中氮素相对缺乏,而碳源仍相对充足,在此条件下,细胞内经过生化合成途径(Harris代谢),大量合成高级醇,约75%的高级醇主要通过Harris代谢途径转化而来[36]。因此,通过氮素补偿策略,使黄酒发酵体系中有充足的YAN,此时,酵母主要由氨基酸途径(Ehrlich途径)进行发酵代谢,从而降低高级醇的生成量,因此氮素补偿策略能有望成为降低黄酒中高级醇含量的主要研究方向。通过添加铵盐可实现氮素补偿。傅红雪[37]通过向酵母发酵酿造而成的酒中添加345 mg/L磷酸氢铵和0.336 mg/L硫胺素,结果表明,与未添加铵盐的对照组相比,高级醇含量从281.64 mg/L降至175.28 mg/L。铵盐来源易得、价格低廉,且可被酵母高效转运及快速同化,成为工业化酿酒体系中潜在的氮源补偿剂。
4 黄酒中高级醇含量的检测方法
4.1 分光光度法
分光光度法是最早用来测定黄酒高级醇含量的方法。根据高级醇(正丙醇除外)经浓硫酸脱水后,转化为不饱和烃,与对二甲氨基苯甲醛发生缩合反应,生成橙黄色化合物的原理来测定[38],该法的优点在于操作简单,在设备条件有限的情况下,仍可以检测产品中的高级醇含量,但此方法只能检测黄酒中高级醇总含量,不能测定各不同组分的高级醇含量。杜威等[38]运用分光光度法检测了黄酒中的高级醇含量。因此,可用分光光度法来测定黄酒中高级醇的含量,但仍存在一些问题有待解决,如试剂的浓度和用量、如何消除黄酒本身带来的色差等。
4.2 气相色谱法
相较于分光光度法难以实现及时、快速测定和不能测定单一组分等缺陷,气相色谱有着独特的优势,可以迅速、敏捷和测定各组分高级醇的含量。气相色谱法分为内标法和外标法,内标法是通过对待测定高级醇含量的黄酒样品中添加高级醇标准品,以提高分析结果的准确度;外标法是通过利用高级醇标准品与待测样品作对照以提高定量分析的准确性。黄建明等[39]采用毛细管气相色谱法,以峰面积外标法定量测定黄酒中的高级醇,测得的相对标准偏差为0.01%~1.03%,因此该法精密度好,准确度高。尹桂豪等[40]用毛细管气相色谱法对黄酒中β-苯乙醇进行了检测,但在检测前,用正己烷对黄酒中的β-苯乙醇进行了萃取,防止了黄酒中的糖类和色素进入色谱体系,避免样品中β-苯乙醇对检测结果的干扰,缩短了检测时间。气相色谱是目前检测黄酒中高级醇较为普遍的方法,但气相色谱的仪器贵重,运行及维修费用均较高,不适在生产过程中快速检测高级醇。
4.3 其他方法
4.3.1 顶空固相微萃取-气相色谱质谱法
肖昭竞等[41-42]研究表明,高级醇还可用顶空固相微萃取-气相色谱质谱的方法进行测定,萃取温度和萃取时间为40℃和30 min,定量方法采用面积归一法,该分析方法快速简单,无干扰。另外,固相微萃取技术不需要使用有毒的有机溶剂,检测界限低,一步实现分析物的提取、浓缩,并具有良好的线性相关性;该方法还具有很高的灵敏度,曾诗雨等[43]使用该法进行酒酿中乙醇测定,检测限为11.92μg/g,但也有操作复杂、耗时长、需消耗大量的吹扫气体(氮气)和捕集材料等缺点,该方法不适用于在实际生产中快速检测高级醇。
4.3.2 薄层层析法
利用高级醇可显色的特性,本团队拟探索建立一种检测高级醇的方法—薄层层析法。相较于其他方法,薄层层析不借助任何设备,仅利用实验室常见的仪器和试剂即可半定量的检测黄酒中不同种类高级醇的含量,测定结果分离速度快、灵敏度和分辨率都较高[44]。薄层层析操作方便,测定成本低,可应用于生产实践中,十分具有商业开发价值。但目前,针对用薄层层析方法检测高级醇具体所要使用的展开剂、显色剂以及相关细节仍在研究当中,若该法在实验室可行并得到可靠的结果,即可在生产中付诸于实践,便于在生产过程中,简单快速的检测高级醇。
5 结论
黄酒作为一种古老的酿造酒,已被人们饮用上千年,其中含有的高级醇可增强饮用的口感,但会致醉,因此,研究黄酒中高级醇对提高黄酒品质有重要意义。黄酒中的高级醇由两条途径合成,分别是以葡萄糖为原料的Harris途径和以氨基酸为原料的Ehrlich途径;在酿造过程中生产原料的种类、糖化剂的使用情况、酵母的种类和发酵温度都会影响高级醇的含量,通过控制以上工艺条件可降低黄酒中高级醇含量,此外,亦可通过氮素补偿策略或氮素缺失策略降低黄酒中高级醇含量;对于黄酒中高级醇含量可通过分光光度法、气相色谱法、顶空固相微萃取-气相色谱质谱进行含量的测定。另外,本团队拟探索建立薄层层析法测定黄酒中高级醇的含量,该法操作简便,成本低,用于生产实践过程中,具有商业开发价值。在生产实践过程中,如何通过控制工艺条件来控制高级醇的代谢以及在如何检测黄酒中的高级醇含量,将会是日后的研究方向,对黄酒的生产实践也具有重要的指导意义。
[1]JIAO A Q,XU X M,JIN Z Y.Research progress on the brewing techniques of new-type rice wine[J].Food Chem,2017,215:508-515.
[2]HONG X T,CHEN J,LIU L.Metagenomic sequencing reveals the relationship between microbiota composition and quality of Chinese rice wine[J].Sci Rep,2016,6:26621-26626.
[3]LU Q Y,LEE R P,HUANG J J,et al.Quantification of bioactive constituents and antioxidant activity of Chinese yellow wine[J].J Food Compos Anal,2015,44:86-92.
[4]WANG P X,MAO J,MENG X Y,et al.Changes in flavour characteristics and bacterial diversity during the traditional fermentation of Chinese rice wines from Shaoxing region[J].Food Control,2014,44(44):58-63.
[5]张兴亚,林 玲,蒋予箭.黄酒中高级醇含量控制的研究进展[J].中国酿造,2011,30(10):13-16.
[6]ZHANG C Y,QI Y N,MA H X,et al.Decreased production of higher alcohols bySaccharomyces cerevisiaefor Chinese rice wine fermentation by deletion of Bat aminotransferases[J].J Ind Microbiol Biotechnol,2015,2(4):617-625.
[7]闫春明.降低新酿黄酒中高级醇含量研究[D].合肥:合肥工业大学,2017.
[8]毛青钟.关于黄酒发酵过程中成分变化的探讨[J].中国酿造,2004,23(12):1-5.
[9]罗惠波,苟云凌,叶光斌,等.影响白酒中高级醇生成的工艺条件研究[J].中国酿造,2011,30(8):87-90.
[10]SIZOV A,KRUPNOV I,MELEDINA T.Intensification of higher alcohols biosynthesis-an advanced feedstock for biofuel production[J].Energ Procedia,2017,113:333-338.
[11]NOZZI N E,DESAI S H,CASE A E,et al.Metabolic engineering for higher alcohol production[J].Metab Eng,2014,25:174-182.
[12]荣智兴,周建弟,钱 斌,等.大米精白度对黄酒主发酵阶段高级醇含量的影响[J].中国酿造,2013,32(1):28-32.
[13]孔小勇,冷云伟,孙 然,等.影响黄酒中高级醇含量的工艺因素探讨[J].中国酿造,2011,30(10):163-165.
[14]张兴亚,高梦莎,蒋予箭.糖化发酵剂对黄酒中高级醇含量的影响[J].中国酿造,2012,31(1):130-133.
[15]龚耀平,周建弟,钱 斌,等.不同酿造工艺对黄酒理化指标及高级醇含量影响的研究[J].中国酿造,2013,32(2):37-40.
[16]周建弟,蒋予箭,邹慧君,等.新旧工艺黄酒发酵过程中主要高级醇的变化研究[J].中国酿造,2012,31(8):29-32.
[17]陈 双,罗 涛.我国黄酒酵母和酿酒原料对黄酒中β-苯乙醇含量的影响[J].中国酿造,2009,28(4):23-26.
[18]毛青钟.浅谈机械化黄酒中高级醇含量的控制[J].酿酒,2000(1):35-36.
[19]龚耀平.糖化剂、发酵剂对黄酒发酵中高级醇和尿素积累的影响[D].杭州:浙江工商大学,2014.
[20]LIU D F,ZHANG H T,XIONG W L,et al.Effect of temperature on Chinese rice wine brewing with high concentration presteamed whole sticky rice[J].Biomed Res Int,2015,2014(1):426929.
[21]LIU D F,ZHANG H T,LIAN Z Z,et al.Optimization of rice wine fermentation process based on the simultaneous saccharification and fermentation kinetic model[J].Chin J Chem Eng,2016,24(10):1406-1412.
[22]毛青钟.不同后发酵温度对黄酒质量的影响研究[J].中外食品,2013(9):74-81.
[23]张兴亚.黄酒中高级醇含量控制的工艺研究[D].杭州:浙江工商大学,2012.
[24]王国正,吴 群,徐 岩.低产高级醇酿酒酵母突变菌株的差异蛋白组分析及高级醇合成相关蛋白的差异表达[J].微生物学通报,2015,42(12):2407-2416.
[25]方维明,汪志君,高 庆,等.低含量高级醇啤酒酵母菌株的选育[J].南京农业大学学报,2005,28(1):61-65.
[26]杨鲁君,蒋予箭,李余动.黄酒酵母优良抗逆菌株的筛选、鉴定及发酵特性研究[J].中国食品学报,2013,13(9):71-77.
[27]YOSHIMOTO H,FUKUSHIGE T,YONEZAWA T.Pyruvate decarboxylase encoded by thePDC1gene contributes,at least partially,to the decarboxylation of alpha-ketoisocaproate for isoamyl alcohol formation inSaccharomyces cerevisiae[J].J Biosci Bioeng,2001,92(1):83-85.
[28]ROLLERO S,BLOEM A,CAMARASA C,et al.Combined effects of nutrients and temperature on the production of fermentative aromas by Saccharomyces cerevisiaeduring wine fermentation[J].Appl Microbiol Biotechnol,2015,99(5):2291-2304.
[29]PARK S H,KIM S,HAHN J S.Metabolic engineering ofSaccharomyces cerevisiaefor the production of isobutanol and 3-methyl-1-butanol[J].Appl Microbiol Biotechnol,2014,98(21):9139-9147.
[30]ESPINOSA V E,MORAIS M A,FRANÇOIS J M,et al.Biosynthesis of higher alcohol flavour compounds by the yeastSaccharomyces cerevisiae:impact of oxygen availability and responses to glucose pulse in minimal growth medium with leucine as sole nitrogen source[J].Yeast,2015,32(1):47-56.
[31]CLEMENT T,PEREZ M,MOURET J R,et al.Metabolic responses of Saccharomyces cerevisiaeto valine and ammonium pulses during fourstage continuouswine fermentations[J].Appl Environ Microbiol,2013,79(8):2749-2758.
[32]杨瑞娟,吴雪昌.酿酒酵母体内氮的代谢作用[J].农业科技,2008(1):41-45.
[33]ZHAO S H,ZHAO X R,ZOU H J,et al.Comparative proteomic analysis ofSaccharomyces cerevisiaeunder different nitrogen sources[J].J Proteomics,2014,101:102-112.
[34]ZHAO X,ZOU H,FU J,et al.Nitrogen regulation involved in the accumulation of urea inSaccharomyces cerevisiae[J].Yeast,2013,30(11):437-447.
[35]张伟平,赵鑫锐,堵国成,等.酿酒酵母氮代谢物阻遏效应及其对发酵食品安全的影响[J].应用与环境生物学报,2012,18(5):862-872.
[36]周世水.控制啤酒中高级醇含量的研究[J].酿酒,2005,33(3):51-53.
[37]傅红雪.添加氮源和维生素对发酵蓝莓酒品质的影响[D].合肥:安徽农业大学,2015.
[38]杜 威,林 玲,张兴亚,等.分光光度法测定黄酒中的高级醇[J].酿造科技,2011(7):104-107.
[39]黄建明,黄 镇,黄祖新.气相色谱法测定黄酒中的高级醇[J].福建分析测试,2009,18(2):26-30.
[40]尹桂豪,吴月仙,章程辉,等.气相色谱法测定黄酒中β-苯乙醇的含量[J].中国酿造,2008,27(9):74-75.
[41]肖昭竞,朱永红,胡 华,等.顶空固相微萃取气质联用分析白酒中高级醇和酯类[J].食品与发酵科技,2009,45(3):63-66.
[42]DACK R E,BLACK G W,KOUTSIDIS G,et al.The effect of maillard reaction products and yeast strain on the synthesis of key higher alcohols and esters in beer fermentations[J].Food Chem,2017,232:595-601.
[43]曾诗雨,赵丽丽,王可兴,等.固相微萃取-气相色谱法测定全麦酒酿中乙醇含量[J].食品安全质量检测学报,2017,8(4):1397-1403.
[44]尹 丽,宗兰兰,蒲晓辉,等.薄层色谱法在药物分析中的应用[J].河南大学学报:医学版,2016,35(2):77-80.
