沉香型酒醅中产香芽孢杆菌的分离鉴定及代谢产物分析
2018-01-31吴树坤杨玲麟黄治国
吴树坤,杨 磊,杨玲麟,余 辉,黄治国*
(1.四川理工学院 酿酒生物技术及应用四川省重点实验室,四川 自贡 643000;2.中国沈酒集团,四川 泸州 646000)
中国白酒以开放式固态酿造、多菌复合发酵的独特方式,在世界蒸馏酒中独树一帜。根据其不同的酿造工艺及独特口感主要分为浓、清、米、酱四大香型,在此基础上又衍生出了许多其他的香型,沉香型白酒是在清、浓、酱三大香型的基础上创新研发出的一种新的香型。沉香型白酒生产用曲为高温大曲,其加入了26种中药材使沉香型白酒中带有药香,将大曲拌入混合粮(高粱、稻壳和母糟)中进行堆积后,再入窖发酵[1]。独特的工艺使得沉香型白酒具有清澈透明,清、浓、酱香气馥郁,沉香怡人、醇厚绵甜、圆润协调、余味爽净等典型风格。
近年来,随着白酒行业的发展,研究人员对白酒酿造过程中的微生物体系研究越来越多,其中芽孢杆菌的功能性被多次报道[2-4],许多芽孢杆菌都具有产淀粉酶、蛋白酶等能力,且大多数芽孢杆菌具有很强的环境适应力,这有利于酿造过程中酶系的积累和原料的利用。故分离并应用具有优良性能的芽孢杆菌具有重要的意义。赵长青等[5]从浓香型酒醅及其大曲中分离得到一株产己酸乙酯较高且产正丙醇较低的蜡质芽孢杆菌,其产己酸乙酯的含量达到国标高度优级酒的范围;杨春霞等[6]从牛栏山二锅头酒醅中分离得到5株产风味较好的芽孢杆菌,其中地衣芽孢杆菌(Bacillus licheniformis)、蜡样芽孢杆菌(Bacillus cereus)和两株枯草芽孢杆菌(Bacillus subtilis)主要代谢的风味物质为3-羟基-2-丁酮,而短小芽孢杆菌(Bacillus pumilus)的主要风味物质为苯乙醇。目前尚鲜见有关于沉香型白酒的研究报道,因此研究沉香型白酒的独特之处具有重要意义。本试验采用沉香型酒醅为材料,通过对沉香型酒醅中芽孢杆菌的分离筛选,结合16S rDNA序列分析和固相萃取和气质联用(gas chromatography-mass spectrometry,GC-MS)法对分离得到的芽孢杆菌进行产酶特性、温度耐受性和产风味物质能力进行研究,旨在为沉香型白酒的发展提供一定的理论指导。
1 材料与方法
1.1 材料与试剂
酒醅样品取自四川省泸州市某常年生产沉香型白酒的酒厂,取上、下层出窖糟醅且均匀混合,置于冰盒中迅速运回,4℃保存。
干酪素、氯化钠、可溶性淀粉、碘、异戊醇、0.1 mol/L磷酸钠(Na3PO4)(均为分析纯):成都科龙化工试剂厂;氯仿(分析纯):重庆川东化工(集团)有限公司;饱和酚、20%十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、0.1 mol/L乙二胺四乙酸二钠(ethylenediamine tetraacetic acid disodium salt,EDTA-2Na)、2%十六烷基三甲基溴化铵(hexadecyl trimethylammonium bromide,CTAB)(均为分析纯):北京索莱宝科技有限公司;0.1mol/L三羟甲基氨基甲烷(Trisbase)(分析纯):美国Sigma-Aldrich公司。
可溶性淀粉培养基:牛肉膏3 g,蛋白胨10 g,琼脂20 g,NaCl 5 g,淀粉2 g,蒸馏水1 L,pH值调至7.2±0.1,121℃灭菌20 min。
牛肉膏蛋白胨液体培养基:牛肉膏3 g,蛋白胨10 g,琼脂20 g,NaCl 5 g,蒸馏水1 L,pH值调至7.2±0.1,121℃灭菌20 min。
酪蛋白琼脂培养基:牛肉膏3 g,酪蛋白10 g,琼脂20 g,NaCl 5 g,KH2PO42 g,溴百里香酚蓝0.05 g,蒸馏水1 L,pH值调至7.4±0.1,121℃灭菌20 min。
玉米粉液体培养基[6]:玉米粉60 g,KH2PO43 g,蔗糖10 g,MgSO4·7 H2O 1.5 g,蒸馏水1 L,自然pH,121 ℃灭菌20 min。
1.2 仪器与设备
ZWYR-D2403摇床:上海智城分析仪器制造有限公司;HWS-12恒温水浴锅:上海一恒科学仪器有限公司;Lynx6000高速落地离心机:赛默飞世尔科技有限公司;7890B 5977 GC-MS仪:美国Agilent公司;Mini-Subce11水平电泳仪、ChemiDoc XRS+化学发光成像系统:美国Bio-Rad公司;Precellys24均质机:法国Bertin Technologies公司。
1.3 方法
1.3.1 酒醅中芽孢杆菌的分离
称取25 g酒醅样品,将其加入装有225 mL无菌生理盐水的锥形瓶中,置于摇床振荡30 min,使菌体悬浮。
采用梯度稀释涂布法分离酒醅中的芽孢杆菌,将菌悬液稀释10-1、10-2、10-3、10-4、10-5倍并分别涂布于平板,37 ℃条件下培养24 h,将所观察到的不同形态特征的菌落进行再次划线纯化,从平板中挑取少量单菌落进行革兰氏染色,并将纯化后所得菌种进行斜面保种,放置于4℃。
1.3.2 芽孢杆菌16S rDNA序列分析
(1)芽孢杆菌DNA提取
将不同形态的单菌落接种至牛肉膏蛋白胨液体培养基中,37℃、160 r/min摇床培养24 h,取2 mL培养液于离心管,13000r/min离心10min,去掉上清液,收集菌体沉淀(共2~3次);向离心管中加入适量玻璃珠和700 μL DNA提取液,吹打振荡使菌体重悬,加入50 μL 20%SDS,充分混匀后,用匀质器进行机械破壁;随后加入750 μL酚-氯仿-异戊醇(25∶24∶1,V/V),剧烈振荡1min,静置5min,13000r/min离心5 min;取上层清液于新的离心管,加入0.6倍体积的异丙醇,室温下沉淀30min;13000r/min离心15min,弃掉上清液,加入1mL体积分数为70%的乙醇洗涤沉淀,13000r/min离心5 min后,弃掉上层乙醇溶液(重复一次);放置于超净台吹风20 min,使DNA沉淀吹干,随后加入100 μL双蒸水使DNA溶解。
(2)DNA的扩增及PCR产物检测
将1.3.2(1)所得到的DNA溶液作为扩增模板,采用通用引物27f-1492R进行聚合酶链反应(polymerase chain reaction,PCR)扩增;25 μL反应体系:10×Buffer 2.5 μL,2.5 mmol/L脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP)2 μL,上下游引物各0.5 μL,DNA模板0.3 μL,Taq酶0.5 μL,加双蒸水至25 μL。扩增程序:94℃预变性4 min;94℃变性1 min,55℃退火1 min,72℃延伸1 min,30个循环后,72℃延伸10 min。随后用1%琼脂糖凝胶电泳,成像对PCR产物进行检测。
(3)测序结果分析
将测序结果与美国国家生物技术信息中心(National Center of Biotechnology Information,NCBI)数据库进行比对,选出序列同源性最高的序列,然后用Mega 5.0软件构建系统发育树。
1.3.3 温度耐受性试验
将牛肉膏蛋白胨液体培养基分装10 mL至试管,灭菌待用,然后将不同菌株种子液(108CFU/mL)以2%的接种量加入试管,分别放于40℃、45℃、50℃、55℃、60℃培养24 h,测定其吸光度值(OD600nm)。
1.3.4 产酶特性研究
(1)淀粉酶透明圈的测定
将活化好的菌用三点法点接到可溶性淀粉培养基培养48 h,观察生长状况,用0.5%的碘液(I2∶KI=1∶2)进行染色。并记录其中3个透明圈直径(D)和菌落直径(d),并计算其平均比值(D/d)。
(2)蛋白酶透明圈的测定
将活化好的菌用三点法点接到酪蛋白琼脂培养基上培养48 h,观察生长状况,并记录其中3个透明圈直径(D)和菌落直径(d),并计算其平均比值(D/d)。
1.3.5 代谢产物分析
从平板上分别挑取一环菌体接种至100 mL牛肉膏蛋白胨液体培养基于37℃、160 r/min条件下培养24 h,再以2%(108CFU/mL)的接种量接入装有100 mL玉米粉液体培养基的锥形瓶中,于37℃、160 r/min条件下培养40 h。结束发酵后,取5 mL玉米发酵液进行顶空固相微萃取,再用气相色谱-质谱(GC-MS)分析其代谢产物。
固相微萃取条件:在顶空瓶中加入5 mL玉米发酵液和2 gNaCl,55℃预热15 min,萃取吸附30 min,GC解吸3 min,用于GC-MS分析。
气相色谱(GC)条件:DB-WAX毛细管色谱柱(60.0 m×0.25 mm×0.25 μm);进样口温度230 ℃;分流比100∶1;程序升温:40℃保持3 min,6℃/min升至180℃,保持3 min,再以10℃/min升至230℃保持5 min;载气:纯度为99.999%氦气,载气流速:0.8 mL/min。
质谱(MS)条件:电离方式为电子电离(electron ionization,EI)源,电子能量70 eV,离子源温度230℃,四极杆温度150℃,传输线温度230℃,全扫描模式,扫描质量范围25~500 amu,溶剂延迟3 min。
定性分析:质谱图通过与美国Agilent公司提供的美国国家标准技术研究所(national institute of standards and technology,NIST)标准普库05a.L进行比对,选择匹配度均>800(最大值为1 000)、特征离子进行定性分析[7]。并采用面积归一化法进行定量分析,根据某一物质的色谱峰面积与总峰面积的比值求出其相对含量。
1.3.6 数据处理
试验结果用平均值±标准差(x¯±SD)表示,利用SPSS 20软件对相关数据进行差异显著性分析,运用Excel 2010进行作图和建表。
2 结果与分析
2.1 酒醅中芽孢杆菌的分离
根据菌落形态差异并结合闻香法分离得到4株芽孢杆菌,编号为A、B、F、G,其菌落形态及菌株形态见图1。结果表明,所得的4株菌革兰氏染色菌呈紫色,即均为革兰氏阳性菌且通过平板闻香均具有较好的香味。由图1A可知,菌株A的菌落呈奶白色,菌落表面光滑且湿润,易挑取;由图1B可知,菌株B的菌落呈暗红色,菌落扁平,表面光滑且湿润,易挑取;由图1F可知,菌株F的菌落表面干燥且有许多褶皱,菌落中心呈火山状,不易挑取;由图1G可知,菌株G的菌落呈淡黄色,菌落扁平粗糙,边缘隆起。由此可确定分离所得的菌株均是不同的。
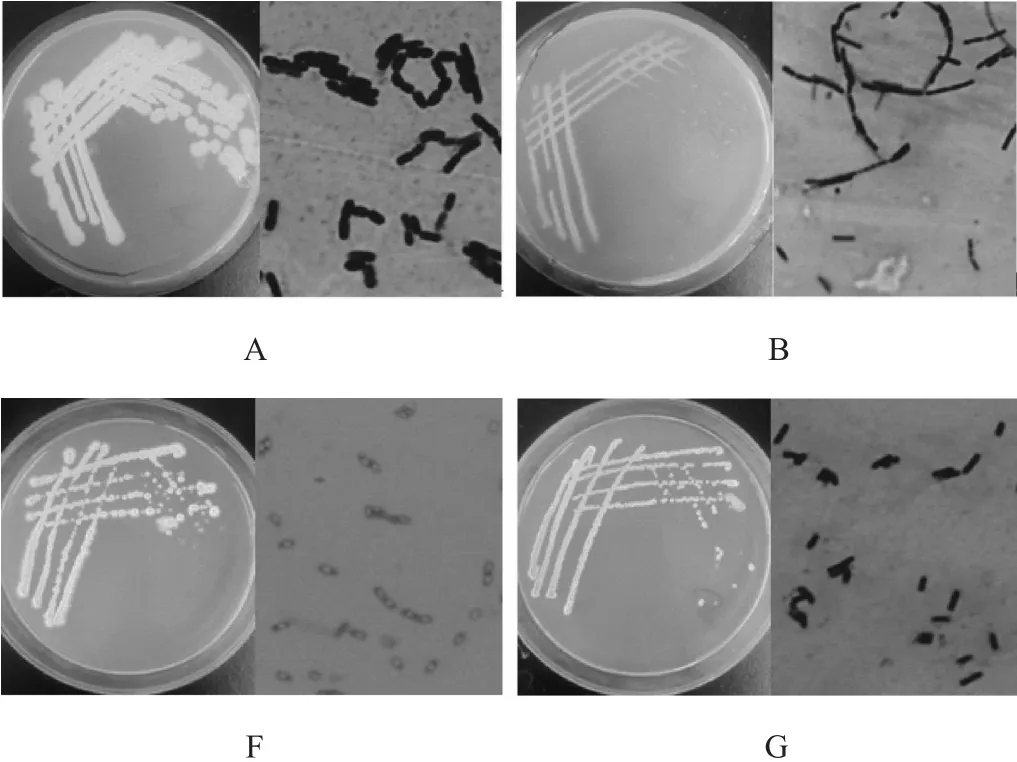
图1 各菌株菌落及细胞形态Fig.1 Bacterial colony and cell morphology of each strain
2.2 芽孢杆菌16S rDNA序列分析
4株芽孢杆菌16SrDNAPCR扩增的电泳图如图2所示,PCR产物片段大约在1 500 bp左右,条带很亮无明显拖尾,阴性对照无条带,说明反应体系无污染,故满足测序要求。

图2 4株芽孢杆菌16S rDNA PCR扩增结果Fig.2 PCR amplification results of 16S rDNA of 4Bacillusstrains

图3 菌株A、B、F、G 16S rDNA序列的系统发育树Fig.3 Phylogenetic tree of 16S rDNA sequences of strains A,B,F and G
将测序结果在NCBI数据库中进行16S rDNA序列同源性比较,选取同源性≥99%的菌株序列,运用Mega 5.0软件构建系统发育树,结果见图3。由图3可知,菌株A为阿式芽孢杆菌(Bacillusaryabhattai),菌株B为地衣芽孢杆菌(Bacillus licheniformis),菌株F为枯草芽孢杆菌(Bacillus subtilis),菌株G为解淀粉芽孢杆菌(Bacillus amyloliquefaciens)。
2.3 芽孢杆菌的温度耐受性试验
通过在不同温度条件下对所得菌株A、B、F、G进行培养,结果见图4。由图4可知,菌株A、F、G在40℃时都能生长良好,但随着温度升高,OD600nm值急剧下降,50℃时,几乎不生长了。而菌株B却有所不同,在50℃时,OD600nm值最大,生长的最好。这表明菌株B的耐热能力较好,具有一定的嗜热性,在相对高温的条件下也具有很强的生长能力,耐高温细菌在白酒酿造中也是重要的优势菌之一。这与吴群等[8-9]关于地衣芽孢杆菌的耐热性研究和描述是一致的。

图4 不同温度下各芽孢杆菌的生长状况Fig.4 Growth status ofBacillusstrains under different temperature conditions
2.4 芽孢杆菌的产酶特性
2.4.1 芽孢杆菌的蛋白酶透明圈试验结果
各芽孢杆菌产蛋白酶的透明圈如图5所示,透明圈直径与菌落直径比值(D/d)结果如图6所示。由图6可知,透明圈直径与菌落直径比值(D/d)在2.2~3.4,其中菌株B的蛋白酶的D/d值最大,达3.4,其次是菌株G,经多重比较分析,菌株B和G所产蛋白酶的D/d值显著高于其他两株菌(P<0.05)。从而可以表明,菌株B和G在一定程度上具有较高蛋白酶活力[10]。微生物通过产生蛋白酶水解原料中的蛋白质,不仅可以摄取营养更利于自身生长,还可以产生使酒体风味更丰满的醇类物质[11]。

图5 各芽孢杆菌产蛋白酶透明圈结果Fig.5 Translucent circle results of protease produced byBacillusstrains

图6 不同芽孢杆菌菌株产蛋白酶D/d值比较Fig.6 Comparison of D/d values of protease produced by differentBacillusstrains
2.4.2 芽孢杆菌的淀粉酶透明圈试验结果
各芽孢杆菌菌产淀粉酶的透明圈如图7所示,透明圈直径与菌落直径比值(D/d)结果如图8所示。由图8可知,透明圈直径与菌落直径比值(D/d)在1.8~2.9,其中菌株B的淀粉酶D/d值最大,达2.92,显著高于其他3株菌(P<0.05),而菌株F和G淀粉酶D/d值差异不显著(P>0.05),但显著高于菌株A淀粉酶D/d值(P<0.05)。故菌株B产淀粉酶能力较好。

图7 各芽孢杆菌产淀粉酶透明圈结果Fig.7 Translucent circle results of amylase produced by differentBacillusstrains

图8 不同芽孢杆菌菌株产淀粉酶D/d值比较Fig.8 Comparison of D/d values of amylase produced by differentBacillusstrains
结合温度耐受性试验可见,菌株B不仅在高温条件下能稳定生长,蛋白酶和淀粉酶透明圈D/d值也是最大的,这说明菌株B在酿造过程中具有更好的生长代谢能力且在高温条件下具有很大的优势。故可推断菌株B在沉香型酒醅发酵过程中具有很大积极的作用。
2.5 芽孢杆菌的发酵产物分析结果
根据1.3.5节的方法对各菌的发酵液中的风味物质进行了分析,并与空白培养基相比较,分析了4株芽孢杆菌发酵产物中的风味物质,总离子流色谱图见图9,各风味物质含量鉴定结果见表1。

图9 不同芽孢杆菌菌株发酵液中风味物质的GC-MS分析总离子流色谱图Fig.9 Total ion chromatograms of flavor compounds in fermentation broth of differentBacillusstrains analysis by GC-MS

表1 不同芽孢杆菌菌株发酵液中风味物质的GC-MS分析结果Table 1 GC-MS analysis results of flavor compounds in fermentation broth of differentBacillusstrains
由图9及表1可知,4株芽孢杆菌分别一共检测得到23种物质,其中主要包括醇类、酸类、酮类和其他化合物。对各菌发酵产物进行分析发现,3-羟基-2-丁酮和2,3-丁二醇是各菌的主要产物,二者之和分别占各菌发酵液的32.1%、52.7%、58.1%、75.4%,且3-羟基-2-丁酮具有特有奶油香味,是广泛使用的食用香料,广泛存在于水果、肉类等许多食品中[12],3-羟基-2-丁酮还是酿造过程中美拉德反应的前驱物质和传统食品发酵中重要的风味物质四甲基吡嗪合成的前提物质,也是中国白酒风味中重要的微量成分之一[13]。此外,菌株A较其他3株菌产3-甲基戊酸和异丁酸的能力更强,分别占35.5%和9.6%。菌株B、F产3-甲基丁酸的能力也较强,分别占29%和12%。具有特殊芳香气味的愈创木酚只在菌株B、F发酵液中被检测出来,且菌株F发酵液中还检测出了少量的乙酸(0.95%)和具有芳香气味的甲酸异丙酯(2.043%);此外,仅在G菌发酵液中检测出了少量的浓香型白酒重要的风味物质丁酸(1.355%)和己酸(0.542%)。这些物质均是白酒中重要的风味成分,但不同的菌株所产的风味物质又具有一定的差异性,使得风味更加丰富。通过分析检测出的风味物质,发现了吡嗪合成所需的前体物质3-羟基-2-丁酮,而吡嗪类物质对酱香型白酒风味具有重要贡献;此外,还检测到了乙酸、丁酸、己酸等有机酸,这些有机酸是合成乙酸乙酯、丁酸乙酯和己酸乙酯的重要底物,也是清香型白酒和浓香型白酒的风味成分之一。综合来看,基本符合沉香型白酒清、浓、酱香气馥郁的风味特点。由此可见,沉香型酒醅中筛选所得的产香芽孢杆菌对沉香型白酒独特风味的形成具有非常重要的作用。
3 结论
沉香型酒醅中分离筛选得到4株产香能力较好的芽孢杆菌,分别鉴定菌株A为阿式芽孢杆菌(Bacillusaryabhattai)、菌株B为地衣芽孢杆菌(Bacillus licheniformis)、菌株F为枯草芽孢杆菌(Bacillus subtilis)、菌株G为解淀粉芽孢杆菌(Bacillus amyloliquefaciens)。阿式芽孢杆菌能快速高效的溶解难溶性磷[14],且具有较强的抗辐射能力[15],这将会为发酵环境提供更多的有效磷,有利于某些微生物生长代谢。而菌株B、F、G都是与产酱香有关的重要细菌[16-17]。其中菌株B地衣芽孢杆菌(Bacillus licheniformis)具有较强的耐高温的能力,在50℃也能稳定生长,且其在淀粉酶和蛋白酶试验中水解圈D/d值均最大;芽孢杆菌属(Bacillussp.)对环境的适应力极强,广泛存在于酿造环境中,是各类酶系的重要产生菌,同时也是酒体风味物质的主要产生菌,对白酒的生产和风味均有重要作用。
通过对各芽孢杆菌发酵产物进行分析,一共检测得到23种物质,其中主要包括醇类、酸类、酮类和其他化合物。其中3-羟基-2-丁酮、乙酸、丁酸、己酸等风味物质的特征可基本体现沉香型白酒清、浓、酱香气馥郁的风味特点。
通过本试验可说明沉香型酒醅是多菌复合发酵并相互作用产生多种具有特殊风味物质的场所,由于不同菌株产风味物质的不同,使得风味物质种类更加丰富。将分离筛选出的优良产香菌株加入沉香型白酒酿造过程中,对沉香型白酒的风味形成及酒质的提高都具有重要的指导意义。
[1]沈云丙,赖高淮,沈怡方,等.沉香型大曲及其制曲工艺、沉香型白酒及其生产方法,CN106497736A[P].2017-03-15.
[2]邓 杰,黄治国,卫春会,等.基于高通量测序的浓香型白酒窖池细菌群落结构分析[J].现代食品科技,2015,31(7):50-55.
[3]袁庆云.酱香型白酒发酵过程中微生物的功能研究[J].酿酒,2016,43(4):15-20.
[4]陈 漫.浓香型白酒功能曲品控标准及工艺影响因素的研究[D].北京:中国矿业大学,2016.
[5]赵长青,徐 莎,杨 阳,等.浓香型白酒酿造大曲及糟醅中功能芽孢杆菌的筛选[J].食品工业科技,2017,38(7):151-155.
[6]杨春霞,廖永红,刘峻雄,等.牛栏山二锅头酒醅中芽孢杆菌分离鉴定及发酵风味分析[J].食品工业科技,2012,33(9):69-74.
[7]曹长江.孔府家白酒风味物质研究[D].无锡:江南大学,2014.
[8]吴 群,徐 岩.高温大曲中地衣芽胞杆菌(Bacillus licheniformis CGMCC3963)的耐高温特征[J].微生物学报,2012,52(7):910-915.
[9]布坎南,吉本斯.伯杰细菌鉴定手册.8版[M].北京:科学出版社,1984:729-758.
[10]马桂珍,暴增海,王淑芳,等.高产蛋白酶细菌的分离筛选及其种类鉴定[J].食品科学,2011,32(21):183-187.
[11]沈怡方.我国白酒生产技术进步的回眸[J].酿酒科技,2002(6):24-28.
[12]韩 丽,赵祥颖,刘建军.乙偶姻的性质、生产及应用[J].齐鲁工业大学学报,2007,21(4):80-83.
[13]庄名扬.乙偶姻与美拉德反应[J].酿酒,2010,37(2):99-100.
[14]王 琰.解磷芽孢杆菌的筛选鉴定及其对玉米促生机理的研究[D].广州:华南农业大学,2016.
[15]冯 玮,张 蕾,宣慧娟,等.西藏土壤中耐辐射阿氏芽胞杆菌T61的分离和鉴定[J].微生物学通报,2016,43(3):488-494.
[16]王 婧.酱香大曲中产吡嗪类物质芽孢杆菌的筛选及其应用研究[D].贵阳:贵州大学,2016.
[17]张 荣.产酱香功能细菌的筛选及其特征风味化合物的研究[D].无锡:江南大学,2009.
