β—细辛醚对Aβ1—42联合2—VO致AD大鼠的保护作用及机制初探
2018-01-29王博林宣玲戴世杰姬丽婷李昌煜杨元宵
王博林+宣玲+戴世杰+姬丽婷+李昌煜+杨元宵
[摘要] 该文通过侧脑室注射Aβ1-42联合2-VO建立AD大鼠模型,探究β-细辛醚对该模型学习记忆障碍的保护作用,并初步探讨其作用机制。将105只大鼠随机分为7组,分别为假手术组、AD模型组、β-细辛醚低、中、高剂量组(10,20,30 mg·kg-1)、多奈哌齐组(0.75 mg·kg-1)和银杏叶提取物组(24 mg·kg-1),不同药物给药4周后检测大鼠学习记忆能力、局部脑血流量变化、海马CA1区病理改变、皮质HIF-1α水平及血清CAT,SOD和MDA水平。结果显示,侧脑室注射Aβ1-42联合2-VO导致大鼠学习记忆障碍,局部脑血流量降低,CA1区神经元排列紊乱、出现大量空泡、淀粉样沉淀增多,皮质HIF-1α阳性细胞数显著增加,血清CAT和SOD显著下降,MDA显著上升。给予20,30 mg·kg-1β-细辛醚后,上述症状均得到顯著改善。结果表明,β-细辛醚能够缓解Aβ1-42联合2-VO建立AD大鼠模型的症状,其作用机制可能是β-细辛醚通过提高机体抗氧化能力,降低体内的活性氧类物质,从而降低HIF-1α水平,减轻了过氧化物及HIF-1α对神经细胞的损伤,最终达到缓解AD的目的。
[关键词] β-细辛醚; 阿尔茨海默; Aβ1-42; 双侧颈总动脉结扎术; 抗氧化酶; HIF-1α
[Abstract] This study was aimed to investigate the protective effect and mechanism of β-asarone on the animal model of Alzheimer′s disease(AD) which was induced by intracerebroventricular injection of Aβ1-42 combined cerebral ischemia. One hundred and five rats were randomly divided into seven groups including sham-operated group, AD model group, β-asarone 10 mg·kg-1 group, β-asarone 20 mg·kg-1group, β-asarone 30 mg·kg-1group, donepezil group(0.75 mg·kg-1) and Ginkgo biloba extract group(24 mg·kg-1). Rats′ learning and memory abilities, cerebric regional blood flow, pathological changes in hippocampal CA1 region, the expression level of HIF-1α and serum CAT, SOD and MDA level were detected 4 weeks later. The results showed that the application of intracerebroventricular injection of Aβ1-42 joint 2-VO could lead to rats′ dysfunction of learning and memory, decrease in regional cerebral blood flow. Neurons in CA1 region were arranged in disorder, and amyloid deposition was increased. The number of cerebral cortical cells expressing HIF-1α was increased as well. The level of serum CAT and SOD decreased, while level of serum MDA increased. However these symptoms were improved by 20 mg·kg-1 and 30 mg·kg-1β-asarone. The results indicated that β-asarone could effectively relieve the symptoms of the AD model induced by intracerebroventricular injection of Aβ1-42 combined cerebral ischemia, and the potential mechanism might be that it could attenuate damage of MDA to the body by improving the level of CAT and SOD, meanwhile the level of HIF-1α decreased as the decline of hyperoxide which might attenuate its damage to neuron, so it finally achieved alleviating Alzheimer′s disease.
[Key words] β-asarone; Alzheimer′s disease; Aβ1-42; 2-VO; antioxidant enzymes; HIF-1α
阿尔茨海默病(Alzheimer′s disease, AD)为一种神经退行性疾病,临床表现为记忆力减退、认知障碍等,严重影响患者的生活。目前其发病机制仍未明确,存在多种假说:氧化应激假说、β淀粉样蛋白级联假说、Tau蛋白异常磷酸化假说和胆碱能系统损伤假说等[1],其中以β淀粉样蛋白级联假说占主导地位[2]。基于该假说的脑内注射Aβ1-42模型也已作为较常用的AD模型制备方法。同时,越来越多的研究表明脑缺血与AD密切相关[3],能导致AD的发生发展[4-7]。因此本研究采用侧脑室注射Aβ1-42联合双侧颈总动脉结扎(2-VO)建立AD大鼠模型,较目前常用的模型能更全面地模拟AD特征。endprint
目前被FDA认可用于改善AD症状的药物仅有5种,包括多奈哌齐、加兰他敏等,然而这些药物对胃肠道刺激大,易导致心动过缓和心肌梗死[8]。中药由于其具有多靶点整体调节、毒副作用小等特点受到研究者的重视,其中石菖蒲具有醒神益智、开窍豁痰等功效[9],在防治AD方面一直备受关注,其主要有效成分为β-细辛醚。β-细辛醚在中枢神经系统方面表现出良好的抗老年痴呆作用[10],本实验室在前期发现β-细辛醚能有效缓解大鼠大脑中动脉闭塞引起的局部脑缺血[11],对Aβ1-42诱导星形胶质细胞活化所致的PC12 细胞损伤也具有保护作用[12],但它对侧脑室注射Aβ1-42联合2-VO致AD大鼠这一模型的作用未见报道,因此本研究主要探讨β-细辛醚对Aβ1-42联合2-VO建立AD模型的作用,并从抗氧化的角度初步探讨其作用机制。
1 材料
1.1 动物
SPF级健康成年雄性SD大鼠,体质量(280±20) g,购自上海西普尔-必凯实验动物有限公司,许可证号SCXK(沪)2013-0016,浙江中医药大学动物实验中心,许可证号SYXK(浙) 2013-0184。温度(22±2) ℃,湿度50%~60%,12 h光照,自由饮水,标准普通饲料喂食。
1.2 仪器
Morris水迷宫(西班牙Panlab公司,型号Smsrt-Mass 0800916s);脑立体定位仪(上海奥尔科特生物技术有限公司,型号Alc-H);激光多普勒脑血流仪[埃德仪器国际贸易(上海)有限公司,型号ML191Laser Doppler Blood Flowmeter];微量注射器(上海高鸽工贸有限公司,规格10 μL);牙科钻(深圳瑞沃德生命科技有限公司,型号strong 90);酶标仪(美国BIO-TEK仪器有限公司,型号Power Wave X340 BIO-TEK);显微镜(Nikon公司,型号Nikon eclipse 80i);封闭式组织自动脱水机(德国Leica公司,型号ASP200S);包埋机(德国Leica公司,型号AP280-2);切片机(德国Leica公司,型号leica RM2245);台式高速冷冻离心机(Thermo公司,型号FRESC017)。
1.3 试剂
Aβ1-42(寡聚体)(吉尔生化有限公司);β-细辛醚(金坛市威德龙化学有限公司,批号131203,纯度98%);安理申[卫材(中国)药业有限公司,批号130821A,每片含盐酸多奈哌齐5 mg];银杏叶提取物(贵州信邦制药股份有限公司);SOD检测ELISA试剂盒(上海信帆生物科技有限公司,批号201603);CAT检测ELISA试剂盒(上海信帆生物科技有限公司,批号201603);HIF-1α抗体(Affinity Biologicals Inc.,AF1009);二抗HRP polymer conjugate(Invitrogen,1289835A);丙二醛(MDA)检测试剂盒(南京建成生物工程研究所,批号201708)。
2 方法
2.1 大鼠模型的制备
2.1.1 动物分组 SD大鼠经Morris水迷宫初筛后,按随机数字分成7组,分别为假手术组、AD模型对照组、β-细辛醚低、中、高剂量组(10,20,30 mg·kg-1)、多奈哌齐组(0.75 mg·kg-1)、银杏叶提取物组(24 mg·kg-1),每组15只。
2.1.2 AD模型大鼠的制备及给药 术前将大鼠适应环境1周,术前12 h禁食,4 h禁水。3%戊巴比妥钠腹腔注射麻醉大鼠,沿颈正中切口,分离出双侧颈总动脉,分别用3-0型蚕丝线双重结扎双侧颈总动脉的远心端和近心端,缝合皮肤。假手术组仅分离暴露双侧颈总动脉而不结扎。在2-VO手术24 h后,进行神经功能学评价。
手术大鼠饲养恢复1周后,进行侧脑室注射Aβ1-42,SD大鼠腹腔注射3%戊巴比妥钠麻醉后,固定于脑立体定位仪上,行正中切口暴露前囟,参照包新民[13]《大鼠脑立体定位图谱》,以前囟为基点,后移0.8 mm,中线旁开1.2 mm为侧脑室注射位点,以牙科钻钻开颅骨,用10 μL微量注射器自脑表面垂直向下进针4 mm,左右两侧分别缓慢注入Aβ1-42 3.5 μL(3.5 μg),5 min内均匀缓慢注入,留针5 min使Aβ1-42充分浸润,假手术组注射等量生理盐水,用少量骨蜡将骨窗封住,青霉素局部喷洒消毒后缝合皮肤,常规饲养,各组动物均在相同环境中自由摄食和饮水,造模7 d后经Morris水迷宫筛选及模型验证,分组给药。
β-细辛醚低、中、高剂量组分别按10,20,30 mg·kg-1剂量灌胃给药,多奈哌齐组按0.75 mg·kg-1剂量灌胃给药,银杏叶提取物组按24 mg·kg-1给药,正常对照组、AD模型对照组给予等剂量的生理盐水,1次/d,连续4周。
2.1.3 大鼠神经功能学评价 在2-VO手术24 h后,对大鼠进行神经功能学评分,参照评分标准[14]:功能正常时得分最高为18分,1~6分为重度损伤,7~12分为中度损伤,13~18分为轻度损伤。剔除重度损伤和中度损伤大鼠,选择13~18分的轻度损伤大鼠继续实验。
2.2 Morris水迷宫检测大鼠学习记忆能力
SD大鼠分别在造模1周后和给药4周后进行Morris水迷宫实验,包括定位航行试验和空间探索试验2部分,方法参照文献[15]。
定位航行试验:测量大鼠获取经验(学习)的能力。实验前1 d下午将大鼠放入水中适应2 min,使其熟悉实验环境。正式实验历时2.5 d,每天分上、下午2个时段各训练1次,将大鼠朝向池壁放入,同一次训练所有大鼠入水点相同。设定潜伏期上限为120 s,记录各组大鼠找到平台的时间,即逃避潜伏期(escape latency)。如果大鼠在120 s內未找到平台,需将其引至平台并停留10 s以强化记忆,这时逃避潜伏期记为120 s。endprint
空间探索试验:第3天下午撤除平台,将大鼠在第6入水点面向池壁放入水池,记录大鼠120 s内穿越原平台所在位置的次数,作为空间探索能力的指标。
2.3 激光多普勒脑血流仪检测大鼠局部脑血流量
分别于2-VO手术24 h后、给药4周后检测脑局部血流量。3%戊巴比妥钠腹腔注射进行麻醉后,将大鼠固定至脑立体定位仪上,将激光多普勒脑血流仪的探头固定在颅窗的软脑膜上,以780 nm激发光照射监测大鼠顶叶局部5 min的脑血流量。
2.4 HE染色与刚果红染色检测脑组织病理变化
给药4周后,每组随机选取3只SD大鼠,10%水合氯醛腹腔麻醉,4%多聚甲醛心脏灌注,取出脑组织,固定于4%多聚甲醛溶液中24 h,依次脱水、透明、浸蜡及包埋切片。
将石蜡切片脱蜡至水,苏木素染色,盐酸乙醇分化,水洗蓝化,置伊红液复染后,常规脱水,透明,封片。在光镜下观察海马CA1区神经元形态的变化。
石蜡切片常规脱蜡至水,甲醇刚果红染色,碱性酒精分化液分化,水洗后Mayer苏木素染核,脱水透明后中性树胶封固。在光镜下观察海马CA1区淀粉样变化。
2.5 免疫组化检测AD大鼠皮质HIF-1α
切片置于60 ℃烤箱烘烤2 h,脱蜡至水,蒸馏水洗2 min,经高压热修复后;用3%H2O2溶液阻断过氧化物酶,经PBS洗涤,滴加HIF-1α一抗(稀释倍数1∶200),4 ℃孵育过夜,PBS洗涤3次后滴加二抗,37 ℃孵育60 min,PBS洗涤3次,DAB显色1~2 min复染、透明后封片,避光自然干燥。
在光镜(目镜×10,物镜×20)下,观察大鼠皮质神经细胞,以胞质或胞核内出现棕黄色颗粒的细胞为阳性细胞,随机选6个不同的视野进行拍照,计数每个视野中1 mm×1 mm面积中阳性细胞数,取其平均值。
2.6 酶联免疫吸附法测定大鼠血清中CAT,SOD及MDA水平
给药4周后进行大鼠眼眶取血,3 000 r·min-1离心15 min后取血清于离心管中,20 ℃冰箱保存,备用。按照ELISA试剂盒操作检测SOD,CAT和MDA。
2.7 统计学方法
采用SPSS 17.0统计软件进行数据分析,结果以±s表示。Morris水迷宫实验中逃避潜伏期数据采用重复测量方差分析进行统计,其他数据均采用单因素方差分析(One-way ANOVA) 进行统计。经方差齐性检验,若方差齐性,组间多重比较采用最小差值法(LSD);若方差不齐,将采用 Dunnett T3 法进行多重比较。P<0.05为具有显著性差异,P<0.01为具有极显著性差异。
3 结果
3.1 β-细辛醚对AD大鼠学习记忆能力的影响
在完成侧脑室注射Aβ1-42联合2-VO造模1周后,AD模型组的逃避潜伏期较假手术组显著延长(P<0.05);给药4周后,β-细辛醚低、中、高剂量组、盐酸多奈哌齐组和银杏叶提取物组与模型组相比,逃避潜伏期显著缩短(P<0.05),见表1。
空间探索实验结果显示,造模1周后,AD模型组的穿越平台次数显著少于假手术组(P<0.01),而给药4周后,β-细辛醚低、中、高剂量组、盐酸多奈哌齐组和银杏叶提取物组的穿越平台次数显著高于AD模型组(P<0.05),见表1。
3.2 β-细辛醚对AD大鼠局部脑血流量的影响
进行2-VO手术24 h后,AD模型组大鼠的局部脑血流量较假手术组显著降低(P<0.01),给药4周后,β-细辛醚中、高剂量组、盐酸多奈哌齐组和银杏叶提取物组的大鼠局部脑血流量均显著提高(P<0.05,P<0.01),见图1。
3.3 β-细辛醚对AD大鼠脑组织病理学改变的影响
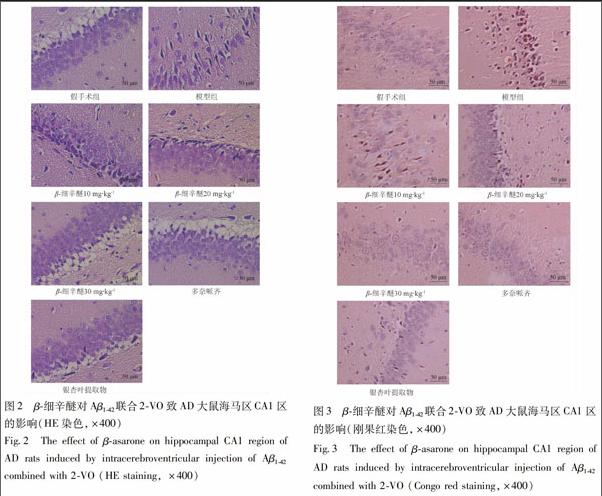
HE染色图显示,假手术组的神经元排列规则、紧密、轮廓清晰结构完整;AD模型组的神经元则排列紊乱、密度减小,有明显的神经元缺失、残留空泡;经β-细辛醚中、高剂量、盐酸多奈哌齐和银杏叶提取物给药4周后,可见给药组较AD模型组病理状态减轻,神经元增多、排列整齐、胞浆清楚,见图2。
大鼠神经元CA1区神经元经刚果红染色后,淀粉样物质呈红色,细胞核呈蓝色,假手术组大鼠未发现明显病理变化,而模型组的CA1区出现红色淀粉样物质沉淀,排列紊乱,神经元细胞变性。β-细辛醚 中、高剂量、盐酸多奈哌齐和银杏叶提取物给药4周后,上述病理状态均有所改善,见图3。
3.4 β-细辛醚对AD大鼠血清CAT,SOD,MDA的影响
侧脑室注射Aβ1-42联合2-VO后的大鼠,其血清 CAT和SOD水平较假手术组显著下降(P<0.01),给予不同剂量的β-细辛醚、盐酸多奈哌齐和银杏叶提取物后,血清CAT水平均显著上升(P<0.05,P<0.01);同时30 mg·kg-1的β-细辛醚组、盐酸多奈哌齐组和银杏叶提取物组也能显著提高血清SOD水平(P<0.05,P<0.01),见图4。
大鼠经侧脑室注射Aβ1-42联合2-VO后,血清MDA水平较假手术组显著上升(P<0.01),给予中、高剂量β-细辛醚、盐酸多奈哌齐和银杏叶提取物后,血清MDA水平较模型组显著下降(P<0.05),见图5。
3.5 β-细辛醚对AD大鼠皮质HIF-1α的影响
假手术组的大鼠皮质仅少数细胞表达HIF-1α,AD模型组的HIF-1α阳性细胞数显著增加(P<0.01),给予不同剂量的β-细辛醚、盐酸多奈哌齐和银杏叶提取物后,HIF-1α阳性细胞数较AD模型组 显著减少(P<0.01),见图6,7。
4 讨论
目前用于研究AD的动物模型主要有脑内注射Aβ模型、自由基氧化损伤模型、转基因动物模型等[16],但这些模型作用因素单一仅部分模拟了AD的病理特征[17],并没有全面地体现人类AD行为学特征和病理学改变。同时,大量研究表明,无论在动物模型还是AD病人中均显示脑缺血可能是AD的病因和初始触发因素[18-21]。于是本研究结合β淀粉样蛋白级联假说和脑缺血,采用侧脑室注射Aβ1-42联合2-VO建立AD模型。课题组前期研究显示,侧脑室注射Aβ1-42联合2-VO手术4周后能显著降低大鼠空间学习记忆能力,使海馬区Aβ沉积、Tau蛋白磷酸化水平显著增加,海马皮层神经元丢失明显,较全面地体现出AD特征,从而为本文提供了基础。endprint
β-细辛醚为石菖蒲的主要有效成分,具有广泛的药理作用,尤其在改善学习记忆功能及治疗AD方面的报道日渐增多。其能促进慢性铅中毒大鼠的空间记忆障碍恢复和突触形成[22],缓解大鼠星形胶质细胞的氧化应激损伤[23],抑制AD模型大鼠海马神经元凋亡[24-25],此外,本课题组在前期研究中也发现β-细辛醚能有效缓解大鼠大脑中动脉闭塞引起的局部脑缺血[11],对Aβ1-42诱导星形胶质细胞活化所致的PC12 细胞损伤也具有保护作用[12],提示β-细辛醚在防治AD方面具有巨大的潜力。
在本研究中,侧脑室注射Aβ1-42联合2-VO手术后表现出显著的学习记忆能力下降、局部脑血流量降低现象。β-细辛醚给药4周后,大鼠的逃避潜伏期缩短,穿越平台次数增多;局部脑血流量增多,脑缺血症状得到缓解;病理状态较AD模型组减轻,神经元增多、排列整齐、胞浆清楚,说明β-细辛醚能有效缓解该AD模型的症状,改善Aβ沉积和脑低灌注,这与文献[26]的研究结果一致。
同时,β-细辛醚给药4周后AD大鼠血清的CAT和SOD水平显著升高,血清MDA水平显著降低。MDA为脂质过氧化反应的代谢终产物之一,为脂质过氧化的标记物,其在体内的过量累积将引起细胞损伤,损害神经元的正常功能,引起认知障碍[27],而SOD和CAT作为机体主要的抗氧化酶,能够去除有害过氧化物,从而防止神经细胞损伤[28],多项研究显示,机体抗氧化能力的提高能够使体内MDA水平下降,从而缓解AD进程[29-30],说明β-细辛醚能够通过提高抗氧化酶水平,减轻体内过氧化物对机体的损伤来缓解AD。
缺氧诱导因子-1(hypoxia inducible transcription factor-1, HIF-1)为参与调节氧稳态失衡的核心调节因子,由α和β亚基组成异源二聚体结构,其中α亚基对氧敏感,并受其调控。在缺氧状态下,机体产生大量活性氧[31-32],而活性氧能够通过多种方式促进体内HIF-1α累積。Lamberti等发现低氧状态下产生的活性氧能够通过“ROS-ERK1/2-HIF-1α轴”促进HIF-1α的表达[33],同时活性氧还能够抑制介导HIF-1α降解的脯氨酰羟化酶的活性,降低HIF-1α亚基羟基化,从而加强HIF-1α稳定性,使其在体内含量增加[34-35],大量研究表明,脑缺血后HIF-1α含量增加,其能通过促进细胞的凋亡和坏死,参与缺氧诱导的细胞死亡[35-37]。值得注意的是,高水平的SOD能够有效抑制HIF-1α在体内的累积[38-39],这与本研究结果一致,提示β-细辛醚可能是通过提高机体抗氧化能力,降低体内的活性氧类物质,从而降低HIF-1α水平,减轻HIF-1α对机体的损害,最终达到缓解AD的目的。
综上所述,β-细辛醚有效缓解了Aβ1-42联合2-VO建立的AD大鼠模型的病理症状,其作用机制可能是β-细辛醚通过提高机体抗氧化能力,降低体内的活性氧类物质,从而降低HIF-1α水平,减轻了过氧化物及HIF-1α对神经细胞的损伤,最终达到缓解AD的目的。
[参考文献]
[1] Sanabria C A, Alvarado E I, Monge B C. Molecular pathogenesis of Alzheimer′s disease: an update[J]. J Neurochem, 2017, 24(1):46.
[2] Hardy J, Selkoe D J. The amyloid hypothesis of Alzheimer′s disease: progress and problems on the road to the rapeutics[J]. Science, 2002, 297(5580): 353.
[3] Kisler K, Nelson A R, Montagne A, et al. Cerebral blood flow regulation and neurovascular dysfunction in Alzheimer disease[J]. Nat Rev Neurosci, 2017, 18(7):419.
[4] Osawa A, Maeshima S, Shimamoto Y, et al. Relationship between cognitive function and regional cerebral blood flow in different types of dementia[J]. Disabil Rehabil, 2004, 26(12):739.
[5] García P L R, García D R. Letter by Rodriguez and Rodriguez regarding article, "vascular contributions to cognitive impairment and dementia: a statement for healthcare professionals from the American Heart Association/American Stroke Association"[J]. Stroke, 2011, 42(11):e584.
[6] Haruo Hanyu, Tomohiko Sato, Kentaro Hirao, et al. The progression of cognitive deterioration and regional cerebral blood flow patterns in Alzheimer′s disease: a longitudinal SPECT study[J]. Neurol Sci, 2010, 290(1):96.endprint
[7] Liu H, Xing A F, Wang X J, et al. Regulation of β-amyloid level in the brain of rats with cerebrovascular hypoperfusion[J]. Neurobiol Aging, 2012, 33(4):826.
[8] Apostolova L G. Alzheimer disease[J]. Continuum, 2016, 22(2):419.
[9] 中國药典. 一部[S].2015:91.
[10] 杨雪鸥, 唐智勇, 黄雪梅, 等. 石菖蒲β-细辛醚研究进展[J]. 中药材, 2016, 39(3):686.
[11] Yang Y X, Chen Y T, Zhou X J, et al. Beta-asarone, a major component of Acorus tatarinowii Schott, attenuates focal cerebral ischemia induced by middle cerebral artery occlusion in rats[J]. Bmc Complement Altern Med, 2013, 13(1):236.
[12] 何潆, 何嘉娜, 付俊, 等. β-细辛醚对Aβ1-42诱导星形胶质细胞活化所致PC12细胞损伤的保护作用研究[J]. 中国中药杂志, 2016, 41(7):1282.
[13] 包新民. 大鼠脑立体定位图谱[M]. 北京:人民卫生出版社, 1991.
[14] Garcia J H, Wagner S, Liu K F, et al. Neurological deficit and extent of neuronal necrosis attributable to middle cerebral artery occlusion in rats statistical validation[J]. Stroke, 1995, 26(4): 627.
[15] Vorhees C V, Williams M T. Morris water maze: procedures for assessing spatial and related forms of learning and memory[J]. Nat Protoc, 2006, 1(2):848.
[16] Neha, Sodhi R K, Jaggi A S, et al. Animal models of dementia and cognitive dysfunction[J]. Life Sci, 2014, 109(2):73.
[17] Chin J. Selecting a mouse model of Alzheimer′s disease[J]. Methods Mol Biol, 2011, 670:169.
[18] Wollenweber F A, Drr S, Müller C, et al. Prevalence of amyloid positron emission tomographic positivity in poststroke mild cognitive impairment[J]. Stroke,2016,47(10):2645.
[19] Iturria M Y, Sotero R C, Toussaint P J, et al. Alzheimer′s disease neuroimaging initiative. Early role of vascular dysregulation on late-onset Alzheimer′s disease based on multifactorial data-driven analysis[J]. Nat Commun,2016, 7:11934.
[20] Cohan C H, Neumann J T, Dave K R, et al. Effect of cardiac arrest on cognitive impairment and hippocampal plasticity in middle-aged rats[J]. PLoS ONE,2015, 10(5): e0124918.
[21] Qiu L, Ng G, Tan E K, et al. Chronic cerebral hypoperfusion enhances Tau hyperphosphorylation and reduces autophagy in Alzheimer′s disease mice[J]. Sci Rep,2016, 6:23964.
[22] Yang Q Q, Xue W Z, Zou R X, et al. β-Asarone rescues Pb-induced impairments of spatial memory and synaptogenesis in rats[J]. PLoS ONE, 2016, 11(12):e0167401.
[23] Kyc L, Yao P, Wang H, et al. Asarone from Acori Tatarinowii Rhizome prevents oxidative stress-induced cell injury in cultured astrocytes: a signaling triggered by Akt activation[J]. PLoS ONE, 2017, 12(6):e0179077.endprint
[24] Geng Y, Li C, Liu J, et al. Beta-asarone improves cognitive function by suppressing neuronal apoptosis in the beta-amyloid hippocampus injection rats[J]. Biol Pharm Bull, 2010, 33(5):836.
[25] Liu J, Li C, Xing G, et al. Beta-asarone attenuates neuronal apoptosis induced by Beta amyloid in rat hippocampus[J]. Yakugaku Zasshi, 2010, 130(5):737.
[26] Li Z, Zhao G, Qian S, et al. Cerebrovascular protection of β-asarone in Alzheimer′s disease rats: a behavioral, cerebral blood flow, biochemical and genic study[J]. J Ethnopharmacol, 2012, 144(2):305.
[27] Islam M T. Oxidative stress and mitochondrial dysfunction-linked neurodegenerative disorders[J]. Neuro Res, 2017, 39(1):73.
[28] Yan M H, Wang X, Zhu X. Mitochondrial defects and oxidative stress in Alzheimer disease and Parkinson disease[J]. Free Radical Bio Med, 2013, 62(9):90.
[29] Ghanbarabadi M, Iranshahi M, Amoueian S, et al. Neuroprotective and memory enhancing effects of auraptene in a rat model of vascular dementia: experimental study and histopathological evaluation[J]. Neurosci Lett, 2016, 623:13.
[30] Turgut N H, Kara H, Arslanbas E, et al. Effect of Capparis spinosa L. on cognitive impairment induced by D-galactose in mice via inhibition of oxidative stress[J]. Turk J Med Sci, 2015, 45(5):1127.
[31] Olson N, Vliet A V. Interactions between nitric oxide and hypoxia-inducible factor signaling pathways in inflammatory disease[J]. Nitric Oxide, 2011, 25(2):125.
[32] Takeda N, O′Dea E L, Doedens A, et al. Differential activation and antagonistic function of HIF isoforms in macrophages are essential for NO homeostasis[J]. Gene Dev, 2010, 24(5):491.
[33] Lamberti M J, Pansa M F, Vera R E, et al. Transcriptional activation of HIF-1 by a ROS-ERK axis underlies the resistance to photodynamic therapy[J]. PLoS ONE, 2017, 12(5): e0177801.
[34] Galanis A, Pappa A, Giannakakis A, et al. Reactive oxygen species and HIF-1 signalling in cancer[J]. Cancer Lett, 2008, 266(1):12.
[35] Chen X, Liu X, Li B, et al. Cold inducible RNA binding protein is involved in chronic hypoxia induced neuron apoptosis by down-regulating HIF-1α expression and regulated by microRNA-23a[J]. Int J Biol Sci, 2017, 13(4):518.
[36] Yin R, Yuan L, Ping L, et al. Neonatal bronchopulmonary dysplasia increases neuronal apoptosis in the hippocampus through the HIF-1α and p53 pathways[J]. Respir Physiol Neurobiol, 2016, 220:81.
[37] Xu W, Xu R, Li X, et al. Downregulating hypoxia-inducible factor-1α expression with perfluorooctyl-bromide nanoparticles reduces early brain injury following experimental subarachnoid hemorrhage in rats[J]. Am J Transl Res, 2016, 8(5):2114.
[38] Kwiatkowska J, Wasowska B, Gilun P. Expression of hypoxia inducible factor 1α and antioxidant enzymes: superoxide dismutases-1 and -2 in ischemic porcine endometrium[J]. Reprod Biol, 2017, 17(3):289.
[39] Wang M, Kirk J S, Domann F E, et al. Manganese superoxide dismutase suppresses hypoxic induction of hypoxia-inducible factor-1alpha and vascular endothelial growth factor[J]. Oncogene, 2005, 24(55):8154.
[責任编辑 张宁宁]endprint
