黄芪甲苷治疗糖尿病及其并发症药理作用研究进展
2018-01-29尤良震林逸轩方朝晖申国明赵进东汪婷婷
尤良震+林逸轩+方朝晖+申国明+赵进东+汪婷婷

[摘要] 糖尿病已经成为严重威胁人类健康的全球性公共卫生问题。中医药以其 “多靶点”的作用特点在糖尿病及其并发症的防治上独具优势。黄芪甲苷是中药黄芪的主要活性成之一,具有改善内皮细胞与新生血管功能、抗炎、抗氧化、调节能量代谢、神经保护、抗癌等作用。该文对黄芪甲苷防治糖尿病及其并发症进行综述,显示出黄芪甲苷具有降血糖、降血脂、改善胰岛素抵抗、抑制炎症反应与氧化应激等作用,能够改善糖尿病动物与细胞模型中糖尿病血管病变、糖尿病肾病、糖尿病视网膜病变、糖尿病周围神经病变、糖尿病心肌病等病理性损伤。黄芪甲苷可能是一种潜在治疗糖尿病及其并发症的中药活性物质。
[关键词] 黄芪甲苷; 糖尿病; 药理作用; 新药
[Abstract] Diabetes has become a global public health problem that seriously threatens human health. Traditional Chinese medicine, the characteristics of the role of multiple targets, has a unique advantage in the prevention and treatment of diabetes mellitus and its complications. Astragaloside-Ⅳ (AS-Ⅳ), one of the main activities of Astragalus membranaceus, has a series of pharmacological effects including improvement in the function of endothelial cells and neovascularization, anti-inflammatory, antioxidant, regulating energy metabolism, protectionnervous, anti-cancer and so on. In this paper, AS-Ⅳ to prevent and treat diabetes and its complications has been reviewed, which has effect on lowering blood sugar, lowering blood pressure, improving insulin resistance, inhibiting inflammatory reaction and oxidative stress. Additionally, it also can improve the diabetic animal and cell model of diabetic vascular disease, diabetic nephropathy, diabetic retinopathy, diabetic peripheral neuropathy, diabetic cardiomyopathy and other pathological damages. AS-Ⅳ may be a potential active substance for the treatment of diabetes and its complications.
[Key words] astragaloside-Ⅳ; diabetes; pharmacological effects; new drugs
药用黄芪为豆科植物蒙古黄芪或膜荚黄芪的干燥根,味甘,性微温,具补气固表、利尿托毒、排脓、敛疮生肌之功[1]。现代药理研究与临床报道显示,黄芪在调节免疫、提高记忆力、抗菌抗病毒、抗肿瘤、延缓衰老、糖尿病、心血管疾病等方面具有重要作用[2-3]。黄芪甲苷(astragaloside-Ⅳ,AS-Ⅳ)是药用黄芪中提取的主要活性成分之一,为评判黄芪质量优劣的标志物,具有改善内皮细胞与新生血管功能、抗炎、抗氧化、调节能量代谢、神经保护、抗癌等作用,在治疗心脑血管疾病、肾病、呼吸系统疾病、糖尿病及相关并发症等疾病具有重要的药物价值[4-5]。
糖尿病(diabetes mellitus,DM)在中医学中属“消渴”症的范畴。糖尿病患者长期碳水化合物以及脂肪、蛋白质代谢紊乱导致糖尿病微血管并发症和大血管并发症的发生。近年来,全球范围内的糖尿病患病率、发病率急剧上升,日益成为严重威胁人类健康的世界性公共卫生问题。在我国,糖尿病已成为继心脑血管疾病和肿瘤之后第三大慢性非传染性疾病。近年来,黄芪及有效部位在防治糖尿病方面进行了大量的临床疗效与作用机制研究[6]。黄芪甲苷作为黄芪主要活性成分在防治糖尿病方面的研究正在深入,但文献资料零散,尚未进行系统地报道。本文将黄芪甲苷有关治疗糖尿病及其并发症的药理作用作一综述,冀望有助于其进一步研究探索与开发利用。
1 黄芪甲苷防治糖尿病的药理作用
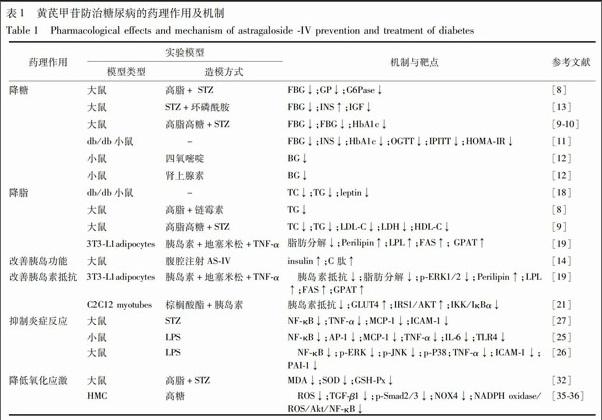
1.1 降糖作用 慢性高血糖是糖尿病的主要特征,一方面随着持续血糖的升高胰岛β细胞分泌胰岛素的能力而逐渐降低形成恶性循环的持续高血糖病症;另一方面葡萄糖毒性是糖尿病慢性并发症的发生发展的主要原因[7]。研究表明黄芪甲苷具有一定的降糖作用。在高脂饮食加腹腔注射链脲佐菌素(STZ)诱导的糖尿病大鼠模型中,黄芪甲苷(25,50 mg·kg-1)可显著降低模型大鼠的血糖,可能与抑制肝葡萄糖原磷酸化酶(GP)和葡萄糖-6-磷酸酶(G-6-Pase)活性有关[8]。在高脂高糖饮食加腹腔注射STZ糖尿病大鼠模型中,韩冬[9]研究表明黄芪甲苷(120 mg·kg-1)在给药7,14,21,28 d降低大鼠血糖,黄芪甲苷(60 mg·kg-1)在给药28 d降低大鼠血糖;Yin等[10]研究显示,黄芪甲苷(50 mg·kg-1)能降低模型大鼠空腹血糖(FBG)和糖基化血红蛋白(HbA1c)。在先天性糖尿病模型db/db小鼠中,黄芪甲苷能降低小鼠FBG,血清胰岛素(INS),糖基化血红蛋白(HbA1c),胰岛素抵抗指数(HOMA-IR)[11]。謝春英[12]研究黄芪甲苷(200,400 mg·kg-1)能降低腹腔注射肾上腺素和四氧嘧啶诱导高血糖模型小鼠的血糖。刘必旺等[13]发现黄芪甲苷能降低腹腔注射STZ与环磷酰胺模型大鼠血糖。另外,黄芪甲苷能促进类胰升血糖素肽1(GLP-1)[14]、胰岛素和胰岛素C肽分泌[15],调节血糖水平。endprint
1.2 降脂作用 体内游离脂肪酸(FFA)浓度或细胞内脂肪含量增多引起或(和)加重胰岛素抵抗与β细胞功能受损[16]。高血糖与高血脂同时发生显著加速糖尿病并发症发生进程[17]。黄芪甲苷能下调后天诱发型糖尿病模型大鼠血清总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白(LDL-C)水平,上调高密度脂蛋白(HDL-C)水平[8-9]。在先天性db/db糖尿病模型小鼠中,黄芪甲苷能降低模型小鼠的TC和TG水平,调节体内瘦素(leptin)敏感性和产热网络系统[18]。Jiang等[19]研究表明黄芪甲苷可抑制TNF-α诱导的3T3-L1脂肪细胞的脂解作用,降低FFA水平,显示黄芪甲苷降脂作用可能与上调细胞脂质代谢关键酶:细胞脂蛋白脂肪酶(LPL)、脂肪酸合成酶(FAS)和磷酸转酰酶(GPAT)有关。
1.3 改善胰岛素抵抗 胰岛素抵抗(IR)是2型糖尿病重要的病因和发病机制。胰岛素抵抗主要发生在胰岛素与胰岛素受体结合前后的异常事件,包括胰岛素与胰岛素受体数量结构功能异常以及二者结合后细胞内外信号传导异常如葡萄糖转运蛋白异常与胰岛素受体底物家族异常。胰岛素抵抗产生有关的细胞因子有:FFA,Leptin,TNF-α,抵抗素(resistin),脂联素(adiponectin),内脏脂肪素(visfatin)等。在TNF-α诱导3T3-L1脂肪细胞建立胰岛素抵抗模型中,黄芪甲苷能增加3T3-L1脂肪细胞中2-脱氧-[3H]-D-葡萄糖(2-DOG)摄取率,增加胰岛素敏感性,改善IR[19]。棕榈酸诱导C2C12成肌细胞是一种常见的胰岛素抵抗细胞造模[20]。黄芪甲苷作用C2C12细胞的胰岛素抵抗模型,能够增加C2C12细胞摄取葡萄糖和葡萄糖转运蛋白4(GLUT4)活性,改善IRS1/AKT通路,减少炎症细胞因子过度表达,抑制IKK/IκBα的过度激活,减轻C2C12细胞胰岛素抵抗[21]。
1.4 抑制炎症反应 炎症反应与2型糖尿病關系密切[22]。有学者提出,2型糖尿病是处于慢性低度炎症状态下的一种天然免疫和炎症性疾病[23]。黄芪甲苷的抗炎作用在动物和细胞模型中已得到证实[24-26]。Gui等[27]研究发现黄芪甲苷能降低糖尿病大鼠血清与肾组织中MCP-1,ICAM-1,TNF-α表达,改善糖尿病肾病。db/db糖尿病小鼠中,黄芪甲苷能降低小鼠视网膜炎性细胞因子IL-1,IL-6,VCAM-1,TNF-β,MMPs的表达,改善视网膜神经节细胞(RGC)功能紊乱[28],降低肾小管上皮细胞中MCP-1和TNF-α蛋白表达,改善小鼠肾损伤[11]。在糖尿病胰岛素抵抗细胞模型中,黄芪甲苷可改善TNF-α所诱导的3T3-L1模型细胞胰岛素抵抗[19],降低棕榈酸诱导C2C12模型细胞MCP-1,IL-6,TNF-α表达,促进细胞葡萄糖转运[21]。
在高糖、高脂饮食+STZ腹腔注射诱导的2型糖尿病模型大鼠中,黄芪甲苷能降低模型大鼠超敏C反应蛋白(hs-CRP)含量,改善糖脂代谢[29]。
1.5 降低氧化应激 氧化应激是指机体受到不良刺激而产生超出其防御系统的清除的能力的活性氧(ROS)和活性氮(RNS),导致ROS 和RNS堆积引发组织损伤[30]。机体内反应氧化应激水平的生物标记物主要分为ROS类、RNS类和脂质过氧化物三类,包括O-·2,H2O2,-HO,NO,NO-,亚硝基硫醇(RSNO)和过氧亚硝酸阴离子(OONO-),丙二醛(MDA)等[31]。氧化应激主要通过损伤胰岛β细胞与诱导胰岛素抵抗诱发糖尿病。黄芪甲苷降低糖尿病大鼠肾组织中MDA水平,升高SOD、谷胱甘肽过氧化物酶(GSH-Px)活性,改善肾内氧自由基的氧化损伤[32]。黄芪甲苷能抑制H2O2诱导的人脐静脉内皮细胞NADPH氧化酶4(Nox4)的过度表达,改善细胞氧化应激,减少细胞凋亡[33]。在高糖或H2O2诱导人肾小球系膜细胞(HMC)氧化应激细胞模型中,黄芪甲苷能减少细胞内ROS生成,下调TGF-β1,p-Smad2/3,NOX4蛋白的表达,保护HMC损伤[34-36]。
常见黄芪甲苷防治糖尿病的药理作用及机制见表1。
2 黄芪甲苷与糖尿病并发症
2.1 糖尿病血管病变 血管内皮细胞和平滑肌细胞结构与功能障碍是糖尿病血管并发症发生的主要原因。黄芪甲苷对糖尿病血管内皮细胞功能障碍和平滑肌损伤有显著的保护作用。黄芪甲苷保护糖尿病血管内皮细胞障碍的主要机制为:①通过抑制蛋白激酶(PKC)活性、调节纤维状肌动蛋白(F-actin)重新分布、改善细胞骨架重构,保护高糖诱导内皮细胞屏障受损[37];②通过抑制糖尿病大鼠NF-κB活性与血管细胞黏附分子与炎症细胞因子表达,改善内皮细胞炎症[24];③通过减少糖尿病大鼠内皮细胞氧化低密度脂蛋白(Ox-LDL)水平,增加一氧化氮与内皮型一氧化氮合酶(eNOS)含量,改善内皮细胞功能[10]。血管平滑肌细胞的异常增殖迁移和表型改变是糖尿病血管病变的基础[38]。Yuan等[39]研究显示:黄芪甲苷降低高糖诱导血管平滑肌细胞增殖和增殖指数的异常升高,可能与黄芪甲苷干预细胞周期、促进细胞凋亡、增加平滑肌肌动蛋白表达有关。
2.2 糖尿病肾病 糖尿病肾病(DN)临床上早期主要为肾小球高滤过状态和尿白蛋白排泄率的增加。随后病情进展,肾小球破坏数量增多,尿蛋白排泄的增多和肾小球及间质纤维化发生。肾小球早期病理改变是肾小球肥大、基底膜增厚、系膜基质增多和细胞外基质蛋白增多[40]。黄芪甲苷对糖尿病肾病的保护作用如下。
第一,保护肾脏足细胞损伤。足细胞是肾小球滤过膜的重要构成部分,是肾病早期重要的病理改变。足细胞病变与糖尿病患者初始蛋白尿产生密切相关[41]。高糖是诱导足细胞凋亡[42],数目减少[43]的重要原因,氧化应激是损伤作用并进一步发展为糖尿病肾病的重要机制[44]。黄芪甲苷能减轻DN模型大鼠肾脏病理损伤及白蛋白尿,改善足细胞损伤,调节细胞凋亡的关键分子表达减少凋亡,减弱心肌肌浆网Ca2+-ATP酶(SERCA)依耐性的内质网应激和AMPKα介导的细胞自噬[12,45-46];黄芪甲苷作用于高糖诱导的足细胞损伤,下调Bax、上调Bcl-2蛋白表达,抑制细胞凋亡,可能机制与降低足细胞活性氧成分MDA、升高抗氧化酶过氧化氢酶(CAT)及SOD水平,降低氧化应激,下调瞬间受体阳离子通道6(TRPC6)、调节钙调磷酸酶(calcineurin)/活化T细胞核因子(NFAT)通路有关[45,47]。endprint
第二,保护肾小管损伤。肾小管间质的损伤程度是DN肾损伤的重要病理指标。黄芪甲苷抑制高糖损伤的肾小管上皮细胞中p38/MAPK信号通路与转化生长因子-β1(TGF-β1)活性,提高肾小肝细胞生长因子(HGF)浓度,减少细胞凋亡,保护肾小管上皮细胞[48]。db/db小鼠肾小管损伤,黄芪甲苷减少尿N-乙酰-β-氨基葡萄糖苷酶(NAG)、中性粒细胞明胶酶相关脂质运载蛋白(NGAL),TGF-β1表达,抑制Akt/mTOR,NF-κB及Erk1/2信号通路高表达[49]。
第三,抑制肾间质纤维化。肾小管上皮细胞间充质转分化(EMT)是DN小管损伤的典型的病理改变,肾小管病变与肾间质纤维化发生的重要环节。在糖化白蛋白诱导的肾小管上皮细胞(NRK52E)损伤模型中,黄芪甲苷能抑制细胞ROS产生与α-平滑肌肌动蛋白(α-SMA)表达,增加E-钙黏蛋白(E-cadherin)表达,抑制EMT事件的发生[50]。
第四,改善线粒体调控网络。肾脏高耗能需氧器官,线粒体复杂的网络调控作用维持肾脏的结构与功能。db/db小鼠肾功能损伤线粒体调控网络失衡。黄芪甲苷能减少db/db小鼠尿蛋白排泄(UAE),降低NAG活性保护肾脏损害,其作用机制可能为降低肾脏线粒体发动相关蛋白1(Drp-1)、分裂蛋白1(Fis-1)、裂变因子(MFF)表达,下调PINK1/Parkin介导的线粒体自噬重建线粒体调控网络[51]。
2.3 糖尿病视网膜病变 糖尿病视网膜病变(DR)早期为微血管非殖型病变,病程逐渐发展为病变部位延伸超过内界膜的增殖型病变。DR发生主要的机制与糖尿病机体多元醇途径亢进、氧化应激、终末糖基化产物积累、蛋白激酶C激活以及细胞因子和生长因子过度表达等有关[52]。视网膜神经退变是糖尿病视网膜病变早期发生的重要病理变化[53-55]。醛糖还原酶(AR)是糖尿病视网膜病变的多元醇途径损伤异常激活的关键酶。黄芪甲苷能抑制db/db小鼠视网膜电图异常与视网膜神经节细胞凋亡,抑制血清和视网膜中AR活性与p-ERK1/2,NF-κB过度激活,改善视网膜神经节细胞(RGC)功能[28]。在体外试验中,黄芪甲苷提高高糖诱导RGC损伤细胞存活率,抑制细胞凋亡,上调线粒体膜电位,缓解线粒体水肿[56],抑制牛晶状体提取的AR活性[57],改善DR。
2.4 糖尿病周围神经病变 糖尿病周围神经病变(DPN)的主要病理变化是轴索变性改变和脱失,神经纤维的密度下降,神经髓鞘与神经元损害以及与神经损害平行的毛细血管基底膜增厚和管腔闭塞[58]。其发病机制复杂主要与多元醇途径、氧化应激、己糖胺途径、蛋白激酶C途径激活以及糖基化终末产物(AGEs)和生长因子的异常表达有关[59]。黄芪甲苷作用能改善糖尿病模型大鼠有髓神经纤维脱髓鞘、神经外膜糖化蛋白的沉积现象,提高神经细胞膜和红细胞膜Na+-K+-ATP酶活性以及神经组织中GSH-Px活性,抑制醛糖还原酶(AR)异常表达,提高神经传导速度和神经敏感性,改善大鼠DPN症状[60]。在体外高糖诱导SH-SY5Y神经细胞损伤模型中,黄芪甲苷能提高模型细胞存活率,降低上清液中8-羟基脱氧鸟苷酸(8-OHdG)含量,对高糖诱导的SH-SY5Y细胞凋亡具有保护作用[61]。
2.5 糖尿病心肌病 糖尿病心肌病是由糖尿病引起的心肌结构和功能的改变,其主要的病理特征为心肌细胞肥大、间质纤维化和PAS阳性物质浸润及冠状小动脉基底膜增厚等[62]。黄芪甲苷具有明显的心肌保护作用,能增强心肌收缩力、抑制心肌肥厚、干预心室重塑、抗缺血再灌注损伤、抗心律失常、抗缺血再灌注损伤、抗病毒性心肌炎等,其可能的机制有:维持心肌细胞内钙稳态起作用、抗氧化反应,改善心肌能量代谢、抑制细胞凋亡等[63-64]。在黄芪甲苷干预糖尿病模型大鼠中,能改善大鼠的心肌组织损伤,提高能量代谢,促进心肌细胞线粒体的生物合成,可能与上调线粒体生物合成的关键调控因子过氧化体增殖物激活型受体γ共激活因子 1α(PGC-1α)和核呼吸因子(NRF-1)表達有关[9,65]。黄芪甲苷干预高糖诱导的乳鼠心肌细胞损伤模型,能提高细胞存活率,抑制细胞内的 ROS,MDA,NOX4表达,减少模型细胞氧化损伤,保护心肌细胞[66]。在体外高糖诱导心肌肥大细胞模型中,黄芪甲苷降低模型细胞心肌细胞蛋白质的含量和细胞体积,降低[Ca2+]瞬间变化,抑制高糖诱导的乳鼠心肌细胞肥大[67]。
常见黄芪甲苷防治糖尿病并发症机制见表2。
3 讨论与展望
黄芪甲苷作为中药黄芪的活性提取物,药物研究不断深入,药理作用及机制逐渐清晰。大量研究资料表明黄芪甲苷多系统、多靶点的药理作用与糖尿病及其并发症多系统复杂的发病机制相切合,可能成为治疗糖尿病及糖尿病并发症的良好临床药物。黄芪甲苷的深入研究和临床新药的开发利用还有诸多问题需要进一步探讨。①黄芪甲苷治疗糖尿病的直接作用靶点及具体分子机制尚不明确。黄芪甲苷针对糖尿病及并发症治疗作用的研究广泛但不够深入,对具体靶器官药效作用及具体药物作用机制缺乏一致性的结论,对相关药物作用现象缺乏深入的药物机制资料。②黄芪甲苷毒理学研究资料较少。目前,中药黄芪以及临床药品黄芪注射液单方和复方制剂毒理学研究尚未发现明显的毒性作用。黄芪甲苷作为黄芪的活性物质,但不能确保其安全性。现有资料表明黄芪甲苷在1.0 mg·kg-1剂量对SD大鼠有母体毒性,1.0 mg·kg-1以上剂量对SD大鼠和新西兰兔均有一定的胚胎毒性[68]。黄芪甲苷的毒理学研究资料需要进一步完善。③黄芪甲苷针对糖尿病的研究领域应向糖尿病前期辐射。本课题组研究提出糖尿病的防治重心前移至糖尿病前期的“早预防、早干预、早防变”防治策略对糖尿病防治具有重大意义[69]。黄芪甲苷与中医治未病思想相结合可能是糖尿病防治新的突破点。④黄芪甲苷的联合用药是其开发利用的有效途径。黄芪甲苷与降糖西药联用以及与其他中药联用,可能是实现优势互补、减毒增效、解决糖尿病血糖难控因素的有效途径。endprint
[參考文献]
[1] 中国药典.一部[S].2010:283.
[2] 陈国辉,黄文凤.黄芪的化学成分及药理作用研究进展[J].中国新药杂志,2008,17(17):1482.
[3] 张蔷,高文远,满淑丽.黄芪中有效成分药理活性的研究进展[J].中国中药杂志,2012,37(21): 3203.
[4] Ren S, Zhang H, Mu Y, et al. Pharmacological effects of astragaloside IV: a literature review[J]. J Tradit Chin Med,2013,33(3):413.
[5] Li L, Hou X, Xu R, et al. Research review on the pharmacological effects of astragaloside IV[J]. Fundam Clin Pharmacol,2017,31(1):17.
[6] 段炼,李会军,闻晓东,等.黄芪治疗糖尿病研究进展[J].中国新药杂志,2013,22(7):776.
[7] Campos C. Chronic hyperglycemia and glucose toxicity: pathology and clinical sequelae[J]. Postgrad Med,2012,124(6):90.
[8] Lv L,Wu S Y, Wang G F, et al. Effect of astragaloside IV on hepatic glucose-regulating enzymes diabetic mice induced by a high-fat diet and strepto zotocin[J]. Phytother Res, 2010,24(2):219.
[9] 韩冬.黄芪甲苷对实验性糖尿病大鼠降糖、调脂和抗氧化作用的研究[J].现代中西医结合杂志,2016,25(4):360.
[10] Yin Y, Qi F, Song Z, et al. Ferulic acid combined with astragaloside IV protects against vascular endothelial dysfunction in diabetic rats[J]. Biosci Trends,2014,8(4):217.
[11] Guo H, Cao A, Chu S, et al. Astragaloside IV attenuates podocyte apoptosis mediated by endoplasmic reticulum stress through upregulating sarco/endoplasmic reticulum Ca(2+)-ATPase 2 expression in diabetic nephropathy[J]. Front Pharmacol,2016,7: 500.
[12] 谢春英.黄芪甲苷降血糖作用的实验研究[J].中药材,2010,33(8):1319.
[13] 刘必旺,吉海杰,许凯霞,等.黄芪甲苷对免疫低下糖尿病大鼠的影响[J].山西中医,2013,29 (8):45.
[14] 江清林,姜吉文,吕学诜,等.黄芪甲苷对类胰升血糖素肽-1作用的研究[J].中国老年学杂志,2003,23(1):52.
[15] 江清林,李延君,辛华,等.黄芪甲甙对胰岛素C肽分泌作用研究[J].黑龙江医药科学,1999,22(3):14.
[16] McGarry J D. Banting lecture 2001: dysregulation of fatty acid metabolism in the etiology of type 2 diabetes[J]. Diabetes,2002,51(1):7.
[17] Ovalle F. Cardiovascular implications of antihyperglycemic therapies for type 2 diabetes[J]. Clin Ther,2011,33(4):393.
[18] Wu H, Gao Y, Shi H L, et al. Astragaloside IV improves lipid metabolism in obese mice by alleviation of leptin resistance and regulation of thermogenic network[J].Sci Rep, 2016,6:30190.
[19] Jiang B,Yang Y, Jin H, et al. Astragaloside IV attenuates lipolysis and improves insulin resistance induced by TNFalpha in 3T3-L1 adipocytes[J]. Phytother Res,2008, 22(11):1434.
[20] Tsuchiya Y, Hatakeyama H, Emoto N, et al. Palmitate-induced down-regulation of sortilin and impaired GLUT4 trafficking in C2C12[J]. Myotubes J Biol Chem,2010,285(45):3437.endprint
[21] Zhu R, Zheng J, Chen L, et al. Astragaloside IV facilitates glucose transport in C2C12 myotubes through the IRS1/AKT pathway and suppresses the palmitate induced activation of the IKK/IκBα pathway[J]. Int J Mol Med,2016,37(6):1697.
[22] Marc Y Donath.Targeting inflammation in the treatment of type 2 diabetes:time to start[J]. Nat Rev Drug Discov, 2014,13(6):465.
[23] Odegaard J I, Chawla A. Pleiotropic actions of insulin resistance and inflammation in metabolic homeostasis[J]. Science,2013,339(6116):172.
[24] Zhang W J, Hufnagl P, Binder B R. Antiinflammatory activity of astragaloside IV is mediated by inhibition of NF-kappaB activation and adhesion molecule expression[J]. Thromb Haemost,2003,90(5):904.
[25] Zhang W J, Frei B. Astragaloside IV inhibits NF-κB activation and inflammatory gene expression in LPS-treated mice[J]. Mediators Inflamm, 2015(10):1.
[26] He C L, Yi P F, Fan Q J, et al. Xiang-Qi-Tang and its active components exhibit antiinflammatory and anticoagulant properties by inhibiting MAPK and NF-κB signaling pathways in LPS-treated rat cardiac microvascular endothelial cells[J]. Immunopharmacol Immunotoxicol,2013,35(2):215.
[27] Gui D, Huang J, Guo Y, et al. Astragaloside Ⅳ ameliorates renal injury in streptozotocin- induced diabetic rats through inhibiting NF-κB-mediated inflammatory genes expression[J]. Cytokine,2013,61(3):970.
[28] Ding Y, Yuan S, Liu X, et al. Protective effects of astragaloside IV on db/db mice with diabetic retinopathy[J]. PLoS ONE,2014,9(11):e112207.
[29] 田震亞,王会敏,田炜,等.葛根素和黄芪甲苷及其配伍对TZDM大鼠的影响[J].河北联合大学学报:医学版,2013,15(4):453.
[30] Reddy V P, Zhu X, Perry G, et al. Oxidative stress in diabetes and Alzheimer′s disease[J]. J Alzheimers Dis,2009,16(4):763.
[31] 任春久,张瑶,崔为正,等.氧化应激在2型糖尿病发病机制中的作用研究进展[J].生理学报, 2013,65(6):664.
[32] 黄晓东,沈楠,路倩,等.黄芪甲苷对糖尿病肾脏病变大鼠氧自由基代谢和转化生长因子β1 mRNA表达的影响[J].吉林大学学报:医学版,2016,42(1):48.
[33] Ma Y, Li W, Yin Y. AST Ⅳ inhibits H2O2-induced human umbilical vein endothelial cell apoptosis by suppressing Nox4 expression through the TGF-β1/Smad2 pathway[J]. Int J Mol Medicine,2015,35(6):1667.
[34] 曹玲玲,李维祖,司秀莲,等.黄芪甲苷对肾小球系膜细胞氧化应激损伤的保护作用及其机制[J].中国中药杂志,2013, 38(5):725.
[35] 熊莉,李维组,孙立,等.黄芪甲苷对高糖诱导人肾小球系膜细胞损伤的保护作用及其机制[J].安徽医科大学学报,2014,49(9):1274.
[36] Sun L, Li W, Li W, et al. Astragaloside Ⅳ prevents damage to human mesangial cells through the inhibition of the NADPH oxidase/ROS/Akt/NF-κB pathway under high glucose conditions[J].Int J Mol Med,2014,34(1):167.endprint
[37] Li H B, Ge Y K, Zhang L. Astragaloside Ⅳ improved barrier dysfunction induced by acute high glucose in human umbilical vein endothelial cells[J].Life Sci,2006,79(12):1186.
[38] Toh Y, Pencil S D, Nicolson G L. A novel candidate metastasis-associated gene, mta1, differentially expressed inhigh metastatic mammary adenocarcinoma cell lines[J]. J Biol Chem,1994,269(37):22958.
[39] Yuan W, Zhang Y, Ge Y, et al. Astragaloside Ⅳ inhibits proliferation and promotes apoptosis in rat vascular smooth muscle cells under high glucose concentration in vitro[J]. Planta Med,2008,74(10):1259.
[40] Schrijvers B F, DeVriese A S, Flyvbjerg A. From hyperglycemia to diabetic kidney disease: the role of metabolic,hemodynamic, intracellular factors and growth factors/cytokines[J]. Endocr Rev,2004,25(6):971.
[41] Jefferson J A, Shankland S J, Pichler R H. Proteinuria in diabetic kidney disease:a mechanistic view point[J]. Kidney Int,2008,74(1):22.
[42] Susztak K, Raff A C, Schiffer M, et al. Glucose induced reactive oxygen species cause apoptosis of podocytes and podocyte depletionat the onset of diabetic nephropathy[J]. Diabetes,2006,55(1):225.
[43] Schiffer M, Bitzer M, Roberts I S, et al. Apoptosis in podocytesinduced by TGF-beta and Smad7[J]. J Clin Invest,2001,108(6):807.
[44] Piwkowska A, Rogacka D, Audzeyenka I, et al. High glucose concentration affects the oxidant-antioxidant balance in culturedmouse podocytes[J]. J Cell Biochem,2011,112(6):1661.
[45] Gui D, Guo Y, Wang F, et al. Astragaloside Ⅳ,a novel antioxidant, prevents glucose induced podocyte apoptosis in vitro and in vivo[J]. PLoS ONE,2012,7(6):e39824.
[46] Guo H, Wang Y, Zhang X, et al. Astragaloside Ⅳ protects against podocyte injury via SERCA2-dependent ER stress reduction and AMPKα-regulated autophagy induction in streptozotocin-induced diabetic nephropathy[J]. Sci Rep,2017,7(1):6852.
[47] Yao X M, Liu Y J, Wang Y M, et al. Astragaloside Ⅳ prevents high glucose-induced podocyte apoptosis via downregulation of TRPC6[J]. Mol Med Rep,2016, 13(6):5149.
[48] 徐維佳,牟姗,王琴,等.黄芪甲苷对高糖诱导的肾小管上皮细胞损伤的保护作用[J].中国中西医结合杂志,2012,13(9):765.
[49] Sun H, Wang W, Han P, et al. Astragaloside Ⅳ ameliorates renal injury in db/db mice[J]. Sci Rep,2016,6:32545.
[50] Qi W, Niu J, Qin Q, et al. Astragaloside Ⅳ attenuates glycated albumin-induced epithelial-to-mesenchymal transition by inhibiting oxidative stress in renal proximal tubular cells[J]. Cell Stress Chaperones,2014,19(1):105.endprint
[51] Liu X, Wang W, Song G, et al. Astragaloside Ⅳ ameliorates diabetic nephropathy by modulating the mitochondrial quality control network[J]. PLoS ONE,2017,12(8):e0182558.
[52] 易茜璐,于明香.糖尿病视网膜病变的发病机制[J].复旦学报:医学版,2010,37(5):604.
[53] Greenstein V C, Shapiro A, Zaidi Q, et a1. Psychophysical evidence for post receptoral sensitivity loss in diabetics[J]. Invest Ophthalmol Vis Sci,1992,33:278l.
[54] Arse M J, Han Y, Schneck M E, et a1. Local multifocal oscillatory potential abnormalities in diabetes and early diabetic retinopathy[J]. Invest Ophthalmol Vis Sci,2004,45:3259.
[55] Parisi V, Scarale M E, Balducci N, et a1.Electrophysiological detection of delayed postretinal neural conduction in human amblyopia[J]. Invest Ophthalmol Vis Sei,2010,51:5041.
[56] 郝明,匡洪学,傅铮,等,黄芪甲苷对高糖培养下视网膜神经节细胞的保护作用[J].中华医学杂志,2012,92(30):2104.
[57] 印晓星,张银娣,刘晓,等.银杏叶提取物和黄芪甲苷对牛晶状体醛糖还原酶的抑制作用[J].徐州医学院学报,2006,26(6):478.
[58] 袁云.糖尿病周围神经病变的临床病理类型以及相关的电生理改变[J].中国糖尿病杂志,2008,16(6):321.
[59] 施君,张文川.糖尿病周围神经病变发病机制的研究进展[J].上海交通大学学报:医学版,2012,32(1):116.
[60] Yu J, Zhang Y, Sun S, et al. Inhibitory effects of astragaloside Ⅳ on diabetic peripheral neuropathy in rats[J].Can J Physiol Pharmacol,2006,84(6):579.
[61] 姜文大,李继,臧丽娥,等.黄芪甲苷对高糖诱导SH-SYSY细胞凋亡的保护作用[J].中药药理与临床,2013,29(6):19.
[62] Factor S M, Borczuk A, Charron M J, et al. Myocardial alterations in diabetes and hypertension[J]. Diabetes Res Clin Pract,1996,31(2):S133.
[63] 陈靖宇,陈铁龙.黄芪甲苷对心肌细胞保护作用的研究进展[J].中西医结合心脑血管病杂志,2016,14(9):980.
[64] 刘天一,何观虹,姚丽.黄芪甲苷治疗心血管疾病研究进展[J].中医药信息,2013,30(2):117.
[65] 曹琼丹,杨育红,于胜男,等.黄芪甲苷对Ⅰ型糖尿病大鼠心肌细胞PGC-1α和NRF-1表达的影响[J].中国药理学通报,2015,31(8):1096.
[66] 曹琼丹,杨育红,唐富天,等.黄芪甲苷对高糖诱导的乳鼠心肌细胞氧化应激的影响[J].中药药理与临床,2015,31(5):27.
[67] 李香华,王洪新,王秋宁.黄芪甲苷对高糖诱导的乳大鼠心肌肥大的保护作用[J].中国动脉硬化杂志,2010,18(11):845.
[68] Jiang B Z, Xu Y W, Yu P Z, et al. Effect of astragaloside Ⅳ on the embryo-fetal development of Sprague Dawley rats and New Zealand White rabbits[J]. J Appl Toxicol,2009,29(5):381.
[69] 方朝暉,赵进东,王建和,等.基于三早防治体系采取中医综合方案干预糖耐量减低的临床应用[J].成都中医药大学学报,2013,36(3):90.
[责任编辑 张宁宁]endprint
