银杏二萜内酯葡胺注射液用于6300例缺血性脑卒中患者的上市后临床安全性再评价研究
2018-01-29周莉高颖赖新星徐天舒于明王珩赵建军谭子虎
周莉+高颖+赖新星+徐天舒+于明+王珩+赵建军+谭子虎

[摘要] 进一步评价银杏二萜内酯葡胺注射液上市后扩大用药人群范围对缺血性脑卒中患者的临床安全性。采用多中心、前瞻性、开放、非对照的临床研究设计方法,于2013年6月—2014年12月,在82家临床单位开展银杏二萜内酯葡胺注射液上市后临床安全性再评价研究。完成病例入组6 300例,试验中,共观察记录到29例次不良反应,ADR发生率为0.46%,其中约86.21%(25例次)的ADR为轻度,表现为一过性,无需干预即可缓解或消失;13.79%(4例次)为中度,头痛2例次,头晕1例次,皮疹1例次;未见重度不良反应。银杏二萜内酯葡胺注射液安全性研究中发生的不良反应均为前期已知不良反应或注射剂常见不良反应,整体不良反应发生率较低且风险可控。
[关键词] 银杏二萜内酯葡胺注射液; 安全性研究; 不良事件/不良反应; 上市后再评价
[Abstract] To further evaluate the safety of ginkgo diterpene lactone meglumine injection in the clinical use in ischemic stroke patients. Clinical safety study was conducted in 82 clinical units and 6 300 cases were completed and included from June 2013 to December 2014 by using multicenter, prospective, open and uncontrolled design methods for clinical research. A total of 29 cases of adverse reactions were observed in the experiment. Adverse reaction ratio (ADR) was 0.46%, and about 86.21% (25 cases) of them was mild with transient response which could be alleviated or disappeared without intervention; about 13.79% (4 cases) was moderate, including 2 cases of headache, 1 case of dizziness and 1 case of rash; no serious adverse reactions were found. The adverse reactions occurred in this study were pre-known adverse reactions or common adverse reactions of Chinese medicine injection. The overall incidence of adverse reactions was low, and the risk was controllable.
[Key words] ginkgo diterpene lactone meglumine injection; study on clinical safety; adverse events/adverse reactions; post-marketing re-evaluation
脑卒中是严重危害人类健康和生命的重大疾病,我国最新的脑卒中大型流行病学调查结果显示,我国居民脑卒中的患病率约为1 114.8/10万人,死亡率为114.8/10万人,每年有大约240万新发卒中患者,造成了巨大的社会与经济负担[1]。由于中医药独特的原创优势,在脑卒中防治领域中,相关中成药已得到了认可并在临床中广泛应用[2]。然而,随着中成药尤其是中药注射剂临床不良反应问题日益受到关注,中药注射液临床应用安全性已成为其上市后再评价的关键问题之一[3]。随着2009年科技部设立国家“重大新药创制”科技重大专项——“中药上市后再评价关键技术”,我国针对中药的上市后安全性再评价开展了大量的研究,并积累了一定的方法学与实践经验[4]。
银杏二萜内酯葡胺注射液(ginkgo diterpene lactone meglumine injection,GDLMI)是2012年获批上市的新药(国药准字Z20120024),功能主治为活血通络,临床用于中风病中经络(轻中度脑梗死)痰瘀阻络证。Ⅲ期临床试验结果表明,GDLMI在改善患者神经功能和中医证候积分方面具有显著的疗效,并且不增加患者的安全风险[5]。然而,由于药品上市前研究存在病例数相对较少、用药人群范围较窄、合并用药控制严格等原因[6],仅根据临床前研究难以对药品的安全性进行全面地评估。为了进一步评价GDLMI在临床应用中的安全性,根据药品注册批件(批件号2012S00646)、《药品注册管理办法》等要求,课题组于2013年6月—2014年12月,在北京中医药大学东直门医院、南京大学医学院附属鼓楼医院、江苏大学附属医院、天津市南开医院、长春中医药大学附属医院、湖北省中医院等82家临床单位组织开展了GDLMI上市后临床安全性再评价研究。
1 资料与方法
1.1 研究设计
采用多中心、前瞻性、开放、非对照的临床研究设计方法,旨在评价GDLMI用于缺血性脑卒中患者的安全性。
1.2 研究对象
1.2.1 诊断标准 缺血性脑卒中西医诊断标准,参照中华医学会神經病学分会脑血管病学组急性缺血性脑卒中诊治指南撰写组《中国急性缺血性脑卒中诊治指南2010》制定[7]。痰瘀阻络证辨证标准,参照《中药新药临床研究指导原则(试行)》[8]制定。endprint
1.2.2 纳入病例标准 符合西医缺血性脑卒中诊断标准,并符合中医中风病中经络诊断标准和痰瘀阻络证辨证标准者;年龄18~80岁者;病程在发病后2周~6个月之间;签署知情同意书者。
1.2.3 排除标准 伴有神智障碍者(神志障碍或严重痴呆者);肝功能实验室指标AST≥2倍正常值上限或ALT≥2倍正常值上限,或严重肾功能异常者;合并有其他严重循环系统、造血系统、消化系统、内分泌系统等疾病者;精神异常者;合并梗死后出血转化,或有出血倾向者;有下肢静脉血栓形成者;对本品或银杏类制剂有过敏或严重不良反应病史者,对葡甲胺及葡甲胺类制剂过敏者;妊娠、哺乳者和6个月内有妊娠计划者;近1个月参加其他临床研究者;医生认为不宜参加临床研究者。
1.2.4 剔除标准 对已被选入本研究,属于以下情况之一者,作为剔除病例:误诊;误纳;未用药;用药后无任何记录。
1.2.5 中止标准 研究中发生严重安全性问题(如出现严重不良事件者或出现严重并发症或病情迅速恶化者),应及时中止;研究中发现研究方案制订有重大失误,或实施有重大偏差,难以评价药物效应;申办者要求中止;CFDA撤销本研究。
1.3 用药方案
1.3.1 试验用药 银杏二萜内酯葡胺注射液,每支装5 mL(含银杏二萜内酯25 mg),由江苏康缘药业股份有限公司生产。每次1支(25 mg),每日1次,临用前,将药物缓缓加入到0.9%氯化钠注射液250 mL中稀释,缓慢静脉滴注,用药期间严格控制滴速,首次使用时滴速控制在每分钟10~15滴,观察30 min无不适者,可适当逐渐提高滴注速度,但不高于每分钟30滴。疗程为14 d。
1.3.2 合并用药 参考《中国缺血性脑卒中和短暂性脑缺血发作二级预防指南2010》规范用药,受试者入组前已使用的缺血性脑卒中恢复期合理治疗方法尽量维持不变。用药期间禁止使用具有类似功能主治的中药或中成药(如注射用血塞通、丹参注射液、注射用丹参多酚酸盐、丹红注射液、复方丹参片、步长脑心通胶囊、通心络胶囊等),或从功能主治类似中药的提取物(如磷酸川芎嗪注射液、丹参酮ⅡA磺酸钠注射液等),以及其他中药注射剂(如痰热清注射液、生脉注射液、双黄连注射液等);合并用药情况详细记录于研究病历与病例报告表。
1.4 安全性评价
1.4.1 不良事件的分类标准和内容 不良事件名称采用 MedDRA 20.0 中文版编码进行不良事件分类。主要观察本品在前期临床试验中观察到的不良反应(如面部皮疹、头晕、肝功能异常等),同时应观察中药注射剂其他常见不良反应(如局部反应、血管刺激、心悸、过敏性哮喘、呼吸困难、热原反应等)。
1.4.2 其他安全性指标 生命体征治疗前后变化,实验室指标治疗前后异常变化,包括血常规(RBC,WBC,HGB,PLT)、尿常规(ERY,LEU,GLU,PRO),便常规+潜血、肝功能(ALT,AST,TBil,ALP,GGT)、肾功能(BUN,Cr)、凝血功能(PT,APTT,TT,FIB);常规12导联心电图;安全性观察均在末次用药后3 d内完成。
1.4.3 不良反应判定标准 按照国家药品不良反应监测中心制定的《药品不良反应报告和监测管理办法》[9],将“肯定有关”、“很可能有关”、“可能有关”的不良事件判定为不良反应。
1.5 伦理审查与方案注册
该研究于2013年5月通过北京中医药大学东直门医院医学伦理委员会批准(伦理批号ECPJ-BDY-2013-17-1),并于美国临床试验注册网ClinicalTrials.gov完成注册(注册号NCT01958957)。
1.6 数据统计
基线数据按全分析集进行分析,安全性分析采用安全性分析集。计量资料的描述将计算均数、标准差、中位数、最小值、最大值;计数资料的描述采用频数和百分比,描述不良事件/反应的分布,列出例次、例数、发生率;描述各种合并用药的分布情况,及不同合并用药的不良事件发生分布情况;采用Logistic回归方法分析不良反应和不良事件发生的影响因素。所有的假设检验取双侧α=0.05(单因素风险分析除外,此时检验水准设置为0.15)。统计分析及绘图分别采用SAS 9.4及R 3.3.3统计软件包完成。
2 结果
2.1 基线特征
本次试验实际82家参试单位共入组受试者6 300例,试验期间中止103例(含缺乏疗效脱落5例),数据审核时56例完成试验但是疗程≤7 d属于严重违背方案剔除,最终进入FAS集6 300例、PPS集6 146例、SS集6 300例。受试者基线特征见表1。
2.2 药物使用情况
本研究患者平均用药时间为(13.87±1.26) d,中位用药时间为14 d,94.41%的患者接受了14 d用药。
2.3 安全性分析
2.3.1 不良事件/不良反应总体情况 研究中共出现不良事件239例(263例次),不良事件发生率为3.79%,其中29例(29例次)经研究判断与研究药物具有相关性(“肯定有关”、“很可能有关”、“可能有关”),视为药物的不良反应,不良反应发生率为0.46%。其中约86.21%(25例次)的ADR为轻度,表现为一过性,无需干预即可缓解或消失;13.79%(4例次)为中度,头痛2例次,头晕1例次,皮疹1例次;未见重度不良反应。
不良反应主要集中在各类神经系统、皮肤及皮下组织、血管与淋巴管类等类别,其中各类神经系统发生12例(12例次),主要表现为头晕、头痛;皮肤及皮下组织发生10例(10例次),主要表现为皮疹、瘙痒;血管与淋巴管类发生3例(3例次),主要表现为输液部位血管疼痛、红肿,见表2。
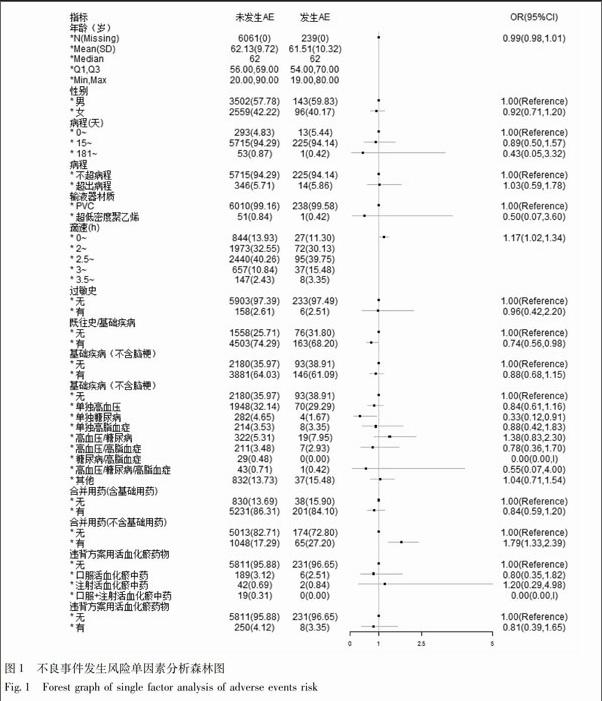
2.3.2 不良事件/不良反应发生的影响因素分析 针对不良事件和不良反应发生的其潜在的影响因素,包括年龄、性别、病程、基础疾病、合并用药情况、過敏史、既往史、滴速等,经对上述因素进行分析,未发现年龄、性别、病程、基础疾病和合并用药影响不良事件和不良反应的发生,详细分析数据见图1。本研究将该处单因素分析的检验水准设置为0.15。endprint
2.3.3 与其他药物联合使用不良事件发生情况 本研究有877例患者未合并用药,发生40例(4.56%)AE,5 423例患者使用了方案规定允许的合并用药,发生199例(3.66%)AE,两者相较,差异无统计学意义。合并用药的种类包括降压药物、降血糖药物、调脂药物、抗血小板药物、改善脑循环药物、神经保护药物等,其发生AE的例数(率),见表3,4。考察与抗血小板药物联合使用的安全性,显示联合使用一种或多种抗血小板药物未见出血风险增加,没有发现导致出血的危险因素,可见本品与抗血小板药物联合使用安全性良好。
2.3.4 药物批次与药物安全性分析 本研究共使用了23个批次的药物,较多用药批次为140607,130201,130903,130902等,其中1 548例(25.47%)患者使用了2个批次的药物,各批次药物不良事件发生情况未见明显差别。
3 讨论
银杏二萜内酯葡胺注射液以银杏叶为原料,采用提取、纯化获得其活性最强的银杏二萜内酯类有效组分,包括银杏内酯A、银杏内酯B、银杏内酯K等。前期动物实验研究结果表明,银杏二萜内酯葡胺注射液对缺糖缺氧损伤的SHSY5Y细胞具有明显的保护作用,其保护机制可能与细胞内PI3K/Akt/Bad/caspase-3/7、cAMP/PKA /Bad/caspase-3/7细胞通路的激活有关[10]。此外,银杏二萜内酯葡胺注射液对大鼠局灶性脑缺血再灌注损伤具有保护作用,其作用机制可能与其修复血脑屏障、抗自由基损伤及抑制Caspase-3表达有关[11];同时,还具有抗血小板聚集,保护中枢神经系统和心血管系统,防止或逆转脑缺血后遗症所引起的脑损伤等作用[10-16]。前期的毒理学实验通过对2种动物的血常规、血液生化,主要脏器指数及主要脏器的组织切片进行了检查,研究结果表明:在大鼠长期毒性试验中,未发现银杏二萜内酯在经腹腔注射连续给药8 周后對大鼠有明显毒性作用。同时,在犬长期毒性试验中,未发现银杏二萜内酯在经静脉注射连续给药9 周后对犬有明显毒性作用。
根据CFDA国家不良反应监测中心提供的监测数据,自2013年GDLMI正式上市销售,至2017年10月31日,CFDA共收到13份不良反应自发反馈报告,包括皮疹4例,心悸4例,头痛2例,面部潮红2例,毛细血管扩张1例。此外,GDLMI上市前临床试验中已经观察到ADRs包括头晕、面部皮疹、白细胞增高等[5],本次研究中观察到的头晕、头痛、皮疹均为前期临床研究中已经观察到的不良事件/不良反应。参考已发表的中药注射剂不良反应相关文献[17-18],上述不良反应均为中药注射剂常见不良反应。
本研究观察到的不良事件发生率为3.79%,经研究判断与研究药物具有相关性的不良反应发生率为0.46%,其中86.21%(25例次)为轻度不良反应,表现为一过性,无需干预即可缓解或消失,13.79%(4例次)为中度不良反应,包括头痛2例次,头晕1例次,皮疹1例次;未见重度不良反应。不良反应主要集中在神经系统、皮肤及皮下组织、血管与淋巴管类等部分;未见与出血相关不良反应,且GDLMI与抗血小板药物等联用不增加不良事件发生风险。
本研究具有一定的局限性,如①为明确观察GDLMI的安全性,研究对合并用药进行了一定限制 (如不允许使用中药注射剂等),因此与临床实际合并用药情况有一定差异;②研究设定了入组、排除标准以筛选适合进入临床观察的患者,虽然与上市前临床试验相比,本研究适当放宽了入选条件,但临床实际使用时人群特征更为复杂;③由于未对参加本研究的临床单位进行整群随机抽样,因此纳入本研究的患者人群代表性尚存在一定局限性。
未来对于GDLMI临床安全性评价,可以借鉴国内外关于上市后药品安全性评价的宝贵经验,结合自发呈报被动监测、主动监测、医院集中监测、药品使用调查、登记注册等多种方法,对GDLMI的临床安全性进行更全面的综合评价,为临床用药安全提供更充分的依据[19-20]。
[参考文献]
[1] Wang W, Jiang B, Sun H,et al. Prevalence, incidence, and mortality of stroke in China: results from a nationwide population-based survey of 480 687 adults[J].Circulation, 2017, 135(8): 759.
[2] Wu B, Liu M, Liu H, et al. Meta-analysis of traditional Chinese patent medicine for ischemic stroke[J]. Stroke, 2007, 38(6): 1973.
[3] 谢雁鸣, 田峰. 中药上市后再评价关键问题商榷[J]. 中国中药杂志, 2010, 35(11):1494.
[4] 孙世光, 李子峰, 谢雁鸣,等. 中药注射剂临床使用合理性与安全性再评价方法学探讨[J]. 中国中药杂志, 2013, 38(18):2969.
[5] 赵宾江, 王振中, 凌娅,等. 银杏二萜内酯葡胺注射液治疗动脉粥样硬化性血栓性脑梗死恢复期(痰瘀阻络证)Ⅲ期临床试验[J]. 中草药, 2013, 44(24):3525.
[6] 杨羽, 詹思延. 上市后大数据药品安全主动监测模式研究的必要性和可行性[J]. 药物流行病学杂志, 2016(7):401.
[7] 中华医学会神经病学分会脑血管病学组急性缺血性脑卒中诊治指南撰写组. 中国急性缺血性脑卒中诊治指南2010[J]. 中国医学前沿杂志:电子版, 2010, 4(2): 50.
[8] 郑筱萸. 中药新药临床研究指导原则[M]. 北京: 中国医药科技出版社,2002:68.endprint
[9] 国家食品药品监督管理局. 药品不良反应报告和监测管理办法[EB/OL].(2011-05-04)[2017-12-01]. http://www.sda.gov.cn/WS01/CL0053/62621.html.
[10] 刘秋, 许治良, 周军, 等. 银杏二萜内酯葡胺注射液对缺糖缺氧损伤的SH-SY5Y细胞保护作用[J]. 中国药理学通报, 2015,31(7):994.
[11] 陈春苗, 周军, 陈健, 等. 银杏二萜内酯葡胺注射液对大鼠急性脑缺血再灌注损伤的影响[J]. 中国实验方剂学杂志, 2014,20(17):133.
[12] 刘秋, 许治良, 金治全, 等. 银杏二萜内酯葡胺注射液通过下调calpain信號通路抑制脑缺血神经细胞凋亡[J]. 中国药科大学学报, 2015,46(6):707.
[13] 司海红, 李艳静, 薛佳, 等. 银杏二萜内酯葡胺注射液原料中5种微量银杏酸的LC-MS/MS含量测定研究[J]. 中国中药杂志, 2015,40(14):2832.
[14] 肖展翅, 倪小红, 李钢, 等. 银杏二萜内酯葡胺注射液对脑梗死恢复期患者血液流变学的影响[J]. 中西医结合心脑血管病杂志, 2015,13(16):1828.
[15] 章晨峰, 曹亮, 邓奕, 等. 银杏二萜内酯葡胺注射液对脑缺血再灌注大鼠行为学和脑脊液成分的影响[J]. 中国实验方剂学杂志, 2015,21(20):118.
[16] 周恩丽, 王仁杰, 李淼, 等. 银杏二萜内酯葡胺注射液活性炭吸附工艺的优选[J]. 中国中药杂志, 2015,40(20):3993.
[17] 张惠霞, 陈建玉, 宋成. 3 414例中药注射剂不良反应分析[J]. 中国药物警戒, 2006,3(4):232.
[18] 谭乐俊,王萌,朱彦.中药注射剂的不良反应发展进展[J].中国中药杂志,2014,39(20):3889.
[19] 杨莉, 田丽娟, 罗刚. 全球视角下上市后药品安全主动监测系统比较研究及启示[J]. 科技管理研究, 2017, 37(7):182.
[20] 王丹,沈璐.药品不良反应主动监测的方法与我国的应用[J]. 中国药物评价, 2012, 29(1):85.
[责任编辑 孔晶晶]endprint
