土壤外源Sb(Ⅲ)的老化对其形态和跳虫(Folsomia candida)毒性的影响
2018-01-29林祥龙孙在金马瑾赵淑婷杨侨侯红
林祥龙,孙在金,马瑾,赵淑婷,杨侨,侯红,*
1. 中国环境科学研究院,环境基准与风险评估国家重点实验室, 北京 100000 2. 云南农业大学, 昆明 650000 3. 中国地质大学, 北京 100000
锑(Sb)是地表土壤中的痕量类金属元素[1],其背景浓度为0.3~8.6 mg·kg-1[2]。由于其单质及其化合物在现代生产中的诸多应用(生产陶瓷、玻璃、杀虫剂、烟火材料及阻燃剂等)和Sb矿山开采冶炼,大量的Sb进入到各种环境介质中[3-4]。我国是产Sb大国,由于Sb矿开采很多地区土壤Sb浓度高达6 946~16 389 mg·kg-1[5-6]。Sb是生物非必需元素,已经被证实对人体及其他生物体具有毒性及致癌性,并可导致肝、皮肤、呼吸和心血管系统方面的疾病[7]。作为一种全球性污染物,欧盟(EU)和美国环保署(US EPA)早在1979年就将Sb及Sb的化合物列为优先控制的污染物[8]。
随着人们对Sb毒性越来越多的重视与关注,目前国内外已开展有关Sb对生态受体(植物、无脊椎动物、微生物)毒性的研究[9-12],然而多数基于实验室短期外源添加Sb盐于土壤中模拟Sb污染,并没有考虑Sb在土壤中的老化作用,即水溶性重金属进入土壤后,除迅速完成固-液分配,与土壤胶体间发生吸附解析、氧化还原、溶解沉淀、络合螯合等一系列反应外,还会进入缓慢的老化过程,与土壤间达到新的平衡过程,其可提取态含量、生物有效性或毒性随时间延长而逐渐降低的特性[13-14]。土壤其他重金属生物有效性及其随老化时间的变化被广泛研究,Han等[15]发现重金属进入土壤1 年以后,形态仍然在缓慢转变。Ma等[16]的研究表明,老化速率与时间的平方根呈反比,可持续数月甚至数年,最终达到一个相对稳定的平衡状态。陈丽红等[17]发现随老化时间的延长,土壤中铅对赤子爱胜蚓繁殖的毒性明显降低。不同研究证实,实际田间存在的时限长短不一的老化过程对重金属生态毒性起着关键性影响,与人工添加污染土壤中重金属的有效性及毒性存在着较大差异[18],Koen等[19]研究发现:土壤中仅老化7 d的外源添加铅影响跳虫繁殖的LOEC(最低有影响浓度)为5 550 mg·kg-1,而实际矿区土壤中铅浓度高达14 436 mg·kg-1时才对跳虫繁殖产生影响。并且,不同于铜、锌、镉、铅等这类在土壤中不发生价态转化且主要以阳离子形态存在的重金属,土壤中Sb包含多种形态(有机态和无机态)且主要以水合阴离子形态存在。无机态Sb在土壤中主要有三价和五价2种价态,虽然通常认为Sb(Ⅲ)的毒性是Sb(Ⅴ)的10倍[20],且两者在一定条件下可以互相转化,但大部分研究发现老化土壤中以Sb(Ⅴ)为主[21]。因此,当进行土壤Sb生态毒性评价和为土壤Sb质量基准与标准的制定提供基础毒理数据时,为避免高估其生态风险,尤其是在外源添加水溶性Sb(Ⅲ)的情况下,考虑老化过程显得尤为重要。
跳虫作为土壤无脊椎动物的代表,在评价土壤生态系统的污染方面起着重要作用[22]。其中白符跳(Folsomiacandida)由于具有在土壤中分布广泛、生长周期短、繁殖快、操作简便、评价指标多(死亡率、繁殖数和生长率等)等优势,在生态毒理实验中应用最为广泛,技术最为成熟,并被国际标准化组织(ISO)规定为评价化学品生态毒性的模式生物[23]。
鉴于Sb(Ⅲ)较高的毒性,本研究选用水溶性较好的酒石酸锑钾(C8H4K2O12Sb2·3H2O)[24]为受试污染物,以白符跳为受试生物,参照ISO标准方法指南[25]和其他文献[26],结合化学分析和生物测试,研究7 d和60 d的老化对土壤中Sb(Ⅲ)的价态、水溶态浓度及毒性的影响,以期为土壤Sb的生态风险评估提供科学依据,为土壤Sb环境质量标准的制定提供数据支撑。
1 材料与方法(Materials and methods)
1.1 供试材料
主要试剂:酒石酸锑钾(C8H4K2O12Sb2·3H2O),来自天津精科精细化工研究所,固体颗粒,优级纯(>98%)。
供试土壤:供试北京潮土采自中国环境科学研究院表层土(0~20 cm),使用前在室内自然条件下风干,剔除植物根系及石块后过2 mm筛,测定土壤理化性质(见表2)。具体测定方法见表1。
供试生物:孤雌生殖的白符跳由中国科学院南京土壤所提供,参照ISO 11267[25]中的方法,饲养在培养皿(90 mm×13 mm)中,培养皿底部铺有约0.5 cm厚的培养基(活性炭与熟石膏质量比为1:9,加去离子水搅拌均匀,待其凝固成形后放置3 d后使用)。采用干酵母作为跳虫的食物,使用人工气候箱控制饲养条件,温度为(20±1) ℃,光照与黑暗比为16 h :8 h (光照强度为400~800 lux),空气湿度为75%。每3 天打开盖子补足空气,必要时为培养基补充适量去离子水,加入适量食物,及时清除培养基表面发霉的食物残渣和死亡的跳虫,保持培养基表面清洁湿润,每2个月更换一次培养基。
为降低跳虫虫龄和个体大小差异对实验的影响,实验前需进行同龄化培养。将培养皿中150~200只成虫移入新制培养皿中,加入少量干酵母(约5 mg),在人工气候箱中培养。待跳虫在培养基表面产卵并孵化出幼虫后,移走成虫,3 d后将幼虫转移到新培养皿中培养,继续培养7~9 d后可用于正式实验。同龄化期间培养条件与饲养条件相同。
1.2 实验方法
1.2.1 土壤外源Sb的添加与老化
土壤中外源Sb以酒石酸锑钾水溶液的方式进行添加,跳虫急性毒性实验浓度设置为0、800、1 600、2 400、4 800 mg·kg-1,慢性毒性实验浓度设置为0、100、200、400、800、1 600、2 400 mg·kg-1。土壤与酒石酸锑钾水溶液充分搅拌混匀后,添加去离子水调节土壤水分至其最大可持水量的50%~55% (经测定,土壤添加Sb后pH值降低范围在0.5以内)。将配好的污染土壤置于自封袋,于温室中分别进行7 d和60 d的老化,期间通过称重法每天添加少量去离子水维持土壤湿度。
1.2.2 土壤水溶态Sb浓度及价态测定
老化时间结束后,采取土样,参考Vojtech等[30]方法,称取2 g风干且过2 mm筛后的土壤样品于50 mL塑料离心管中,加入20 mL去离子水,在25 ℃和60 r·min-1条件下振荡2 h,并于4 000 r·min-1条件下离心10 min后,上清液用0.45 μm的醋酸纤维滤膜过滤后稀释,用ICP-MS测定溶液中Sb浓度。同时参考和秋红等[31]与秦德元等[32]的方法,称取相当于0.3 g烘干土的新鲜土壤于5 mL离心管中,加入3 mL柠檬酸提取液,在混旋仪上振荡混合30 min后离心10 min,取上清液,残渣再用同样的方法提取一次,合并2次得到的上清液,用0.45 μm滤膜过滤后,用SA-10型高效液相色谱-氢化物发生-原子荧光形态分析仪(HG-AFS,北京吉天仪器有限公司生产)测定待测液中的Sb浓度。

表1 土壤理化性质测定方法Table 1 The measurement methods of soil physicochemical properties

表2 供试土壤基本理化性质Table 2 The basic physical and chemical properties of test soil
1.2.3 土壤中跳虫暴露实验
急性存活实验:称取30 g受试土壤于有机玻璃杯,加入10只10~12 d大小的跳虫,每浓度设4个重复,加盖后放在人工气候箱中培养7 d,培养过程中不添加酵母,其他培养条件同跳虫饲养条件。培养结束后,用水浮法对存活的跳虫进行计数。
慢性毒性实验:称取30 g受试土壤于有机玻璃杯,加入10只10~12 d大小的跳虫,实验组处理设4个重复,对照组设6个重复,加入5 mg干酵母,盖上盖子后放在人工气候箱中培养28 d,培养条件同跳虫饲养条件。每周开盖通气3次,并补充少量去离子水和干酵母,培养结束后,用水浮法对存活的成虫和繁殖的幼虫数量进行计数。
1.3 数据处理
分别采用 Excel、SPSS 软件对实验数据进行计算处理和显著性差异分析,采用Origin软件进行绘图。用Logistic方程拟合土壤Sb浓度和跳虫毒性效应后根据拟合曲线计算LC50和EC50。数据以平均值±标准差表示。
2 结果(Results)
2.1 土壤外源Sb(Ⅲ)价态随时间的变化

图1 土壤中不同浓度Sb(Ⅲ)价态随老化时间的变化Fig. 1 The changes of oxidative state of Sb(Ⅲ) in soil during the aging period
土壤中外源Sb(Ⅲ)价态转化与老化时间长短和Sb浓度均有关(见图1)。老化仅7 d后,Sb浓度较低(100~800 mg·kg-1)时土壤柠檬酸提取液中Sb主要以Sb(Ⅴ)存在,但未检测出有机态Sb,而土壤Sb浓度较高(1 600~4 800 mg·kg-1)时,分别仅有47.4%、27.5%和2.2%的Sb转化成Sb(Ⅴ),但老化长达60 d后,Sb浓度最高的土壤中Sb(Ⅴ)的比重上升到38.1%,其他处理的土壤中均以Sb(Ⅴ)为主。
2.2 老化对土壤中水溶态Sb浓度的影响

图2 分别老化7 d和60 d后土壤水溶态Sb浓度Fig. 2 The concentrations of soluble Sb in soil when being aged for 7 d and 60 d

图3 不同老化时间对土壤Sb急性毒性的影响注:*表示与老化7 d 相比P<0.05;**表示与老化7 d 相比P<0.01,下同。Fig. 3 The effects of different aging time on acute toxicity of Sb to Folsomia candida in soilNote: * indicates significant differences compared with soils aged for 7 d (P<0.05); ** indicates significant differences compared with soils aged for 7 d (P<0.01). The same below.
土壤中加入Sb后,随着老化时间的延长,添加不同浓度Sb的土壤中水溶态Sb含量占总Sb的比例均显著降低(P<0.01)(见图2)。如土壤Sb浓度为100和4 800 mg·kg-1时,水溶态Sb含量分别由9.3、300.6 mg·kg-1降低到4.9、197.3 mg·kg-1,降低比例分别为47%和34%。
2.3 老化对Sb急性毒性的影响
急性存活实验结束后对照组土壤中跳虫死亡率小于20%,保证了实验的有效性。老化7 d的土壤中跳虫存活数与Sb浓度之间存在明显的剂量-效应关系,在最高浓度4 800 mg·kg-1时,跳虫死亡率达到100%。而经过60 d的老化后,与对照组相比,在Sb浓度为800~2 400 mg·kg-1时跳虫存活数无明显差异,仅在最高浓度时存活数降低至6只,但显著高于老化7 d时跳虫存活数(P<0.01)(见图3)。经计算,急性实验中老化7 d后的土壤Sb影响跳虫存活的LC50为2 105 mg·kg-1(1 792~2 418 mg·kg-1),老化60 d后土壤Sb影响跳虫存活的LC50大于设置的最高浓度。
2.4 老化对土壤Sb慢性毒性的影响
慢性繁殖试验结束后对照组土壤中成虫存活率高于80%,幼虫高于100只,符合ISO关于实验有效性的标准[25]。Sb对跳虫存活和繁殖的毒性作用随老化时间延长而显著减小(见图4)。老化7 d后,跳虫成虫存活数量随土壤Sb浓度的提高而明显降低,老化60 d后,在Sb浓度为200~400 mg·kg-1的土壤中跳虫存活数显著增加(P<0.05),Sb浓度为800~2 400 mg·kg-1的土壤中跳虫存活数(分别为9、8.7和8只)与老化7 d时的存活数(分别为3.3、1.7和0.3只)相比,差异达显著水平(P<0.01)。与成虫存活情况类似,老化7 d的土壤中Sb浓度为200 mg·kg-1时跳虫幼虫数与对照组相比,便显著降低(P<0.05),浓度达到800 mg·kg-1后幼虫数仅21只,已几乎没有幼虫被繁殖出来,而当老化时间延长到60 d后,Sb浓度为800 mg·kg-1时跳虫繁殖才开始受到一定抑制,虽然浓度达到1 600、2 400 mg·kg-1时,幼虫数分别为159.5和112只,仍显著低于对照组(P<0.01),但显著高于老化7 d时的幼虫数(P<0.01)。经计算,慢性实验中老化7 d后的土壤Sb影响跳虫存活的LC50为683 mg·kg-1(612~755 mg·kg-1),老化60 d后在设置的Sb浓度范围内跳虫死亡率未达到50%;影响跳虫繁殖的EC50分别为307 mg·kg-1(265~349 mg·kg-1)、1 419 mg·kg-1(1 251~1 587 mg·kg-1)。
3 讨论(Discussion)
土壤中重金属拥有众多赋存形态,但并不是所有形态都具有毒性,其中水溶态和交换态等由于有较高的移动性,容易被生物吸收而产生毒害,因此它们的含量可以反映土壤重金属的生物有效性[33]。本研究中土壤水溶态Sb含量随着老化时间的延长显著降低,与很多有关其他重金属老化的研究一致,如Li等[33]发现土壤经过100 d老化后水溶态硒浓度由1 mg·kg-1降低到 0.01 mg·kg-1。这是由于重金属进入土壤后,土壤溶液中游离态金属离子随时间很容易向更稳定的形态(铁锰氧化物结合态、有机质结合态及残渣态等)转化,这种转化或老化受控于多种作用,如微孔扩散、表面聚合/沉淀、有机质络合等[33],研究表明土壤铁锰铝化合物、黏粒和有机质都对Sb有着强烈的吸附结合作用[34-35]。
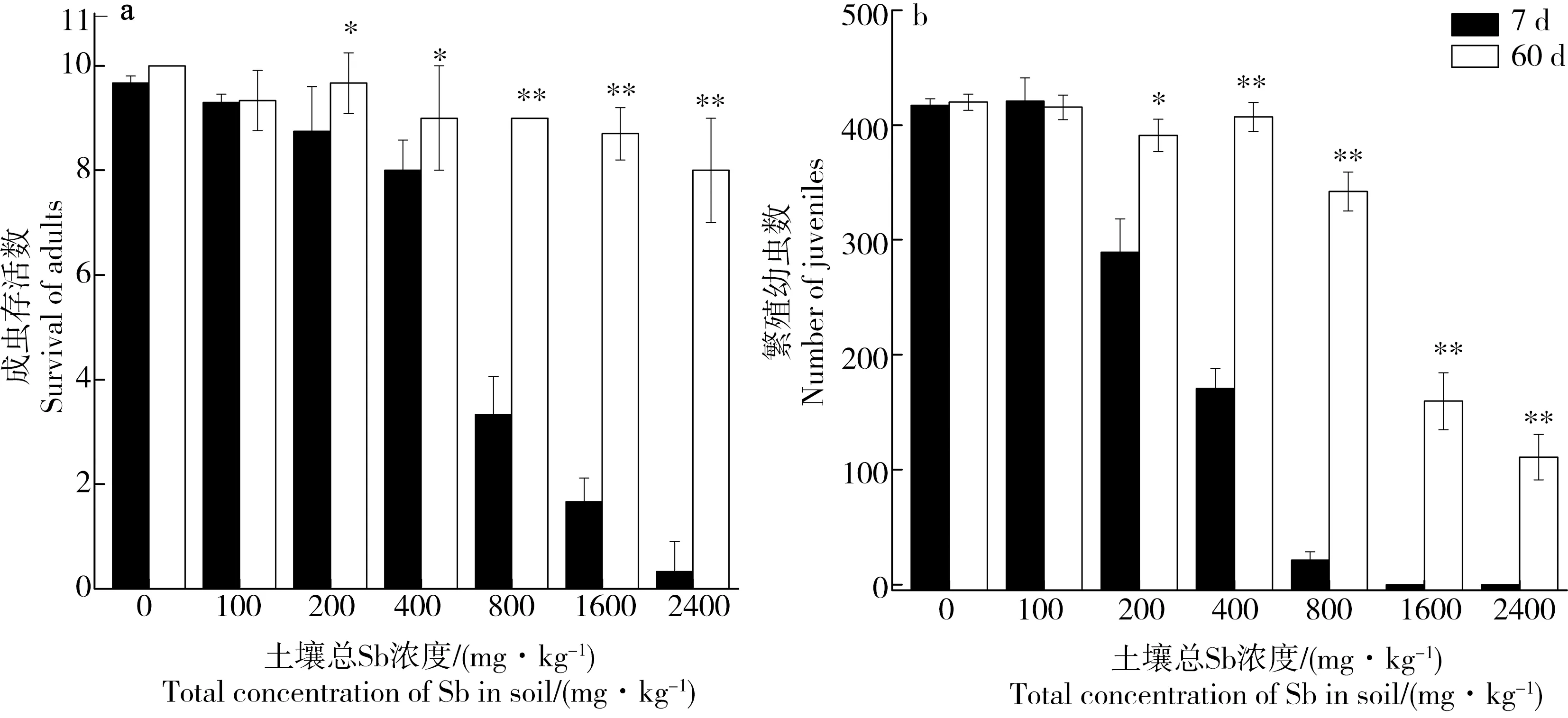
图4 土壤Sb对跳虫慢性存活毒性(a)和繁殖毒性(b)随老化时间的变化Fig. 4 The effects of different aging time on chronic toxicity of Sb to Folsomia candida in soil
作为变价类金属,Sb进入土壤后被吸附的同时,还发生着价态的转变。本研究表明土壤中外源添加的Sb(Ⅲ)很容易被氧化成Sb(Ⅴ),特别是Sb(Ⅲ)浓度较低时,短时间内就几乎全部发生了价态转化,虽然Sb(Ⅲ)浓度较高时,其初始氧化速率相对较慢,但在相对好氧的条件下,随着老化时间的推移,也逐步向Sb(Ⅴ)转化。土壤中Sb(Ⅲ)的氧化常见报道,Takaoka等[36]发现从冶炼厂释放出的Sb2O3进入土壤后转变成了Sb(Ⅴ)化合物,Oorts等[37]发现向淋溶土中外源添加Sb2O3仅2 d后土壤溶液中70%的Sb以Sb(Ⅴ)存在,Cai等[38]在吸附实验(受试物质为酒石酸锑钾)中发现低浓度的Sb(Ⅲ)在经过10 d反应后几乎都被氧化成Sb(Ⅴ),高浓度Sb(Ⅲ)的氧化却需要更多的时间。这是因为土壤有机质和铁锰铝化合物等矿物成分除了吸附结合Sb以外,还可促使Sb氧化作用的发生。Belzile等[39]发现暴露在空气中的Sb(Ⅲ)溶液在7 d内没有发生价态转化,然而在添加非晶质铁锰化合物后,短短几天即被氧化。Buschmann等[40]发现可溶性有机碳能很好地预测Sb的氧化速率。
本研究中随着老化时间的延长,Sb对跳虫存活和繁殖的毒性明显减弱。Bruus等[41]研究也发现土壤中铜未经老化时,影响跳虫繁殖的EC50为1 400 mg·kg-1,而当土壤老化后,铜浓度达到2 500 mg·kg-1时,对跳虫繁殖的影响与对照组相比亦无显著差异。Liu等[42]发现未老化的土壤中外源添加的镍对跳虫繁殖的EC50为1 064 mg·kg-1,而在田间条件下经过5 年老化后,镍浓度最高时跳虫繁殖的抑制率仍未达到50%。许多研究表明,老化作用主要通过降低土壤重金属生物有效态导致其生物有效性或毒性减弱[13-16,43],本研究慢性实验中跳虫成虫存活数、幼虫繁殖数的增加和土壤水溶态Sb浓度降低相一致,且两者之间呈现显著负相关,其相关系数分别为-0.864、-0.871(P<0.01)。这是因为跳虫除了经口摄入重金属外还主要通过接触土壤溶液中的重金属而产生暴露[44],在老化时间长的土壤中跳虫暴露的毒物的量大大减少。此外,Sb(Ⅲ)的毒性远高于Sb(Ⅴ)的,如何孟常等[45]发现Sb(Ⅲ)及Sb(Ⅴ)对水稻(OryzasativaL.)种子萌发、根系的生长及产量都能产生影响,若以产量下降10%作为水稻受害的“临界点”,则土壤中Sb(Ⅴ)的临界浓度约为300 mg·kg-1,而Sb(Ⅲ)的临界浓度为150 mg·kg-1。本研究慢性实验中跳虫成虫存活数、幼虫繁殖数和土壤Sb(Ⅴ)所占比例间呈现显著正相关,其相关系数分别为0.808、0.961(P<0.01),因此土壤Sb老化过程中毒性的减弱除了有效态浓度降低外,价态的转变也起着重要作用。
作为与砷(As)同一主族的元素,Sb与As有着很多相似的环境化学行为[21]。高雪等[46]发现外源As(Ⅲ)进入土壤后,不仅与土壤胶体发生吸附作用,也伴随着向As(Ⅴ)转化的过程,该过程在培养至约90 d 后基本完成。该研究还发现土壤pH 值、有机质、铁铝锰氧化物是影响外源As(Ⅲ)老化过程的重要因素。Yang等[47]研究也认为,外源As(Ⅲ)进入土壤后的老化过程同样受到铁氧化物含量、pH等因素的影响。本研究只关注了单一种类土壤中老化7 d和60 d后Sb有效态和毒性的变化,今后应研究土壤性质和更长老化时间对各形态Sb间转化和毒性的影响。
[1] He M C, Wang X Q, Wu F C. Antimony pollution in China [J]. Science of the Total Environment, 2012, 421-422:41-50
[2] Tschan M, Robinson B H, Schulin R. Antimony in the soil-plant system—A review [J]. Environmental Chemistry, 2009, 6: 106-115
[3] Okkenhaug G, Zhu Y G, Luo L, et al. Distribution, speciation and availability of antimony in soils and terrestrial plants from an active Sb mining area [J]. Environmental Pollution, 2011, 159(10): 2427-2434
[4] Antoine P, Muhammad S. Antimony bioavailability: Knowledge and research perspectives for sustainable agricultures [J]. Journal of Hazardous Materials, 2015, 289:219-234
[5] Li J N, Wei Y, Zhao L, et al. Bioaccessibility of antimony and arsenic in highly polluted soils of the mine area and health risk assessment associated with oral ingestion exposure [J]. Ecotoxicology and Environmental Safety, 2014, 110: 308-315
[6] Fu Z Y, Wu F C, Mo C L, et al. Comparison of arsenic and antimony biogeochemical behavior in water, soil and tailings from Xikuangshan, China [J]. Science of the Total Environment, 2016, 539: 97-104
[7] Gebel T. Arsenic and antimony: Comparative approach on mechanistic toxicology [J]. Chemical-Biological Interactions, 1997, 107(3): 131-144
[8] Filella M, Belzile N, Chen Y W. Antimony in the environment: A review focused on natural waters: I. Occurrence [J]. Earth-Science Reviews, 2002, 57(1-2): 125-176
[9] Feng R W, Wei C Y, Tu S, et al. The uptake and detoxification of antimony by plants: A review [J]. Environmental and Experimental Botany, 2013, 96: 28-34
[10] An Y J, Kim M. Effect of antimony on the microbial growth and the activities of soil enzymes [J]. Chemosphere, 2009, 74(5): 654-659
[11] Baek Y W, Lee W M, Jeong S W, et al. Ecological effects of soil antimony on the crop plant growth and earthworm activity [J]. Environmental Earth Sciences, 2014, 71(2):895-900
[12] 梁淑轩, 王凯, 耿梦娇, 等. 土壤中添加Sb(Ⅲ)对赤子爱胜蚓金属硫蛋白的影响[J]. 环境污染和保护科学学报, 2013, 2(2): 31-36
Liang S X, Wang K, Geng M J, et al. Effect of adding antimony pollution on metallothionein ofEiseniafetidain soil [J]. Scientific Journal of Environment Pollution and Protection, 2013, 2(2): 31-36 (in Chinese)
[13] Hamels F, Maleve J, Sonnet P, et al. Phytotoxicity of trace metals in spiked and field-contaminated soils: Linking extractable metals with toxicity [J]. Environmental Toxicology and Chemistry, 2014, 33(11): 2479-2487
[14] Erik S, Koen O, Sofie P, et al. Toxicity in lead salt spiked soils to plants, invertebrates and microbial processes: Unraveling effects of acidification, salt stress and ageing reactions [J]. Science of the Total Environment, 2015, 536:223-231
[15] Han F X, Banin A. Long-term transformation and redistribution of potentially toxic heavy metals in arid-zone soils: Ⅱ. Incubation at the field capacity moisture content [J]. Water, Air and Soil Pollution, 1999, 114(3-4): 221-250
[16] Ma Y B, Uren N C. Effect of aging on the availability of zinc added to a calcareous clay soil [J]. Nutrient Cycling in Agroecosystems, 2006, 76(1): 11-18
[17] 陈丽红, 刘征涛, 方征, 等. 老化土壤中铅对赤子爱胜蚓生长及繁殖的影响[J]. 环境科学, 2014, 35(4): 1486-1490
Chen L H, Liu Z T, Fang Z, et al. Effects of lead on the growth and reproduction ofEiseniafetidawith aged soils [J]. Environmental Science, 2014, 35(4): 1486-1490 (in Chinese)
[18] Donner E, Broos K, Heemsbergen D A, et al. Biological and chemical assessments of zinc ageing in field soils [J]. Environmental Pollution, 2010, 158(1): 339-345
[19] Koen L, Nadia W, Erik S, et al. Effect of leaching and aging on the bioavailability of lead to the springtailFolsomiacandid[J]. Environmental Toxicology and Chemistry, 2006, 25: 2006-2010
[20] Flynn H C, Meharg A A, Bowyer P K, et al. Antimony bioavailability in mine soils [J]. Environmental Pollution, 2003, 124(1): 93-124
[21] Wilson S C, Lockwood P V, Ashley P M, et al. The chemistry and behavior of antimony in the soil environment with comparisons to arsenic: A critical review [J]. Environmental Pollution, 2010, 158(5): 1169-1181
[22] 许杰, 柯欣, 宋静, 等. 弹尾目昆虫在土壤重金属污染生态风险评估中的应用[J]. 土壤学报, 2007, 44(3): 544-549
Xu J, Ke X, Song J, et al. A review of application of springtails in ecological risk assessment of metal contaminated soils [J]. Acta Pedologica Sinica, 2007, 44(3): 544-549(in Chinese)
[23] Fountain M T, Hopkin S P.Folsomiacandida(Collembola): A “standard” soil arthropod [J]. Annual Review of Entomology, 2005, 50(1): 201-222
[24] Frédérique G, Virgile C, Marie V M. Does antimony affect microbial respiration in Mediterranean soils? A microcosm experiment [J]. Pedobiologia, 2014, 57(2): 119-121
[25] International Organization for Standardization (ISO). Soil quality-inhibition of reproduction of Collembolan (Folsomiacandida) by soil pollutants [S]. Geneva: ISO, 2014
[26] Andressa C B, Júlia C N, Maria E F C, et al. Ecotoxicity of mercury toFolsomiacandidaandProisotomaminuta(Collembola: Isotomidae) in tropical soils: Baseline for ecological risk assessment [J]. Ecotoxicology and Environmental Safety, 2016, 127: 22-29
[27] 鲍士旦. 土壤农化分析[M]. 北京: 中国农业出版社, 2008: 25-200
[28] Pleysier J L, Juo A S R. A single-extraction method using silver-thiourea for measuring exchangeable cations and effective CEC in soils with variable charges [J]. Soil Science, 1980, 129(4): 205-211
[29] Zhang S Z, Shan X Q. The determination of rare earth elements in soil by inductively coupled plasma mass spectrometry [J]. Atomic Spectroscopy, 1997, 18(5): 140-144
[30] Vojtech E, Martin M. Antimony availability in highly polluted soils and Sediments-A comparison of single extractions [J]. Chemosphere, 2007, 68(3): 455-463
[31] 和秋红, 曾希柏, 李莲芳, 等. 好气条件下不同形态外源砷在土壤中的转化[J]. 应用生态学报, 2010, 21(12): 3212-3216
He Q H, Zeng X B, Li L F, et al. Transformation of different exogenous arsenic forms in soil under aerobic condition [J]. Chinese Journal of Applied Ecology, 2010, 21(12): 3212-3216 (in Chinese)
[32] 秦德元, 刘霁欣, 张新智. 原子荧光形态分析仪在汞锑形态分析中的应用[J]. 现代科学仪器, 2009, 24(2): 74-77
Qin D Y, Liu J X, Zhang X Z. Application of speciation analysis for mercury and antimony by atomic fluorescence spectrometry speciation analyzer [J]. Modern Scientific Instruments, 2009, 24(2): 74-77 (in Chinese)
[33] Li J, Peng Q, Liang D L, et al. Effects of aging on the fraction distribution and bioavailability of selenium in three different soils [J]. Chemosphere, 2016, 144: 2351-2359
[34] Mitsunobu S, Takahashi Y, Terada Y, et al. Antimony(V) incorporation into synthetic ferrihydrite, goethite, and natural iron oxyhydroxides [J]. Environmental Science and Technology, 2010, 44(10): 3712-3718
[35] Tserenpil S H, Liu C Q. Study of antimony(Ⅲ) binding to soil humic acid from antimony smelting site [J]. Microchemistry, 2011, 98(1): 15-20
[36] Takaoka M, Fukutani S, Yamamoto T, et al. Determination of chemical form of antimony in contaminated soil around a smelter using X-ray absorption fine structure [J]. Analytical Sciences, 2005, 21(7): 769-773
[37] Oorts K, Smolders E, Degryse F, et al. Solubility and toxicity of antimony trioxide (Sb2O3) in soil [J]. Environmental Science and Technology, 2008, 42(12): 4378-4383
[38] Cai Y B, Mi Y T, Zhang H. Kinetic modeling of antimony(Ⅲ) oxidation and sorption in soils [J]. Journal of Hazardous Materials, 2016, 316: 102-109
[39] Belzile N, Chen Y W, Wang Z. Oxidation of antimony (Ⅲ) by amorphous iron and manganese oxyhydroxides [J]. Chemical Geology, 2001, 174(4): 379-387
[40] Buschmann J, Canonica S, Sigg L. Photoinduced oxidation of antimony(Ⅲ) in the presence of humic acid [J]. Environmental Science and Technology, 2005, 39(14): 5335-5341
[41] Bruus P M, Van G C. Toxicity of copper to the collembolanFolsomiafimetariain relation to the age of soil contamination [J]. Ecotoxicology and Environmental Safety, 2001, 49(1): 54-59
[42] Liu R Y, Li J, He J Z, et al. Different influences of field aging on nickel toxicity toFolsomiacandidain two types of soil [J]. Environmental Science and Pollution Research, 2015, 22(11): 8235-8241
[43] Schreck E, Foucault Y, Geret F, et al. Influence of soil ageing on bioavailability and ecotoxicity of lead carried by process waste metallic ultrafine particles [J]. Chemosphere, 2011, 85(10): 1555-1562
[44] Pedersen M B, Gestel C A M, Elmegaard N. Effects of copper on reproduction of two Collembolan species exposed through soil, food and water [J]. Environmental Toxicology and Chemistry, 2000, 19(10): 2579-2588
[45] He M C, Yang J R. Effects of different forms of antimony on rice during the period of germination and growth and antimony concentration in rice tissue [J]. Science of the Total Environment, 1999, 243-244: 149-155
[46] 高雪, 王亚男, 曾希柏, 等. 外源As(Ⅲ)在不同母质发育土壤中的老化过程[J]. 应用生态学报, 2016, 27(5):1453-1460
Gao X, Wang Y N, Zeng X B, et al. Aging process of arsenite (Ⅲ) in soils originated from different parent materials [J]. Chinese Journal of Applied Ecology, 2016, 27(5):1453-1460 (in Chinese)
[47] Yang J, Varnet M O, Basta P M, et al. Adsorption, oxidation and bioaccessibility of As(Ⅲ) in soils [J]. Environmental Science and Technology, 2007, 39(18): 7102-7110
