转基因作物对鱼类的生态毒理效应研究综述
2018-01-29董姗姗章嫡妮张振华于赐刚刘燕王长永
董姗姗,章嫡妮,张振华,于赐刚,刘燕,#,王长永,*
1. 环境保护部南京环境科学研究所,南京 210042 2. 环境保护生物安全重点实验室,南京 210042
转基因作物潜在的健康和环境风险一直以来颇受争议,外源基因的随机插入可能会影响转基因作物本身内源基因的表达,进而产生非预期效应,例如:改变作物中的大量元素、微量元素、抗营养因子或固有植物毒素的表达水平[1-2]。如果作为动物饲料的转基因作物发生了这些改变,可能会对动物的健康产生潜在影响,而且有研究发现转基因作物在加工成饲料后其中的外源蛋白会有一定量的残留,可能会诱导动物产生免疫应激反应[3],影响动物的生长发育、繁殖等[4]。
目前对转基因作物的饲用安全性评价多参照经典的生态毒理学评价方法,采用不同的饲喂时间、不同的剂量水平、不同的模式动物和毒性参数(表1)。Kuiper和Kleter[5]建议对于转基因作物饲用安全性全面深入的评估应该包括对外源蛋白的毒性、致敏性,外源基因的分子特征、非预期效应及其水平转移到其他物种的潜力等方面的评估。以往对转基因作物饲用安全性的研究中因转基因作物的品种、剂量水平、动物种类、实验持续时间、对照组的选择以及评价参数的不同,其结果会明显不同[6-13],这在一定程度上表明转基因作物饲用安全性评价的复杂性,需要个案分析。
鱼类是水体中主要生物之一,是水生脊椎动物的代表, 因其对水环境的物理、化学及生物变化比较敏感,已被广泛应用于指示水环境质量的变化。目前以鱼类为模式动物的生态毒理学研究主要是水体中农药、抗生素、重金属以及其他化学品等有毒物质的毒理效应,转基因作物对鱼类的安全性研究相对较少,国外在这方面的研究中较多使用的实验动物是大西洋鲑(Salmosalar)、虹鳟鱼(Oncorhynchusmykiss)和斑马鱼(Daniorerio)等[14]。常见的方法是配制含有一定剂量的转基因作物饲料给鱼喂食一段时间,评估鱼的健康状况。常见的毒性参数为鱼的生长率、死亡率、健康指数、脏器功能及发育、组织病理学指标、血液学指标、脏器组织中抗氧化酶活性及敏感蛋白的mRNA表达水平等。
随着集约化水产养殖业的发展,鱼用人工配合饲料的应用也日渐广泛,鱼粉的需求量激增,由于受全球性的酷渔滥捕及环境污染等影响,鱼粉的产量逐年下降,植物性来源诸如大豆和玉米在鱼饲料中的应用越来越普遍。自1996年转基因作物商业化种植以来,其产量相对于作物总产量的比例逐年增加。在2014年,转基因大豆、棉花、玉米和油菜的种植面积分别占比为82%、68%、30%和25%[15]。转基因作物是否与传统作物具有一样的营养成分,其中的外源基因及其表达蛋白是否会对鱼类生长、健康产生潜在风险逐渐成为鱼类养殖业关注的焦点。本文基于转基因作物作为鱼饲料原料对鱼类生态毒理学效应的研究现状,综述了转基因作物对鱼的生长表现、生理生化、脏器功能及发育、组织病理以及行为活动等方面的生态毒理学效应,分析了当前研究中存在的问题,并对今后的研究趋势进行了探讨。
1 转基因作物对鱼类的生态毒理效应(Ecotoxicological effects of genetically modified crops on fish)
目前以鱼类作为模式动物进行转基因作物饲用安全性评价的研究还比较少,而且这些研究选取的鱼的种类、评价的毒性参数、采用的转基因作物品种及其在饲料中的含量,以及实验持续的时间都有所不同,其结果也不尽相同。
1.1 对生长表现的影响
检测鱼的体重、体长、外形指数、特定增长率等生长指标是评价转基因作物生态毒理效应的基本手段。例如:Sissener等[8]通过喂食斑马鱼含有25%转基因大豆和20%转基因玉米的人工饲料,调查了斑马鱼的摄食量、体重、体长和特定增长率等生长指标,结果显示与非转基因玉米组相比,转基因玉米组斑马鱼体重显著偏高。Sanden等[6]用含有19%转Bt基因玉米的饲料喂食两代斑马鱼,研究发现转基因玉米组亲代斑马鱼的各项生长指标与非转基因玉米组相比没有显著差异,但转基因玉米组子代斑马鱼的体重、特定增长率和食物转化率都明显高于非转基因玉米组的,总体来看,喂食转基因玉米饲料的两代斑马鱼在生长表现上都好于喂食非转基因玉米饲料的,推测这可能与非转基因玉米中的伏马毒素B1和黄曲酶毒素B1的含量相对偏高有关。Hemre等[16]在对大西洋鲑喂食转基因玉米(MON810)饲料82 d的研究中发现,转基因玉米组的摄食量、生长率和最终体重与非转基因玉米组相比都显著偏低。Brown等[17]分别以2种抗除草剂转基因油菜(GT200和GT73)为饲料原料喂食虹鳟鱼,实验中设置5%~20%这4个剂量梯度,以非转基因亲本材料和不含油菜的饲料为对照,研究发现GT200转基因油菜组虹鳟的体重、食物转化率、蛋白效率比和蛋白沉积与非转基因组相比无显著差异,但CT73组虹鳟的体重增加值、食物转化率和蛋白效率比随着转基因油菜在饲料中含量的增加而减少,而且与非转基因亲本组相比CT73组虹鳟鱼身体中蛋白、水分及蛋白沉积增加,脂肪含量减少,推测可能由于转基因与非转基因油菜仔本身蛋白含量和溶解度的差异所导致。Chainark等[18]以虹鳟鱼幼鱼为模式动物,通过3个月的喂养试验评估转基因大豆对其生态毒理效应,在该研究中设置了15%和30%共2种剂量水平,结果显示虹鳟鱼的生长和摄食在转基因大豆和非转基因大豆组间没有显著差异。Li等[19]通过8周的喂养实验评估了4种转基因棉花对斑点叉尾鮰的生态毒理效应,实验中以非转基因亲本和商业化的饲料为对照,棉花籽在饲料中的含量均为20%,通过对斑点叉尾鮰的生长、存活、饲料转化率和鱼体的成分分析,结果显示Bollgard×Roundup Ready和BollgardⅡ×Roundup Ready组斑点叉尾鮰的蛋白含量与非转基因亲本相比显著偏低。

表1 转基因作物对鱼类的生态毒理学效应Table 1 Ecotoxicological effects of genetically modified (GM) crops on fish
1.2 对生理生化方面的影响
1.2.1 血液学
血液学参数已被广泛地用来评价鱼类的健康状况、营养状况及对环境的适应状况,是重要的生理、病理和毒理学指标[20]。研究显示饲料的配比、添加剂、传染病以及环境因子胁迫等都可能对鱼的血液参数产生影响[21-22]。在转基因作物对鱼类的生态毒理学研究中已有很多采用血液学指标来监测鱼体的生理变化。例如:Sagstad等[23]发现喂食转基因玉米的大西洋鲑血液中的粒细胞与非转基因玉米组的相比比例明显偏高,推测可能是转Bt基因玉米引起了与细胞应激反应相关的免疫反应变化。Jørgensen[24]用含有19%抗虫转基因玉米的饲料喂食斑马鱼45 d,对白细胞的数量检测发现转基因玉米组与其非转基因近等系对照组间没有显著差异。血液指标的改变在一定程度上指示了生物机体的功能变化,通过检测血浆中营养素和酶的含量可以对鱼进行健康筛查,比较不同实验组间的营养水平。一项用分别含有15%和30%的转基因大豆的饲料喂食大西洋鲑28 d的研究发现,转基因大豆组大西洋鲑血浆甘油三酯水平与非转基因大豆组相比显著偏低,推测可能是由于2种大豆中皂苷水平的差异所导致[25]。Sanden等[26]喂食幼年大西洋鲑含有抗除草剂转基因大豆的饲料8个月,结果也发现转基因大豆组的大西洋鲑与常规大豆组相比血浆甘油三酯显著偏低。同样一项用含有转基因大豆的饲料喂食大西洋鲑7个月的研究显示,大西洋鲑血浆中的血糖和蛋白质含量在转基因和非转基因大豆组间没有显著差异,但转基因大豆组血浆甘油三酯浓度相对于非转基因大豆组偏高,与前人的研究结果刚好相反,这种差异表明很有可能不是转基因的效应引起的,而与不同品种大豆中的抗营养因子、抗原、代谢产物或者其他未知因素的差异有关[27]。丙氨酸转氨酶(ALAT)和天冬氨酸转氨酶(ASAT)主要存在于动物肝脏、心脏和骨骼肌组织细胞内,当细胞膜完整时它们在血浆中的含量较低,当组织细胞受到损伤或坏死时血浆中的含量升高,血浆中ALAT和ASAT的含量可以作为诊断鱼肝脏和肾脏疾病的指标。例如:通过对不同饲料组大西洋鲑血浆中ALAT和ASAT含量的检测,比较研究转基因大豆对大西洋鲑脏器的影响[26]。
1.2.2 敏感基因和蛋白
分子生物标志物直接反映外界因素与细胞靶分子,特别是生物大分子如核酸和蛋白质的相互作用及其后果,具有较高的敏感性。目前,在转基因作物对鱼类生态毒理效应研究中应用较多的分子指标主要是与免疫应激反应相关的热休克蛋白、抗氧化酶及其mRNA转录水平。
热休克蛋白(HSPs)是一类在遗传上高度保守的分子,能保护细胞并促进细胞对各种刺激所造成的损伤进行自身修复,具有重要的生物学功能。在不受胁迫的细胞中它们能够维持蛋白质的稳态,参与细胞内新合成蛋白质的折叠、加工和转运;在有胁迫因子存在的情况下HSPs会被诱导合成,保护细胞免受损伤。研究显示鱼肝脏中的热休克蛋白似乎对外界环境的刺激更加敏感[28]。例如:Sagstad等[23]等发现喂食大西洋鲑转基因玉米饲料82 d,其肝脏中的HSP70蛋白含量与鱼粉对照组相比显著偏高,而非转基因玉米组的处于中间水平,HSP70的mRNA转录水平在各组间没有显著差异。Sissener等[8]通过20 d的喂养实验,调查了抗虫转基因玉米对斑马鱼肝脏中HSP70 mRNA转录水平的影响,结果显示非转基因组斑马鱼肝脏中的HSP70 mRNA转录水平比转基因玉米组的高出6.5倍,尽管统计上不显著。
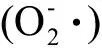
1.3 对脏器功能及发育的影响
脏器系数是毒理实验中常用的检测指标,脏器系数的变化可以在一定程度上反映动物脏器的受损情况,为我们比较实验组与对照组间的差异提供线索。已有大量研究通过调查鱼的肝脏、脾脏、肾脏或肠道等脏器系数及脏器功能,监测转基因作物对鱼类的生态毒理效应[4,25,27,35]。例如,Sagstad等[25]和Hemre等[36]在用抗除草剂转基因大豆配制的饲料喂食大西洋鲑时都发现,转基因大豆组的大西洋鲑脾脏系数相对于非转基因大豆组的显著偏高,推测可能与白细胞的激活和增殖有关,这是机体在受到外界抗原刺激后普遍的免疫反应。在一项同样是喂食大西洋鲑转基因大豆饲料的研究中,对大西洋鲑的脏器系数和功能检测发现转基因组与非转基因组的脾脏系数相似,但转基因大豆组的中肠系数与非转基因对照组相比显著偏低[27]。
肠道是营养物质消化吸收的重要器官,在转基因作物对鱼类的生态毒理学研究中,通常会把肠道中的消化酶活性作为监测指标之一。Bakke-McKellep等[35]用含有抗除草剂转基因大豆的饲料对大西洋鲑幼鱼进行8个月的喂养实验,对不同肠道片段中的消化酶活性、活性葡萄糖摄取和钠-葡萄糖共转运蛋白1(SGLT1)水平的检测结果显示,转基因大豆组大西洋鲑幽门垂中的葡萄糖转运率和SGLT1蛋白水平显著偏高,非转基因大豆组的处于中间水平,而鱼粉组的最低。与非转基因大豆组相比,转基因大豆组大西洋鲑幽门垂中的麦芽糖酶活性明显偏低。一项用分别含有15%和30%转Bt基因玉米(MON810)的饲料喂食大西洋鲑的研究发现,转基因玉米组大西洋鲑中肠片段的麦芽糖酶活性显著偏高,幽门垂中的葡萄糖摄取量也显著偏高[16]。Gu等[37]通过99 d的喂养实验调查了转Bt基因玉米(MON810)对大西洋鲑消化功能的效应,结果显示转基因组大西洋鲑肠道中亮氨酸氨基肽酶和麦芽糖酶活性显著降低,而且肠道中的胆汁盐浓度也明显偏低,该研究表明转基因玉米中的Cry1Ab蛋白或其他成分上的差异可能会引起大西洋鲑幼鱼肠道反应的变化。
1.4 对组织病理学指标的影响
组织病理参数是生态毒理学研究中的重要指标之一,目前在转基因作物的饲用安全性评价中也已广泛应用。Sissener等[7]对喂食了7个月转基因大豆饲料的大西洋鲑的脾、头肾和中肠的组织形态检测发现,转基因大豆组与非转基因大豆组大西洋鲑的组织形态没有明显差异,但两组的所有样本都出现了肠道炎症,推测这可能与饲料中的大豆含量水平有关。在一项以幼年大西洋鲑为实验动物,以含有12.5%抗除草剂转基因大豆的饲料为实验组,以商业化的非转基因大豆和鱼粉饲料为对照组,喂食8个月的研究显示2种大豆组大西洋鲑的肠道、脾脏、肝脏、心脏和脑的脏器系数没有显著差异,在对肠道的进一步研究中发现,非转基因大豆组肠道组织中增殖细胞核抗原(PCNA)阳性细胞增加,而且与鱼粉组相比,2种大豆组都明显提高,这可能是大豆中的抗营养因子诱导的炎症反应引起的,各组肠道中的溶菌酶水平和免疫球蛋白M没有显著差异[38]。在对喂食了转基因玉米饲料的子一代斑马鱼的近端小肠和中肠组织病理的研究中发现,转基因玉米组和非转基因玉米组都有个别样本的肠道形态发生了轻微变化,而且转基因玉米组有一个样本的中肠出现了轻微炎症,但总体来看,两组肠道样本的组织病理没有显著差异[6]。
1.5 对行为活动的影响
行为参数主要反映较低生物水平的影响,包括环境激素物质、有毒有害的有机与无机物、环境因素变化等引起的生物生理习性、健康状态异常变化,从而确定其中的相关关系。已有研究发现鱼在卵黄囊时期活动的增加可能会影响其进一步的生长发育[39],在转基因作物对鱼类的饲用安全性研究中大多是通过监测鱼的游动情况来评估转基因作物的生态毒理效应。例如:Sanden等[6]在研究转Bt基因玉米对两代斑马鱼的效应时,采用ZebraLab斑马鱼行为学分析系统监测孵化出4 d的子一代斑马鱼的游动轨迹,通过高分辨率数字红外相机捕捉斑马鱼在特定区域的游动时间,结果发现转基因组与非转基因组斑马鱼在高度活跃区域的时间相似,转Bt基因玉米对斑马鱼幼鱼的游动情况没有显著影响。
从以上研究可以看出,转基因作物作为饲料成分对鱼类的生态毒理效应研究缺乏重复性,针对不同的实验动物、设置不同的饲料配比或者采取不同的喂养时间其实验结果不同,甚至可能是相反的,这表明在这些研究中所检测到的效应很有可能不是转基因及其表达蛋白所引起的,但有可能与转基因的非预期效应有关,因为转基因可能导致作物中的抗营养因子水平、抗原、代谢产物或者其他不确定因素的变化。目前,转基因作物对鱼类的生态毒理效应研究中,已调查了大量的与鱼类生长表现、生理生化、脏器功能及发育、组织病理以及行为活动等相关的参数指标,总体来看转基因的效应很小,只要在合理含量范围内转基因作物与传统作物一样适合作为饲料来源。
2 存在的问题(Problems)
(1)实验动物的选择:目前在转基因作物对鱼类的生态毒理效应研究中应用的最广泛的实验动物是大西洋鲑,此外还有斑点叉尾鮰、虹鳟和斑马鱼等。但是对于某些种类的鱼,特别是像大西洋鲑这种肉食性鱼类,对某些植物成分非常敏感(例如:大豆中的抗营养因子),用其作为转基因作物饲用安全评估的实验动物颇有争议,因此,针对同种转基因作物选用不同的实验动物进行广泛的评估是有必要的。
(2)转基因效应的确定:在转基因作物对鱼类的饲用安全性研究中,尽管可以保证不同饲料组在饲料配比上是一致的,但是并不是饲料中的所有成分都会被分析,日粮成分上的某些差异是很难平衡的,例如植物雌激素或者皂苷等抗性因子的差异,或者是霉菌毒素、除草剂等农药残留的差异。在实验中检测到的不同饲料组在某些响应参数上的差异,很大程度上还很难确定是否是转基因的效应引起的。而且这些差异通常都是孤立的,缺乏重复性的,差异的大小是否具有重要的生物学意义还需要进一步的跟踪研究。
(3)响应参数的选择:转基因作物的饲用安全评价不仅需要调查鱼的生存、生长、繁殖等一般性指标,还应该包括能够评估鱼的健康水平以及对饮食的不良反应进行早期监测的敏感指标。但并不是检测的响应参数越多越能反应转基因的效应,当许多不同的参数被检测时,其中某几个参数很有可能会出现显著差异,这些差异往往很难解释,而真正的效应可能由于实验设计等原因没有被检测出来。因此,选择合适的响应参数来监测转基因作物对鱼类的生长、繁殖和健康的影响,是转基因作物生态毒理学效应研究中的关键。
(4)对照组的选择:在大多数研究中,会选用与转基因作物在相同条件下种植的非转基因近等基因系作为对照,但是转基因与非转基因亲本在组成成分及营养水平上的差异仍不可避免。在对照组的选择上,存在的主要问题是如何解释与对照组在某些参数上的差异,如何区分这种差异是由转基因蛋白还是转基因的非预期效应造成的,或者还是由于种植季节或地点的变化造成的随机差异。针对这些问题,在实验中选择几个商业化的非转基因作物作为对照对于转基因作物的安全性评估可能会更加全面和准确。
3 研究展望(Prospects)
目前,植物中哪种抗营养因子或成分及其在何种水平上会对鱼的生长、健康产生不利影响,这方面的信息还比较匮乏。而且某些抗性因子间的相互作用会影响其抗性水平,使得更难预测对鱼的效应。通过对转基因作物与非转基因作物内在成分(例如:抗性因子、霉菌毒素或农药残留等)差异的分析,可能会在一定程度上解释不同饲料组间的反应差异,或者至少可以说明这些差异是转基因的效应还是其他因素所导致的。此外,对于作物和饲料中转基因及其表达蛋白的定量检测也有助于区分转基因的预期与非预期效应。采用非靶向性的筛选方法(如:基因芯片和蛋白质组学)分析转基因作物在鱼的靶标器官中的非预期效应也将在转基因作物生态毒理学研究中发挥重要作用。
[1] Cellini F, Chesson A, Colquhoun I, et al. Unintended effects and their detection in genetically modified crops [J]. Food & Chemical Toxicology, 2004, 42(7): 1089-1125
[2] Somers D A, Makarevitch I. Transgene integration in plants: Poking or patching holes in promiscuous genomes? [J]. Current Opinion in Biotechnology, 2004, 15(2): 126-131
[3] Prescott V E, Campbell P M, Moore A, et al. Transgenic expression of bean α-amylase inhibitor in peas results in altered structure and immunogenicity [J]. Journal of Agricultural and Food Chemistry, 2005, 53(23): 9023-9030
[4] Frøystad-Saugen M K, Lilleeng E, Bakke-Mckellep A M, et al. Distal intestinal gene expression in Atlantic salmon (Salmosalar, L.) fed genetically modified maize [J]. Aquaculture Nutrition, 2009, 15(1): 104-115
[5] Kuiper H A, Kleter G A. The scientific basis for risk assessment and regulation of genetically modified foods [J]. Trends in Food Science & Technology, 2003, 14(5-8): 277-293
[6] Sanden M, Ornsrud R, Sissener N H, et al. Cross-generational feeding of Bt (Bacillusthuringiensis)-maize to zebrafish (Daniorerio) showed no adverse effects on the parental or offspring generations [J]. British Journal of Nutrition, 2013, 110(12): 1-12
[7] Sissener N H, Bakke A M, Gu J, et al. An assessment of organ and intestinal histomorphology and cellular stress response in Atlantic salmon (Salmosalar, L.) fed genetically modified Roundup Ready®soy [J]. Aquaculture, 2009, 298(1-2): 101-110
[8] Sissener N H, Johannessen L E, Hevrøy E M, et al. Zebrafish (Daniorerio) as a model for investigating the safety of GM feed ingredients (soya and maize); performance, stress response and uptake of dietary DNA sequences [J]. British Journal of Nutrition, 2010, 103(1): 3-15
[9] Gu J, Krogdahl Å, Sissener N H, et al. Effects of oral Bt-maize (MON810) exposure on growth and health parameters in normal and sensitised Atlantic salmon,SalmosalarL. [J]. British Journal of Nutrition, 2012, 109(8): 1-16
[10] Zhu Y, He X, Luo Y, et al. A 90-day feeding study of glyphosate-tolerant maize with theG2-aroAgene in Sprague-Dawley rats [J]. Food & Chemical Toxicology, 2013, 51(1): 280-287
[11] Xing H Z, Ying D, Xiang X, et al. A 90-day toxicology study of high-amylose transgenic rice grain in Sprague-Dawley rats [J]. Food & Chemical Toxicology, 2011, 49(12): 3112-3118
[12] Herouet-Guicheney C, Rouquié D, Freyssinet M, et al. Safety evaluation of the double mutant 5-enol pyruvylshikimate-3-phosphate synthase (2mEPSPS) from maize that confers tolerance to glyphosate herbicide in transgenic plants [J]. Regulatory Toxicology & Pharmacology, 2009, 54(2): 143-153
[13] Finamore A, Roselli M, Britti S, et al. Intestinal and peripheral immune response to MON810 maize ingestion in weaning and old mice [J]. Journal of Agricultural & Food Chemistry, 2008, 56(23): 11533-11539
[14] Sissener N H, Sanden M, Krogdahl Å, et al. Genetically modified plants as fish feed ingredients [J]. Canadian Journal of Fisheries & Aquatic Sciences, 2011, 68(3): 563-574
[15] James C. Global status of commercialized biotech/GM crops: 2015 [R]. New York: International Service for the Acquisition of Agri-biotech Applications (ISAAA), 2015: 46
[16] Hemre G I, Sagstad A, Bakke-Mckellep A M, et al. Nutritional, physiological, and histological responses in Atlantic salmon,Salmosalar, L. fed diets with genetically modified maize [J]. FEMS Yeast Research, 2007, 13(3): 186-199
[17] Brown P B, Wilson K A, Jonker Y, et al. Glyphosate tolerant canola meal is equivalent to the parental line in diets fed to rainbow trout [J]. Journal of Agricultural and Food Chemistry, 2003, 51(15): 4268-4272
[18] Chainark P, Satoh S, Hino T, et al. Availability of genetically modified soybean meal in rainbow troutOncorhynchusmykissdiets [J]. Fisheries Science, 2006, 72(5): 1072-1078
[19] Li M H, Hartnell G F, Robinson E H, et al. Evaluation of cottonseed meal derived from genetically modified cotton as feed ingredients for channel catfish,Ictaluruspunctatus[J]. Aquaculture Nutrition, 2008, 14(6): 490-498
[20] Sissener N H. Genetically modified plants as fish feed ingredients. Roundup Ready®soy, MON810 maize, Atlantic salmon, zebrafish [D]. Bergen: The University of Bergen, 2009: 1-84
[21] Hemre G I, Sandnes K, Waagbø R. Blood chemistry and organ nutrient composition in Atlantic salmon,SalmosalarL., fed graded amounts of wheat starch [J]. Aquaculture Nutrition, 1995, 1(1): 37-42
[23] Sagstad A, Sanden M, Haugland Ø, et al. Evaluation of stress- and immune-response biomarkers in Atlantic salmon,Salmosalar, L. fed different levels of genetically modified maize (Bt maize), compared with its near-isogenic parental line and a commercial suprex maize [J]. Journal of Fish Diseases, 2007, 30(4): 201-212
[24] Jørgensen S. Evaluating primary (cry1Ab) and secondary effects (deoxynivalenol) of GM maize when fed to zebrafish (Daniorerio). Investigating growth, intestinal mRNA and white blood cell differentiation [D]. Bergen: The University of Bergen, 2012: 1-62
[25] Sagstad A, Sanden M, Krogdahl Å, et al. Organs development, gene expression and health of Atlantic salmon (Salmosalar, L.) fed genetically modified soybeans compared to the near-isogenic non-modified parental line [J]. Aquaculture Nutrition, 2008, 14(6): 556-572
[26] Sanden M, Krogdahl Å, Bakke-Mckellep A M, et al. Growth performance and organ development in Atlantic salmon,Salmosalar, L. parr fed genetically modified (GM) soybean and maize [J]. Aquaculture Nutrition, 2006, 1(1): 1-14
[27] Sissener N H, Sanden M, Bakke A M, et al. A long term trial with Atlantic salmon (Salmosalar, L.) fed genetically modified soy; focusing general health and performance before, during and after the parr-smolt transformation [J]. Aquaculture, 2009, 294(1-2): 108-117
[28] Iwama G K, Vijayan M M, Forsyth R B, et al. Heat shock proteins and physiological stress in fish [J]. Integrative & Comparative Biology, 1999, 39(6): 901-909
[29] Papst C, Utz H F, Melchinger A E, et al. Mycotoxins produced byFusariumspp. in isogenic Bt vs. non-Bt maize hybrids under European corn borer pressure [J]. Agronomy Journal, 2005, 97(1): 219-224
[30] Bakan B, Melcion D, Richard-Molard D, et al. Fungal growth and fusarium mycotoxin content in isogenic traditional maize and genetically modified maize grown in France and Spain [J]. Journal of Agricultural & Food Chemistry, 2002, 50(4): 728-731
[31] Kaushik S J, Cravedi J P, Lalles J P, et al. Partial or total replacement of fish meal by soybean protein on growth, protein utilization, potential estrogenic or antigenic effects, cholesterolemia and flesh quality in rainbow trout,Oncorhynchusmykiss[J]. Aquaculture, 1995, 133(3-4): 257-274
[32] Kelly A M, Green C C. Binding affinities of hepatic nuclear estrogen receptors for genistein in channel catfish [J]. North American Journal of Aquaculture, 2006, 68(2): 160-167
[33] Bennetau-Pelissero C, Breton B, Bennetau B, et al. Effect of genistein-enriched diets on the endocrine process of gametogenesis and on reproduction efficiency of the rainbow troutOncorhynchusmykiss[J]. General and Comparative Endocrinology, 2001, 121(2): 173-187
[34] Duke S O, Rimando A M, Pace P F, et al. Isoflavone, glyphosate, and aminomethylphosphonic acid levels in seeds of glyphosate-treated, glyphosate-resistant soybean [J]. Journal of Agricultural and Food Chemistry, 2003, 51(1): 340-344
[35] Bakke-Mckellep A M, Sanden M, Danieli A, et al. Atlantic salmon (Salmosalar, L.) parr fed genetically modified soybeans and maize: Histological, digestive, metabolic, and immunological investigations [J]. Research in Veterinary Science, 2008, 84(3): 395-408
[36] Hemre G I, Sanden M, Bakke-Mckellep A M, et al. Growth, feed utilization and health of Atlantic salmonSalmosalarL. fed genetically modified compared to non-modified commercial hybrid soybeans [J]. Aquaculture Nutrition, 2005, 11(3): 157-167
[37] Gu J, Bakke A M, Valen E C, et al. Bt-maize (MON810) and non-GM soybean meal in diets for atlantic salmon (SalmosalarL.) juveniles—Impact on survival, growth performance, development, digestive function, and transcriptional expression of intestinal immune and stress responses [J]. PloS One, 2014, 9(6): e99932
[38] Sanden M, Berntssen M H G, Krogdahl Å, et al. An examination of the intestinal tract of Atlantic salmon,Salmosalar, L. parr fed different varieties of soy and maize [J]. Journal of Fish Diseases, 2005, 28(6): 317-330
[39] Penglase S J, Hamre K, Ellingsen S. Selenium nutrition in zebrafish (Daniorerio) [C]. Bergen City: 3rd Zebrafish Network Norway Meeting, 2011: 3-6
