干燥综合征涎腺病变的影像学研究进展
2018-01-27杨芦莎王志刚张群霞
杨芦莎 王志刚 张群霞
干燥综合征(Sjögren's syndrome,SS)又称自身免疫性外分泌病,是主要累及外分泌腺的慢性自身免疫病,以泪腺、唾液腺受损最常见,发病率为0.1%~3.0%,男女比例为1∶20~1∶9[1]。SS临床表现多样且复杂,口眼干燥是其早期的典型特征。患者随病情发展可出现肺间质纤维化、原发性胆汁性胆管炎、肾小管酸中毒等其他腺外器官病变,其淋巴瘤发生率亦显著高于正常人群。
SS的病因和发病机制尚不明确,感染、遗传、内分泌等多种因素共同参与了本病的发生和发展。目前公认的诊断标准为2002年美国-欧洲联盟(American-European Consensus Group,AECG)发布的SS国际分类(诊断)标准[2]。该标准含口干燥症、眼部体征及实验、唇腺活检、唾液腺功能检测和自身抗体6个项目,并根据是否合并类风湿关节炎(rheumatoid arthritis,RA)、系统性红斑狼疮(systemic lupus erythrmatosus,SLE)等其他结缔组织病细分为原发性干燥综合征(primary Sjögren's syndrome,PSS)和继发性干燥综合征(secondary Sjögen's syndrome,SSS)。SS的病理基础为淋巴细胞浸润外分泌腺体。活检发现淋巴细胞灶对诊断SS具有重要意义;但活检易受取材影响,且疾病早期淋巴细胞无明显浸润,故可造成漏诊[3]。唾液流率、腮腺造影、唾液腺显像(salivary gland scintigraphy,SGS)为常用的腺体功能检查。其中唾液流率由于临床标准不一现已较少采用;后2项因良好的诊断性能已纳入AECG标准。
近年来随着影像学技术的快速发展以及对SS更深入的认识,CT、MRI、US等检查也逐步用于涎腺病变的客观评估。本文就5种常用影像学检查对SS的临床价值进行综述。
1 腮腺造影
经腮腺导管口注入造影剂后摄取充盈相、排空相X片,可清楚地显示导管系统、腺体大体结构及排泄速度的改变。SS患者腮腺造影主要表现为排空时间延迟、末梢导管扩张,尤以末梢导管扩张最具特征,但部分慢性腮腺炎也可表现为末梢导管扩张[4],因此判读结果有赖于阅片者的临床经验;此外,正常人和SS患者完全排空时间尚无明确报道,主导管受累程度与年龄是否相关有待进一步研究;更重要的是,该项检查存在辐射损伤,操作过程及检查后患者均感痛苦,对造影剂过敏者无法接受该项检查,因而受到一定的限制。
2 SGS
99TcmO4-可被导管上皮细胞摄取聚于腺体内,受刺激后,随腺泡细胞分泌的唾液一同排入口腔,其浓聚分泌的多少、快慢与腺体功能相关。正常腺体为两侧对称显影,放射性分布均匀、浓度逐渐增加、轮廓逐渐清晰。酸刺激后,唾液分泌加速,放射性迅速下降,轮廓缩小,而口腔内放射性分布急剧增加。研究显示,SS患者腺体放射性分布显著减少[4](图1)。酸刺激后,放射性下降速度降低,口腔内放射性浓度增加减慢,其诊断SS的准确性(91.5%)高于腮腺造影(83.1%),且无侵入性操作,更易被接受;但易受观察者的主观干扰。为尽量避免主观性,国内外学者开始探讨SGS定量分析在SS中的价值。Infante等[5]发现SS患者排泄分数(ejection fraction,EF)、摄取率(uptake ratio,UR)、摄取百分比(percentage uptake,PC)等功能参数显著低于正常人群。Aksoy等[6]进一步发现腺体病变越重,EF越低,表明定量参数可提示病情轻重。Wu等[7]认为定量分析还能对SS、慢性阻塞性腮腺炎、涎石症等涎腺疾病进行鉴别,即SS患者UR、EF均明显降低,而后两者仅出现EF降低。
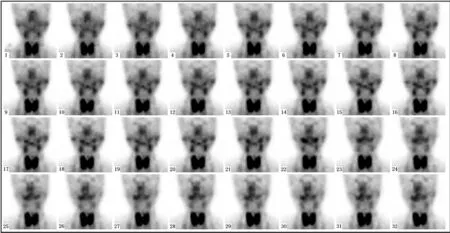
图1 女,54岁,SS。唾液腺显像(以1 min/帧连续采集40 min)示腺体显影欠清晰,轮廓较模糊,放射性分布显著减少且明显低于甲状腺
SGS可显示解剖形态、反映功能改变、提示病情程度,但具有辐射,且设备要求高,在基层医院难以开展;而且其定量分析方法与标准尚未统一,有待深入研究。
3 CT
3.1 平扫CT 正常腺体为均匀低密度脂肪影。丁长伟等[8]发现腮腺密度不均、脂肪异常沉积、弥漫性点状钙化为SS患者特有的征象;且涎石症、慢性腮腺炎、肿瘤表现为单侧、单发的钙化,明显不同于SS的双侧弥漫性钙化,提示CT可用于诊断SS。Sun等[9]将脂肪沉积面积分为0~IV级,结果显示脂肪沉积与功能受损程度呈正相关,表明CT可提示病变及功能受损程度。
3.2 CT造影 CT造影原理与腮腺造影一致,区别为利用后处理重建可显示导管的形态、走行甚至腺泡充盈功能,弥补了传统腮腺造影仅显示形态的不足。SS表现为腮腺实质内见造影剂弥漫性或斑块性融合充填。白杨等[10]以此为阳性标准,对80例确诊患者行CT造影,诊断SS阳性70例,敏感度为87.5%,特异度为96.0%。
尽管CT能清晰显示导管形态、走行,但该项检查同样存在辐射,无法用于碘过敏者和急性感染者,且相关研究较少,对SS的诊断价值还需进一步验证。
4 MRI
4.1 常规MRI 既往研究显示,SS患者MRI表现为腺体信号不均匀, T1WI和T2WI上均见弥漫分布的高信号,抑脂T2WI上呈低信号[11-12]。SS出现上述影像学表现缘于淋巴细胞沿导管周围浸润,导管上皮细胞增生引起阻塞,造成腺泡萎缩、纤维化和导管扩张,随后腺泡萎缩加重,由脂肪组织替代,故而出现MRI信号不均及脂肪信号弥漫分布。SS的病理发展提示腺体内脂肪沉积与病程有关。Yokosawa等[13]采用T1WI和短时反转恢复序列对脂肪信号进行分级,并分析其与唇腺活检分级的相关性,结果显示两者显著相关,表明MRI能反映病情。
4.2 腮腺导管MR成像(MR sialography,MRS) SS患者导管受损,排空功能降低,唾液积聚于导管内;而唾液具有长T2弛豫时间,故采用特殊加权(长TE、重T2WI)可突出其信号。MRS即利用此原理使导管显影。韦洁勤等[14]发现SS患者MRS表现为类似于腮腺造影的末梢导管扩张,且MRS诊断准确率高于腮腺造影,与CT造影相当;但MRS无辐射,无需注入造影剂,避免了外力试压,导管呈自然充盈状态,能更客观地反映导管实际情况。丁长伟等[12]以末梢导管扩张为阳性标准诊断SS,结果显示诊断特异性理想,但敏感性低于常规MRI(71.4%比95.2%),原因为病变晚期末梢导管萎陷,导管内唾液无明显积聚,此时MRS出现假阴性结果。Ren等[15]联合MRS与常规MRI诊断SS,发现两者联合检出率高于单项检查,原因为MRS容易显示病变早期导管内积聚的唾液;而常规MRI容易显示病变晚期腺体内的脂肪沉积。故联合两者可提高检出率。
4.3 扩散加权成像(DWI) DWI能反映水分子在细胞内外的扩散运动,并通过测量表观扩散系数(ADC)值进行量化,已成为近年快速发展的功能成像技术。邢晓菲等[16]发现无论是正常人还是SS患者,酸刺激后腮腺ADC值均会随时间发生改变,表明DWI能反映腮腺的功能变化。陈志晔等[17]对8例正常人和8例常规MRI表现无异常的SS患者行腮腺DWI扫描并计算ADC值,结果示SS患者腮腺ADC值较正常人明显降低,提示DWI可先于常规MRI判断SS是否累及腮腺。Takahashi等[18]应用DWI技术评价SS患者治疗前后的腮腺,结果提示DWI可作为疗效评估的检查手段。
在SS诊断中,常规MRI多用于观察腺体病变,MRS主要观察导管病变,两者结合能减少漏诊;功能成像方面,尽管DWI能早于常规MRI提示SS,但 ADC值的测量受MR机型、场强及b值等因素影响。此外,MRI无法扫查体内置入金属异物者和密闭恐惧症者,故在临床应用中稍受限制。
5 超声
超声是发展最为迅速的影像学检查之一,因其安全无创、可实时显像、重复性高而得到普遍应用。常用模式包括高频超声、多普勒超声、超声造影(contrast-enhanced ultrasonography,CEUS)及超声弹性成像。
5.1 高频超声 运用于涎腺又称为涎腺超声(salivary gland ultrasonography,SGU)。腮腺、颌下腺位置表浅,易于探查,SGU显示理想;而舌下腺位置深在,不易探及。正常涎腺实质回声细密、均匀,因含脂肪成分,回声稍高于甲状腺及周围肌肉组织,导管一般不易显示。
1992年,De Vita等[19]指出SGU在SS诊断中具有潜在价值。该研究发现腺体回声不均匀是SS的特征性表现,并按不均匀程度、淋巴细胞浸润、融合形成的低回声结节大小提出0~4分超声评分法(SGU scoring system,SGUS)分别对4个腺体进行评分。0分:正常腺体,回声均匀(图2A);1分:轻度不均匀(图2B);2分:明显不均匀,低回声结节<2 mm(图 2C);3 分:低回声结节直径 2~6 mm(图 2D);4 分:低回声结节>6 mm(图2E)。取最高值为最终值,以≥2分为界诊断性能较好。但进行SGU评分时应除外同样表现为不均匀回声的急性腮腺炎。急性腮腺炎多有局部回声减低,SS多有淋巴细胞所形成的低回声结节,并可结合临床病史进行鉴别。近年来,国内外学者在0~4分SGUS基础上将评分 条 目 更 细致 化, 提 出 了 0~12分、0~16分、0~48分SGUS[20-21]。尽管文献报道其均有较好的敏感性和特异性,但因操作相对复杂、对操作者技术及经验要求高,且临界值存在争议而未像0~4分SGUS得到广泛引用。
随着对SGUS研究的不断深入,有学者认为简便、价廉的SGUS可作为常规检查用于SS的诊断。Cornec等[22]采用Logistic回归分析,对唾液流率、Schirmer试验、唇腺活检、自身抗体及SGUS进行赋值,总分12.5分,以≥5分为界,诊断敏感度为85.7%、特异度为94.9%,而欧美共识标准(American-European Consensus Group,AECG)诊断敏感度为77.9%、特异度为98.7%。可见SGUS的加入明显提高了SS的检出率,SGUS有望成为诊断SS的新检查手段。

图2 涎腺超声评分。A.女,54岁,正常人,腮腺实质回声均匀,超声评分0分;B.女,45岁,干眼症,腮腺实质回声轻度不均匀,超声评分1分;C.女,48岁,SS,腮腺实质回声明显不均匀,内见低回声结节(直径<2 mm),超声评分2分;D.女,27岁,SS,腮腺内见散在分布的低回声结节(直径2~6 mm),超声评分3分;E.女,67岁,SS,颌下腺内见直径>6 mm的低回声结节,超声评分4分
5.2 多普勒超声 彩色多普勒血流(CDFI)可实时反映血供情况。脉冲频谱多普勒(pulsed wave Doppler,PW)在CDFI显示理想下可测得收缩期峰值流速(peak systolic velocity,PSV)、舒张末期血流速度(end diastolic velocity,EDV)、供血动脉阻力指数(resistance index,RI),间接提示血管受累情况。
王依宁等[23]报道SS患者早期血流增多,PW无异常,中晚期血供丰富,PW示RI低于早期患者。其原因在于SS为慢性炎症,早期腺体仅轻度充血,PW可无明显变化。随病情发展,细胞因子相继产生,作用于末梢血管致其扩张则出现RI降低。田永梅等[24]发现酸刺激后,健康对照组PSV、EDV均较刺激前增高,RI相应降低;而SS组血流动力学参数较前无明显变化。其原因为SS患者腺体受损,供血动脉对外界刺激反应降低,故PW可提示腺体受损情况。
5.3 超声造影 经外周静脉快速注入微泡造影剂后再注射5 ml生理盐水,大量微泡便悬浮于血液中,血液与气体间的声阻抗差增加,微泡背向散射增强,相应部位回声也增强,与周围组织形成鲜明对比。与CDFI相比,CEUS可显示彩色增益无法代偿的微小血管,且无角度依赖性,能更精确地反映血流灌注情况。CEUS已广泛用于肝脏、乳腺、甲状腺相关疾病的鉴别诊断,但对涎腺疾病的诊断尚处于探索阶段。Giuseppetti等[25]发现无论是静息状态还是酸刺激后,SS组增强强度均明显低于非SS组;此外酸刺激后,PSS增强强度低于SSS;表明CEUS不仅能有效鉴别SS和非SS患者,还可进一步区分PSS和SSS。
5.4 超声弹性成像 组织受外力后将遵循物理规律产生响应(位移、应变、速度的改变),经数字信号或图像处理技术显示为超声图像,可间接或直接反映生物组织的弹性或硬度。其优势在于以非侵入性方式提供定性或定量的组织硬度指标,较触诊所获取的信息更客观、准确,目前已应用于肝脏、浅表器官的实验与临床研究中。常用的弹性成像方法包括实时组织弹性成像(real-time tissue elastograph,RTE)、声辐射力脉冲弹性成像(acoustic radiation force impulse,ARFI)和剪切波弹性成像(shear wave elastography,SWE)等。
5.4.1 RTE 外力来自操作者沿探头方向的纵向施压。不同组织弹性系数(组织抵抗外界压力而不变形的能力)不同造成受外力压迫后变形程度不同,因而可将受压前后回声信号移动幅度的变化转化为实时彩色图像。Knopf等[26]报道RTE诊断SS特异性较高(85.7%),能对常规超声进行补充。王健楠等[27]应用RTE测量腺体与相邻肌肉的应变率比值(strain ratio,SR),结果提示病例组SR值明显增高,且病变越重,SR值越高。
5.4.2 ARFI ARFI包括声触诊组织量(virtual tough tissues quantification,VTQ)和声触诊组织成像(virtual touch tissue imaging,VTI)两种技术,其中VTQ应用较多。ARFI的外力为探头发射的辐射压力,VTQ技术下组织会产生纵向压缩和横向振动,横向振动以剪切波的方式向周边传播,测量剪切波速度(shear wave velocity,SWV)可反映组织硬度大小。ARFI克服了RTE的主观性,操作更简便,可定量获取组织弹性值。
SS患者体内发生过度免疫反应,慢性炎症细胞增生、浸润外分泌腺体(淋巴细胞为主)。随病情进展,淋巴细胞聚集增多,腺体逐步遭到破坏,发生纤维化、萎缩改变。上述病理过程为ARFI在SS中的应用奠定了组织学基础。王婧玲等[28]研究显示VTQ能有效诊断SS,其中腮腺诊断SS的最佳SWV值为1.99 m/s,颌下腺的最佳SWV值为2.13 m/s(图3)。Chen等[29]将SGUS与VTQ相联合,结果示敏感性、特异性均显著提高,分别达到98%和90%,原因在于SS早期淋巴细胞浸润少,回声改变不明显,此时虽SGUS正常,但腺体已出现纤维化,组织硬度增加,因而将两者结合可减少对早期SS的漏诊。Hofauer等[30]还发现SS患者治疗后,腺体硬度明显下降,表明弹性还能监测、评估治疗效果。

图3 ARFI成像图。A.女,48岁,SS,VTQ测量腮腺SWV值为2.13 m/s;B.女,67岁,SS,VTQ测量颌下腺SWV值为2.20 m/s
5.4.3 SWE SWE首先测量出剪切波在组织中的传播速度,再进一步换算成弹性模量值,同VTQ一样可定量反映组织硬度。其优点在于SWE可调节取样框大小,更精确地评估感兴趣区域的组织弹性。研究显示,涎腺组织硬度与年龄、性别、侧别无关,表明SWE可用于诊断涎腺病变[31]。Wierzbicka等[32]发现SS组腮腺硬度显著高于正常人,且SS与涎石症、腮腺管狭窄、慢性腮腺炎的腮腺弹性值存在明显差异(分别为111、82、63、48 kPa ),提示SWE不仅可有效诊断SS,还能对涎腺疾病进行鉴别,为临床提供更多信息。
对于SS,超声不仅能提供随炎症进展、发生过程中腺体大小、实质回声的改变,还可反映病变涎腺的血供情况及软硬程度,甚至提示病变轻重并反映疗效。
6 总结与展望
SS为多系统病变,临床表现无明显特异性,故明确诊断对其治疗及预后具有重要意义。随着对SS逐渐深入的认识及影像学技术的不断研究发展,影像诊断已凸显出明显的优势。腮腺造影、SGS、CT、MRI、US均具有较好的诊断敏感性和特异性,部分检查甚至还能提示病变程度及疗效。其中MRI、US因无辐射损伤、无介入操作,同时具备理想的诊断效能而受到更多应用。MRI能反映导管病变,US倾向于提示腺体病变,可相互进行补充,两者联合诊断SS是未来的发展方向。
[1]Maślińska M, Przygodzka M, Kwiatkowska B, et al. Sjögren's syndrome: still not fully understood disease. Rheumatol Int, 2015,35(2): 233-241.
[2]Vitali C, Bombardieri S, Jonsson R, et al. Classification criteria for Sjögren's syndrome: a revised version of the european criteria proposed by the american-european consensus group. Ann Rheum Dis, 2002, 61(6): 554-558.
[3]Carubbi F, Alunno A, Cipriani P, et al. A retrospective, multicenter study evaluating the prognostic value of minor salivary gland histology in a large cohort of patients with primary Sjögren's syndrome. Lupus, 2015, 24(3): 315-320.
[4]刘慧, 赵春梅, 龚忠诚, 等. 干燥综合征患者唇腺活检、腮腺造影及唾液腺SPECT诊断价值的比较研究. 实用口腔医学杂志,2014, 30(1): 66-69.
[5]Infante JR, Garcia L, Rayo JI, et al. Diagnostic contribution of quantitative analysis of salivary scintigraphy in patients with suspected Sjögren's syndrome. Rev Esp Med Nucl Imagen Mol,2016, 35(3): 145-151.
[6]Aksoy T, Kiratli PO, Erbas B. Correlations between histopathologic and scintigraphic parameters of salivary glands in patients with Sjogren's syndrome. Clin Rheumatol, 2012, 31(9): 1365-1370.
[7]Wu CB, Xi H, Zhou Q, et al. The diagnostic value of Technetium 99m pertechnetate salivary gland scintigraphy in patients with certain salivary gland diseases. J Oral Maxillofac Surg, 2015,73(3): 443-450.
[8]丁长伟, 刘东武, 薛红霞, 等. 干燥综合征的腮腺CT表现. 中国临床医学影像杂志, 2015, 26(5): 317-320.
[9]Sun Z, Zhang Z, Fu K, et al. Diagnostic accuracy of parotid CT for identifying Sjögren's syndrome. Eur J Radiol, 2012, 81(10): 2702-2709.
[10]白杨, 李伟雄, 张静, 等. 干燥综合征腮腺CT造影,唇腺活检与临床相关性结果对比分析. 广西医科大学报, 2014, 31(5):762-765.
[11]Kojima I, Sakamoto M, Iikubo M, et al. Diagnostic performance of MR imaging of three major salivary glands for Sjögren's syndrome.Oral Dis, 2017, 23(1): 84-90.
[12]丁长伟, 郭启勇, 邢晓菲, 等. 干燥综合征的腮腺MRI表现.中华放射学杂志, 2014, 48(5): 386-390.
[13]Yokosawa M, Tsuboi H, Nasu K, et al. Usefulness of MR imaging of the parotid glands in patients with secondary Sjögren's syndrome associated with rheumatoid arthritis. Mod Rheumatol, 2015, 25(3):415-420.
[14]韦洁勤, 张静, 陆力坚, 等. 干燥综合征腮腺导管MRS与CT及X线造影对比研究. 中国临床新医学, 2015, 8(3): 193-197.
[15]Ren YD, Li XR, Zhang J, et al. Conventional MRI techniques combined with MR sialography on T2-3D-DRIVE in Sjögren's syndrome. Int J Clin Exp Med, 2015, 8(3): 3974-3982.
[16]邢晓菲, 丁长伟. 酸刺激前后扩散加权成像评价干燥综合征患者腮腺功能. 中国临床医学影像杂志, 2016, 27(10):706-709.
[17]陈志晔, 李金锋, 马林. 干燥综合征患者腮腺扩散加权成像研究. 中国医学影像学杂志, 2013(3):181-183.
[18]Takahashi H, Tsuboi H, Yokosawa M, et al. Diffusion-weighted magnetic resonance imaging of parotid glands before and after abatacept therapy in patients with Sjögren's syndrome associated with rheumatoid arthritis: utility to evaluate and predict response to treatment. Mod Rheumatol, 2017, 19: 1-8.
[19]De Vita S, Lorenzon G, Rossi G, et al. Salivary gland echography in primary and secondary Sjögren's syndrome. Clin Exp Rheumatol, 1992, 10(4): 351-356.
[20]Zhang X, Zhang S, He J, et al. Ultrasonographic evaluation of major salivary glands in primary Sjögren's syndrome: comparison of two scoring systems. Rheumatology (Oxford), 2015, 54(9):1680-1687.
[21]Lin D, Yang W, Guo X, et al. Cross-sectional comparison of ultrasonography Sjögren's systems for primary sjogren's syndrome.Int J Clin Exp Med, 2015, 8(10): 19065-19071.
[22]Cornec D, Jousse-Joulin S, Pers JO, et al. Contribution of salivary gland ultrasonography to the diagnosis of Sjögren's syndrome: toward new diagnostic criteria? Arthritis Rheum, 2013, 65(1): 216-225.
[23]王依宁, 王学梅, 欧国成. 干燥综合征患者的颌下腺超声表现.中国超声医学杂志, 2012, 28(1): 23-26.
[24]田永梅, 张娟, 陈玉伟, 等. 干燥综合征酸刺激试验前后腮腺血流动力学变化的研究. 中国医师进修杂志, 2012, 35(22): 36-38.
[25]Giuseppetti GM, Argalia G, Salera D, et al. Ultrasonographic contrast-enhanced study of sicca syndrome. Eur J Radiol, 2005,54(2): 225-232.
[26]Knopf A, Mansour N, Chaker A, et al. Multimodal ultrasonographic characterisation of parotid gland lesions--a pilot study. Eur J Radiol, 2012, 81(11): 3300-3305.
[27]王健楠, 王学梅, 欧国成. 超声弹性成像在干燥综合征诊断中的应用价值. 中国超声医学杂志, 2013, 29(1): 10-13.
[28]王婧玲, 邓晓贵, 陈莉,等. 声辐射力脉冲成像对干燥综合征的诊断价值. 中国医学影像学杂志, 2017, 25(4): 251-254, 258.
[29]Chen S, Wang Y, Zhang G, et al. Combination of salivary gland ultrasonography and virtual touch quantification for diagnosis of Sjögren's syndrome: a preliminary study. Biomed Res Int, 2016,2016: 2793898.
[30]Hofauer B, Mansour N, Heiser C, et al. Effect of liposomal local therapy on salivary glands in acoustic radiation force impulse imaging in Sjögren's syndrome. Clin Rheumatol, 2016, 35(10):2597-2601.
[31]王健楠, 王学梅, 方毅, 等. 正常成人腮腺及颌下腺实时剪切波弹性成像的研究. 中国临床医学影像杂志, 2013, 24(8): 540-542.
[32]Wierzbicka M, Kałużny J, Ruchała M, et al. Sonoelastography--a useful adjunct for parotid gland ultrasound assessment in patients suffering from chronic inflammation. Med Sci Monit, 2014,20(20): 2311-2317.
